Reference Change Value: Uma ferramenta do laboratório para interpretar resultados de exames
Reference Change Value: A laboratory tool for interpreting test results
Flávia Martinello1, Alice Berlanda Seidler2, Mauren Isfer Anghebem3
1 Farmacêutica, Pós-doutora em Análises Clínicas, Professora do Departamento de Análises Clínicas da Universidade Federal de Santa Catarina/UFSC, Florianópolis, SC, Brasil.
2 Estudante, Graduanda em Ciências Farmacêuticas pela Universidade Federal de Santa Catarina/UFSC, Florianópolis, SC, Brasil.
3 Farmacêutica, Doutora em Ciências Farmacêuticas/Análises Clínicas, Professora Adjunta da Escola de Medicina e Ciências da Vida da Pontifícia Universidade Católica e Professora Adjunta do Departamento de Análises Clínicas da Universidade Federal do Paraná/UFPR, Curitiba, PR, Brasil.
Recebido em 03/10/2024
Aprovado em 06/10/2024
DOI: 10.21877/2448-3877.202400200.pt
INTRODUÇÃO
As etapas de um exame laboratorial são agrupadas em fases, como mostra a Figura 1, nesta ordem: Fase pré-pré-analítica, que corresponde à requisição do exame, a orientação e o preparo do paciente, ou seja, acontece fora do laboratório; Fase pré-analítica, que inclui a recepção e identificação do paciente, a coleta, o armazenamento, o transporte e o preparo da amostra; Fase analítica, que abrange a realização do exame com o respectivo controle da qualidade; Fase pós-analítica, que compreende a elaboração do laudo com respectivo comentário interpretativo que se fizer necessário, a liberação do resultado e a comunicação de valores críticos; e a Fase pós-pós-analítica, que compreende a interpretação do resultado e a tomada de decisão baseada no resultado.(1,2)
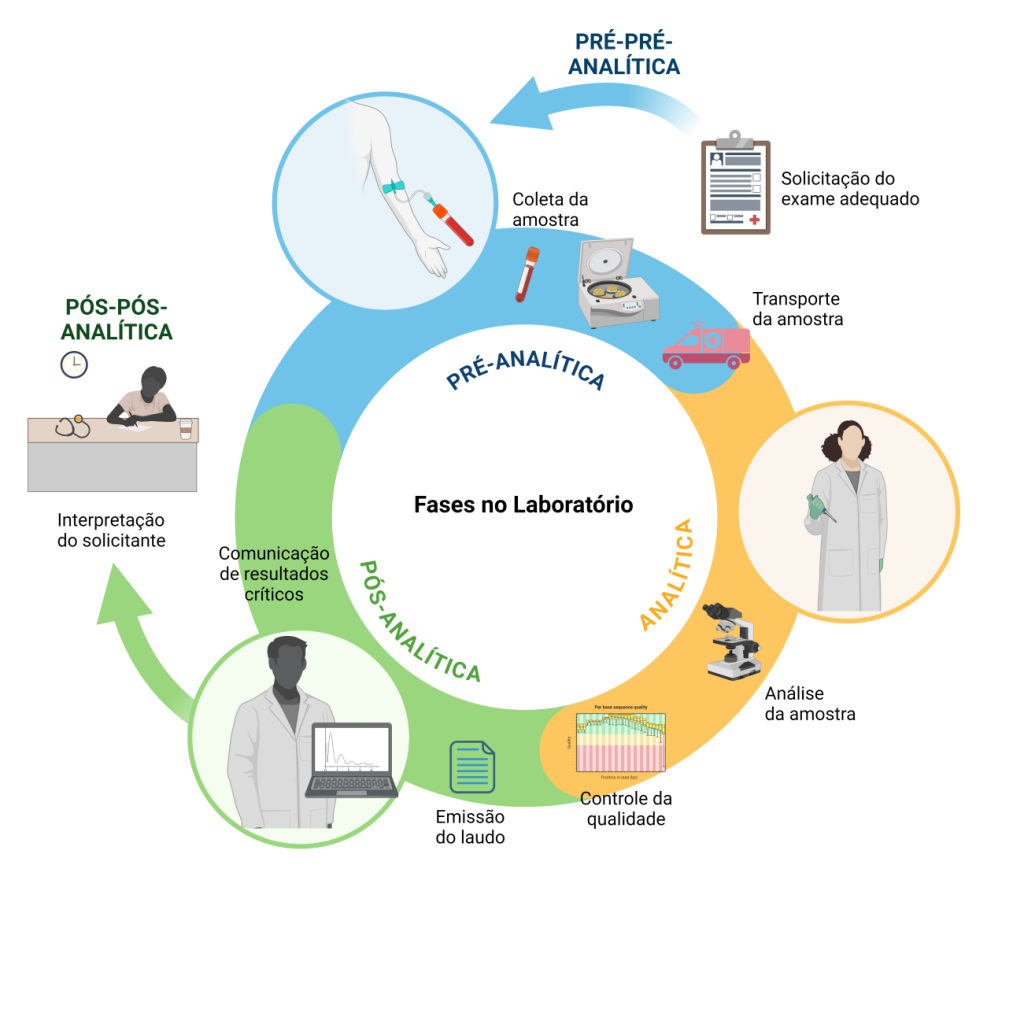
Figura 1
Etapas do processo de exame laboratorial.
Fonte: Autoras.
Os resultados quantitativos de exames laboratoriais são interpretados por comparação com valores ou intervalos de referência obtidos de uma população cujo estado de saúde é conhecido. Essas comparações podem ser transversais ou longitudinais. A comparação transversal é a comparação do resultado de um analito de um paciente com a faixa de valores desse analito obtida de um grupo de indivíduos aparentemente saudáveis. Esse tipo é conhecido como intervalos de referência “baseados na população” e é usado para diagnóstico ou rastreamento de doenças. A Figura 2 ilustra o processo de obtenção dos intervalos de referência.

Figura 2
Processo de obtenção de intervalos de referência.
Fonte: Autoras.
Os intervalos de referência convencionais baseados na população, independentemente de serem gerados por um laboratório individual ou harmonizados, são de utilidade muito limitada na avaliação dos resultados de um indivíduo na triagem ou diagnóstico, uma vez que muitos indivíduos terão valores que são altamente incomuns para eles, mas ainda estão dentro dos intervalos de referência.(3)
As comparações longitudinais são aquelas em que um valor recente de um paciente é comparado aos valores anteriores para o mesmo analito. Essa comparação pode ajudar a detectar uma alteração do estado de saúde, ou seja, é utilizada para monitoramento de pacientes. A Figura 3 ilustra, na forma de lista e gráfica, os resultados anteriores de um paciente para o analito X.
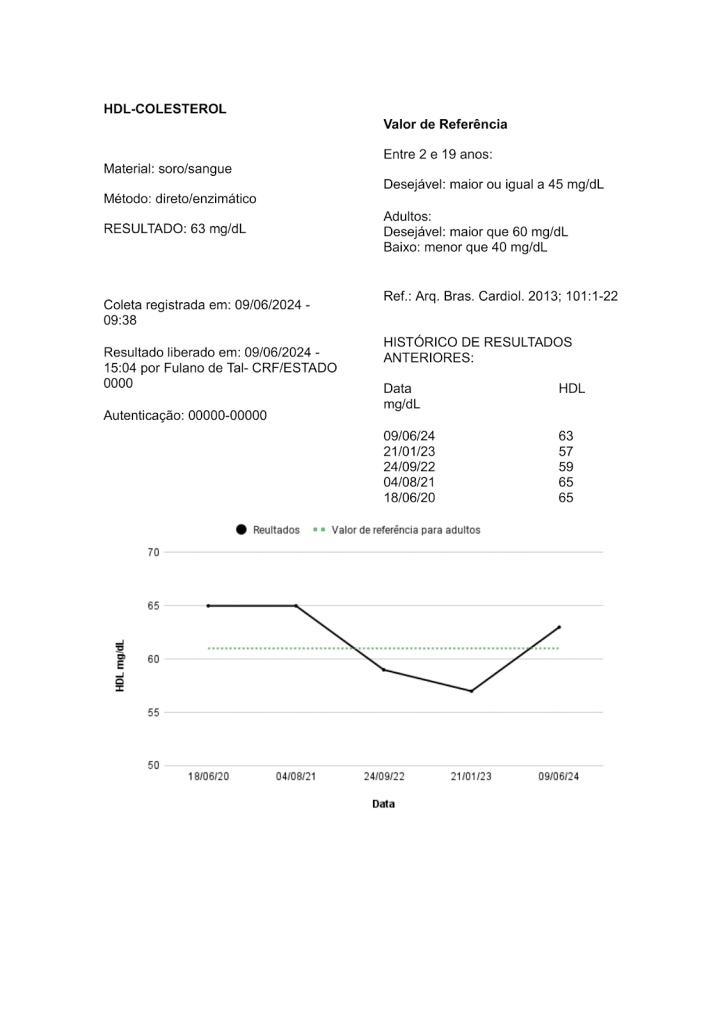
Figura 3
Parte de um laudo laboratorial apresentando o resultado atual e os resultados anteriores de um paciente na forma de lista e gráfica.
Fonte: Autoras.
A informação dos resultados anteriores do paciente no próprio laudo agrega qualidade na fase pós-analítica, pois permite que o profissional de saúde e o próprio paciente relembre o resultado anterior e conheça a evolução do marcador laboratorial. Desta forma, o laboratório está tratando o paciente como próprio indivíduo de referência e não como população (de referência). Os resultados dos exames de um paciente devem ser comparados preferencialmente com seus próprios valores de referência individualizados, ou seja, um valor de referência personalizado.(4)
Nesse contexto, vários fatores podem influenciar na variação entre resultados sequenciais de um indivíduo. Um resultado diferente do anterior pode resultar de variação pré-analítica, de variação analítica e de variação biológica.(5) É preciso ponderar sobre os três tipos de variação para poder afirmar que a modificação de um resultado, em relação a um anterior, é significativa.(3)
Dependendo da forma de estudo, a variação biológica pode ser classificada em variação biológica intrapessoal, quando se estuda a variação de resultados de um analito em um único indivíduo em situação de equilíbrio homeostático; variação biológica intraindividual, quando se estuda a variação intrapessoal de resultados de um analito em vários indivíduos em situação de equilíbrio homeostático; e variação biológica interindividual, ou variação biológica de um grupo, quando se estuda a variação de resultados de um analito entre vários indivíduos em situação de equilíbrio homeostático.(5)
A variação biológica intrapessoal, ou dentro do sujeito, que é a variação do analito em torno do ponto de ajuste homeostático do indivíduo, também é chamada variação biológica aleatória e não pode ser prevista, mas pode ser estimada por estatística apropriada.(5) A diferença entre variação biológica intrapessoal e intraindividual é a fonte dos dados usados para calcular esses parâmetros. A variação biológica intraindividual é calculada usando os resultados das variações intrapessoais de um grupo de indivíduos (população) e, portanto, não é específica para o indivíduo, enquanto variação biológica intrapessoal é obtida usando os resultados das medições repetidas do indivíduo e, portanto, é específica para o indivíduo.(5) Nos últimos anos, houve um grande progresso na metodologia de derivação, cálculo, estimativa e relato de dados de variação biológica e parâmetros derivados.(6)
A variação biológica intraindividual aleatória dos analitos não é sinônimo de ritmo fisiológico. Os ritmos fisiológicos são variações sistemáticas parcialmente previsíveis e podem ser classificadas, com base na frequência, como ultradiana (<24 horas), circadiana (aproximadamente 24 horas) e infradiana (>24 horas).(5)
Devido aos ritmos ultradianos dos analitos, a comparação de um resultado de exame laboratorial atual não pode ser feita em relação a um resultado anterior obtido de amostra coletada em momento diferente do dia, por exemplo, a coleta anterior foi no período da tarde e a atual pela manhã. Para comparações confiáveis, a fase pré-analítica deve ser padronizada, ou seja, muito semelhante, considerando horário de coleta, tempo de jejum, preparo para a coleta, procedimento de coleta, estilo de vida e outras variáveis pré-analíticas que possam afetar o resultado do exame. Além disso, em alguns casos, a amostragem no mesmo horário por dias consecutivos pode não ser suficiente para eliminar variações infradianas, como lipídios, vitamina D, cálcio etc., especialmente se o intervalo de tempo entre medições consecutivas se aproximar dos períodos infradianos do exame.(5)
A Figura 4 ilustra a variação biológica intrapessoal, intraindividual e interindividual de um analito bioquímico.
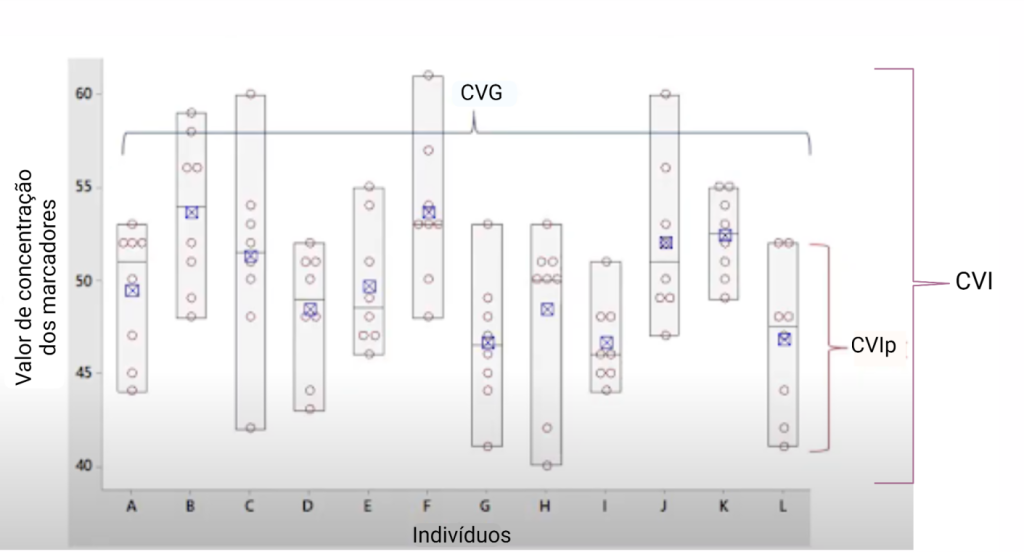
Figura 4
Os componentes da variação biológica de um analito: variação biológica intrapessoal, intraindividual e interindividual.
Legenda CVIp: Coeficiente de variação biológica intrapessoal. CVI: Coeficiente de variação biológica intraindividual. CVG: Coeficiente de variação biológica interindividual (do grupo). Fonte: Adaptado de Johnson, 2020.(7)
A Federação Europeia de Medicina Laboratorial (EFLM) disponibiliza esses dados de variação biológica (%) em indivíduos saudáveis, após avaliação da qualidade dos estudos, gratuitamente, para usuários em todo o mundo.(6)
Além disso, também há estudos que relatam a variação biológica (%) de alguns analitos em indivíduos em certos estados de doença. No entanto, para uma série de analitos, não há dados ou são limitados.(8,9)
A informação da variação biológica interindividual é utilizada indiretamente para interpretar resultados de exames laboratoriais, pois é utilizada para calcular o índice de individualidade de um analito. A razão entre a variação biológica intraindividual (CVI) e a interindividual (CVG) é chamada de índice de individualidade (II).(6) Na maioria dos indivíduos, a variação da concentração de um analito ao longo do tempo é menor que a dispersão do intervalo de referência, ou seja, a variação biológica intraindividual é geralmente menor que a variação biológica interindividual, o que gera um II menor que um (1,0).(10)
Se o II for abaixo de 0,6, o analito apresenta alta individualidade, e isto significa que a variação entre os resultados do indivíduo é pequena em relação à faixa do intervalo de referência, tornando este último pouco útil para a interpretação dos resultados, pois a variação do indivíduo não é visível na faixa do intervalo de referência populacional. Nesses casos, existe o risco de se considerar o resultado do indivíduo como uma variação fisiológica normal, quando os valores do analito estão significativamente longe de seu ponto de ajuste homeostático, mas ainda incluídos no intervalo de referência.(11,12) Por outro lado, se o II for acima de 1,4, o analito apresenta baixa individualidade e a dispersão de valor em cada indivíduo cobre a maior parte da dispersão entre os indivíduos que são representados pelo intervalo de referência, tornando-o uma ferramenta útil para a interpretação do teste. Em termos gerais, a utilidade do intervalo de referência populacional para monitorar pacientes é limitada quando o II for inferior a 0,6 e aceitável quando o II for maior que 1,4. Para um analito com II entre 0,6 e 1,4, a utilização dos intervalos de referência populacionais fica a critério clínico.⁽¹³⁾
Por exemplo, a hemoglobina glicada é um analito que possui uma individualidade alta (II = 0,16), ou seja, o intervalo de referência (IR) é pouco útil, pois a variação do indivíduo não é visível na faixa do IR. Por outro lado, o pH sanguíneo é um parâmetro com pouca individualidade (1,75), ou seja, o intervalo de referência (IR) é bastante útil, pois uma pequena variação do indivíduo se torna visível na faixa do IR.
Por fim, a variação analítica do método escolhido para medida do analito também é uma variável que pode influenciar na interpretação de resultados laboratoriais consecutivos, e é uma informação que só o laboratório possui. A variação analítica, também chamada de precisão analítica, representa a dispersão dos resultados da amostra controle no controle interno da qualidade do exame laboratorial. A precisão do método é calculada pelo desvio padrão da média dos resultados e expresso em termos percentuais como coeficiente de variação (CV) da média.
Considerando que as informações sobre o desempenho analítico dos métodos (precisão) são informações exclusivas dos laboratórios, os profissionais de laboratório podem participar ativamente de estratégias para melhorar a experiência do paciente em cuidados de saúde, desenvolvendo e contribuindo para informações de alta qualidade para permitir a comunicação e interpretação oportunas e significativas dos resultados dos testes.⁽¹⁴⁾
RCV – Reference Change Value
Considerando o uso dos intervalos de referência tradicionais, os resultados de um analito de um indivíduo podem mudar de dentro do intervalo para fora (e vice-versa) sem significância, provavelmente estimulando alguma atividade clínica desnecessária, mesmo que seja apenas a solicitação de repetição do teste.
Uma maneira muito melhor de monitorar indivíduos é usar o RCV, do inglês reference change value, traduzido para o português como diferença crítica ou valor de referência para alteração ou valor de referência mudança.⁽³⁾ O RCV foi introduzido por Harris e Yasaka⁽¹⁵⁾ em 1983 e é definido como a diferença estatisticamente significativa existente entre dois resultados do mesmo indivíduo, levando em consideração o erro de medida. Assim, o RCV é uma ferramenta para avaliação da significância da diferença entre resultados seriados de um indivíduo.⁽¹⁶⁾ Para concluir que a diferença entre dois resultados seguidos é significativa e pode ser biologicamente relevante (alteração do estado de saúde), a diferença deve ser maior que o RCV, por isso chamada de diferença crítica.⁽¹⁰⁾
A fórmula para definição do RCV de cada analito, dependente da variação analítica do método laboratorial em uso e do CVI, segundo Fraser e Harris (1989)⁽¹⁷⁾ é:
RCV = 21/2x Z x (CVA2 + CVI2)1/2
onde CVA é o coeficiente de variação analítica do método de medida do analito em questão, CVI é o coeficiente de variação biológica intraindividual, e Z = 1,65 para p < 0,1 ou 1,96 para p <0,05 ou 2,33 para p < 0,01.
Considerando que o cálculo do RCV foi inicialmente proposto para medidas com distribuição simétrica ou gaussiana (também chamada normal), ao longo dos anos, outros autores defenderam que a abordagem de conversão do RCV em logaritmo natural (ln-RCV) deveria ser usada principalmente quando os valores medidos são considerados normalmente distribuídos quando estes são transformados em ln. Assim, outros modos de calcular o RCV surgiram para medidas com distribuição assimétrica.⁽11,18⁾
Com o enfoque assimétrico, o desvio (σ) da distribuição log-normal do coeficiente de variação total (CVT) é calculado pela fórmula:
σ = [ln((CVT/100)2 + 1)]1/2
onde CVT=[(CVI2 + CVA2)]1/2
Esta abordagem resulta em limites de RCV assimétricos. O limite assimétrico da diferença crítica para aumento (RCV positivo) e para o declínio (RCV negativo) de resultado laboratorial é determinado pelas fórmulas, respectivamente:
RCV pos = [exp(1,96 x 21/2 x σ) – 1] x 100
RCV neg = [exp(-1,96 x 21/2 x σ) – 1] x 100
Na prática, a diferença é que o resultado do RCV simétrico gera apenas um valor como diferença crítica e o do RCV assimétrico gera dois, um que deve ser superado quando há um aumento do resultado e outro quando há uma diminuição do resultado paciente. Quando os CVT são < 5-10% as fórmulas simétricas e assimétricas apresentarão resultados semelhantes, como ilustrado no exemplo prático adiante.
Independentemente da fórmula escolhida, utiliza-se o coeficiente de variação biológica intraindividual do banco de dados do EFLM (https://biologicalvariation.eu/), quando não se conhece o coeficiente de variação biológica intrapessoal.
Contudo, o próprio banco de dados do EFLM funciona inicialmente com a busca pelo analito (que deve ser inserido em língua inglesa), em seguida são mostrados os dados de variação biológica do analito e a opção para selecionar o cálculo do RCV (Figura 5). Para o cálculo você deve inserir o CVA do analito do seu laboratório e automaticamente o RCV assimétrico será apresentado.
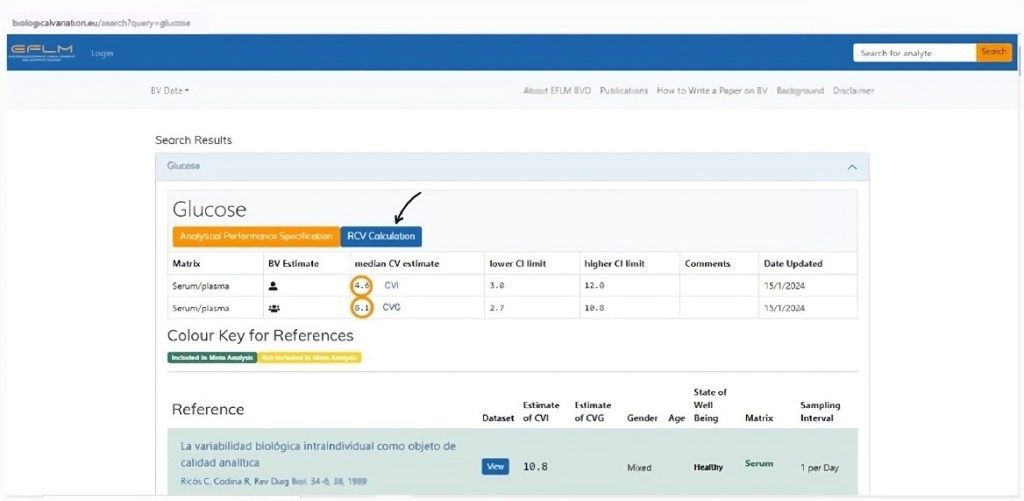
Figura 5
Site da base de dados de variação biológica da Federação Europeia de Medicina Laboratorial (EFLM).
Legenda: Os círculos alaranjados indicam o CVI e o CVG do analito pesquisado. A seta preta indica o local para acesso ao cálculo do RCV do analito considerando o CVA do próprio laboratório. Fonte: https://biologicalvariation.eu/search?query=glucose
Além disso, é importante perceber que, embora o CVI possa ser assumido como constante, pois não muda com frequência, o CVA (imprecisão analítica) varia de laboratório para laboratório e de método para método. A Tabela 1 mostra que o RCV depende do CVA e que a relação não é linear, com exemplo para a glicemia capilar, considerando um CVI hipotético de 3,8% e intervalo de confiança de 95% (z = 1,65).
Tabela 1: RCV para glicemia capilar, considerando um coeficiente de variação biológica intraindividual (CVI) hipotético de 3,8% em diferentes níveis de imprecisão analítica (p<0,05).
| Imprecisão (CVA, %) | RCV (%) |
| 1,0 | 9,2 |
| 2,0 | 10,0 |
| 3,0 | 11,3 |
| 4,0 | 12,9 |
| 5,0 | 14,7 |
| 6,0 | 16,6 |
Além disso, alguns estudos apresentam o RCV utilizado no laboratório como diferença crítica para liberação automática, ou não, de resultados de pacientes com base em resultados anteriores, também chamado de delta-check.(19,20) Contudo, cabe lembrar que cada laboratório tem seu RCV de cada analito, pois depende da variação analítica laboratorial. Como ilustração, a influência da variação analítica é apresentada na Tabela 2,⁽¹²⁾ que mostra a probabilidade de uma modificação de 15% no resultado de colesterol total (CVI 6%), em relação a um resultado anterior, ser significativa dependendo do CVA.
Tabela 2: Probabilidade de uma modificação de 15% no resultado de colesterol total ser significativa em diferentes níveis de imprecisão analítica.
| Imprecisão (CVA, %) | Probabilidade de mudança significativa (%) |
| 2,0 | 95 |
| 4,0 | 93 |
| 6,0 | 90 |
| 8,0 | 86 |
| 10 | 82 |
CVA: coeficiente de variação analítica. Fonte: Fraser, 2012.⁽¹²⁾
Na prática, ainda, muitas vezes mais de dois resultados sequenciais estão disponíveis para um indivíduo e é possível calcular a significância das mudanças entre cada uma das duas medições consecutivas.⁽²¹⁾
EXEMPLO PRÁTICO
Considerando um CVA hipotético para a análise de glicemia de 4% e um CVI hipotético de glicemia capilar de 3,8%, o RCV simétrico seria calculado como sendo:
Diferença crítica com 90% de confiança:
RCV = 21/2x Z x (CVA2 + CVI2)1/2
RCV = 1,414 x 1,65 x (42 + 3,82)1/2
RCV = 12,9%
Diferença crítica com 95% de confiança:
RCV = 21/2x Z x (CVA2 + CVI2)1/2
RCV = 1,414 x 1,96 x (42 + 3,82)1/2
RCV = 15,3%
Diferença crítica com 99% de confiança:
RCV = 21/2x Z x (CVA2 + CVI2)1/2
RCV = 1,414 x 2,58 x (42 + 3,82)1/2
RCV = 20,1%
As diferentes probabilidades (Z) na confiança da diferença crítica significam que quanto mais o profissional de saúde quer confiar no RCV, maior ele será.
Para o cálculo do RCV assimétrico deve-se calcular o CVT, em valores decimais:
CVT=[(CVI2 + CVA2)]1/2
CVT=[(3,82 + 42)]1/2
CVT=[(14,44 + 16)]1/2
CVT=[30,44]1/2
CVT=5,517%
E o desvio do CVT deve ser calculado como:
σ = [ln((CVT/100)2 + 1)]1/2
σ = [ln(0,05522 + 1)]1/2
σ = [ln(0,05522 + 1)]1/2
σ = [ln(0,003 + 1)]1/2
σ = [ln(1,003)]1/2
σ = [0,00299]1/2
σ = 0,0547
O RCV assimétrico, ou seja, a diferença considerada crítica para aumento no resultado deve ser calculado como sendo:
RCV pos = [exp(1,96 x 21/2 x σ) – 1] x 100
RCV pos = [exp(1,96 x 1,414 x 0,0547) – 1] x 100
RCV pos = [exp(0,1516) – 1] x 100
RCV pos = [1,1636 – 1] x 100
RCV pos = [0,1636] x 100
RCV pos = 16,36%
E a diferença considerada crítica para redução do resultado como:
RCV neg = [exp(-1,96 x 21/2 x σ) – 1] x 100
RCV neg = [exp(-1,96 x 1,414 x 0,0547) – 1] x 100
RCV neg = [exp(-0,1516) – 1] x 100
RCV neg = [0,8593 – 1] x 100
RCV neg = [-0,1406] x 100
RCV neg = -14,06%
Perante uma situação hipotética de um paciente que há 3 meses apresentou glicemia de 152mg/dL e iniciou tratamento hipoglicemiante oral com dose diária de 2,5mg de glibenclamida e retornou para realização de novo exame e apresentou resultado de 133mg/dL (redução de 12,5%), questiona-se: essa redução é significativa? Considerando o RCV calculado, simétrico e assimétrico, a redução não é significativa, pois a diferença deve ser maior que 15,3% ou 14,06%. Ou seja, inicialmente deve-se avaliar a adesão do paciente ao tratamento medicamentoso. Se observada a adesão, o tratamento medicamentoso deve ser complementado com tratamento não medicamentoso, com introdução de atividade física e/ou dieta, ou deve ser modificada a dose diária do medicamento.
Desta forma tem-se uma interpretação personalizada dos resultados do paciente, com base em dados da variação biológica intraindividual e dados do laboratório, como resultado anterior e coeficiente de variação analítica.
PERSPECTIVAS
O intervalo de referência baseado no modelo homeostático pode ser calculado usando os resultados de exames anteriores de um indivíduo obtidos em uma situação de estado clínico de equilíbrio, ou seja, conhecendo-se a variação biológica intrapessoal. Com o desenvolvimento da tecnologia da informação, os laboratórios possuem os dados de milhões de pacientes, permitindo a implementação do diagnóstico laboratorial personalizado.(4) Aplicativos para o cálculo do próprio intervalo de referência, com base em resultados anteriores do indivíduo, já estão sendo desenvolvidos por alguns grupos de pesquisa.(6) A aplicação do intervalo de referência próprio para cálculo do RCV personalizado pode ser considerada o elemento essencial da medicina laboratorial preditiva, preventiva e particularmente personalizada. Com a disseminação do conhecimento, os laboratórios poderão apresentar o RCV personalizado no laudo do paciente.
LIMITAÇÕES
Fraser (2012)⁽¹²⁾ relata algumas desvantagens no uso do RCV como a possibilidade de que a) as informações estatísticas sobrecarreguem os profissionais, b) o uso do escore Z obscurece o julgamento clínico, c) o RCV pode depender da frequência do exame, d) alguma variação biológica pode depender do estado de saúde, e) a aplicação adequada requer um sofisticado sistema de gerenciamento de informações laboratoriais, f) é necessária educação da equipe de laboratório e clínicos, e g) a terminologia pode ser confusa.
Outros autores relatam que é necessário cautela no uso do RCV de marcadores tumorais para orientar decisões médicas.⁽9.22⁾ Rossum e colaboradores (2022)⁽22⁾ alegam que os estudos de variação biológica são realizados em voluntários saudáveis, normalmente apenas na idade adulta, e mesmo aqueles realizados em estado de doença, nos casos de câncer, sofrem interferência da dinâmica do marcador tumoral que é altamente dependente do tipo de tumor, estágio do tumor, tratamento utilizado, meia-vida do biomarcador etc. Além disso, outra limitação do uso do RCV para marcadores tumorais é que a mudança significativa, baseada em probabilidade estatística (Z), não é de interesse do clínico, que precisa de níveis de decisão médica baseada na probabilidade de um paciente ter uma resposta, ou não, ao tratamento, probabilidade de recorrência do câncer após tratamento curativo ou probabilidade de resistência ao tratamento após resposta inicial.⁽22⁾
CONSIDERAÇÕES FINAIS
Nesta revisão, resumimos a aplicação da variação biológica para uso do RCV e a utilização do RCV como apoio na interpretação de resultados laboratoriais consecutivos. Cada indivíduo possui um intervalo “próprio” de valores que abrange apenas uma parte do intervalo de referência comum. Consequentemente, os indivíduos podem ter alterações significativas nos seus resultados e não serem percebidas, pois serão consideradas normais quando avaliadas pelo valor de referência comum. O conhecimento e o uso do RCV auxiliam nesta problemática. No entanto, os dados de variação biológica têm limitações baseadas nas características da população que foi estudada, o que sugere a abordagem do intervalo de referência próprio.
O uso do RCV deve ser tão utilizado quanto os intervalos de referência de base populacional em laboratórios clínicos. O RCV deve estar disponível como uma ferramenta para a tomada de decisão clínica, especialmente no monitoramento de indivíduos.
REFERÊNCIAS
- Tate JR, Johnson R, Barth J, Panteghini M. Harmonization of laboratory testing – Current achievements and future strategies. Clinica Chimica Acta. 2014 May;432:4-7. doi: 10.1016/j.cca.2013.08.021.
- Tan JG, Omar A, Lee WB, Wong MS. Considerations for Group Testing: A Practical Approach for the Clinical Laboratory. The Clinical Biochemist Reviews. 2020 Dec;41(3):79-92. doi: 10.33176/AACB-20-00007.
- Fraser CG. Valores de mudança de referência: o caminho a seguir no monitoramento. Annals of Clinical Biochemistry. 2009 Mar 5;46(3):264-265. doi: 10.1258/acb.2009.009006.
- Coskun A, Sandberg S, Unsal I, Serteser M, Aarsand AK. Personalized reference intervals: from theory to practice. Critical Reviews in Clinical Laboratory Sciences. 2022 May 17;1-16. doi: 10.1080/10408363.2022.2070905.
- Coskun A, Zarepour A, Zarrabi A. Physiological Rhythms and Biological Variation of Biomolecules: The Road to Personalized Laboratory Medicine. International Journal of Molecular Sciences. [Internet]. 2023 Mar 27 [cited 2023 Nov 8];24(7):6275. https://doi.org/10.3390/ijms24076275.
- Sandberg S, Carobene A, Bartlett B, Coskun A, Fernandez-Calle P, Jonker N et al.. Biological variation: recent development and future challenges. Clinical Chemistry and Laboratory Medicine. 2022 Dec 20;61(5):741-50. doi: 10.1515/cclm-2022-1255.
- Johnson P. Setting Analytical Quality Goals with Biological Variation Data. Pearls of Laboratory Medicine. Clinical Chemistry Contents. American Association of Clinical Chemistry: Better health through laboratory medicine. doi: 10.15428/CCTC.2019.310276 Disponível em: https://www.youtube.com/watch?v=MjIbHq6pMCI. Acesso em: 13/03/2024.
- Ricós C, Álvarez V, Perich C, Fernández-Calle P, Minchinela J, Cava F, Biosca C et al.. Rationale for using data on biological variation. Clinical Chemistry and Laboratory Medicine. 2015 [cited 2024 Sep 16];53(6).
- Dittadi R, Fabricio A, Gion M. Biological variation and reference change value as decision criteria in clinical use of tumor biomarkers. Are they really useful? Clinical Chemistry and Laboratory Medicine. 2022 Mar;60(6)e136-e137.
- Badrick T. Biological variation: Understanding why it is so important? Practical Laboratory Medicine.2021 Jan 4;23:e00199. doi: 10.1016/j.plabm.2020.e00199.
- Fraser CG. Making better use of differences in serial laboratory results. Annals of Clinical Biochemistry. 2012 Jan;49(Pt 1):1-3. doi: 10.1258/acb.2011.011203.
- Fraser C. Reference change values. Clinical Chemistry and Laboratory Medicine. 2012 May;50(5): 807-812. doi: 10.1515/cclm.2011.733
- Braga F, Panteghini M. Generation of data on within-subject biological variation in laboratory medicine: an update. Critical Reviews in Clinical Laboratory Sciences. 2016 Mar;53(5):313-25. doi: 10.3109/10408363.2016.1150252
- Klatt EC. Cognitive factors impacting patient understanding of laboratory test information. Journal of Pathology Informatics. 2024 Dec 1;15:100349. doi: 10.1016/j.jpi.2023.100349.
- Harris EK, Yasaka T. On the calculation of a “reference change” for comparing two consecutive measurements. Clinical Chemistry, v. 29, n. 1, p. 25-30, 1983 Jan.
- Åsberg A, Lian IA, Odsæter IH, Mikkelsen G. Testing the limits: the diagnostic accuracy of reference change values. Scandinavian Journal of Clinical and Laboratory Investigation. 2021 Mar;81(4):318-323. doi: 10.1080/00365513.2021.1904517.
- Fraser CG, Harris EK. Generation and application of data on biological variation in clinical chemistry. Critical Reviews in Clinical Laboratory Sciences. 1989 Jan;27(5):409-37. doi: 10.3109/10408368909106595.
- Fokkema MR, Herrmann Z, Muskiet FA, Moecks J. Reference change values for brain natriuretic peptides revisited. Clinical Chemistry. 2006 Aug;52(8):1602-3. doi: 10.1373/clinchem.2006.069369.
- Feitosa MS, Bücker DH, Santos SME, Vasconcellos LS. Implementation of criteria for automatic release of clinical chemistry test results in a laboratory at an academic public hospital / Implantação de critérios de liberação automática de resultados de bioquímica em um laboratório de hospital público universitário. Jornal Brasileiro de Patologia e Medicina Laboratorial. 2016 May;52(3): 149-156.
- Fernandez DC, Avinash SS, Malathi M, Shivashankara AR, Kumar A, Fernandez PA. Establishing the reference change values (RCVs) and validating the delta check auto-verification in a clinical biochemistry laboratory. Muller Journal of Medical Sciences and Research. 2017 Jan-Jun;8(1):p 42-46, doi: 10.4103/0975-9727.199363.
- Jones GR, Chung JZ. Cálculo de valores de mudança de referência usando mais de dois resultados é uma tarefa difícil: uma resposta. Annals of Clinical Biochemistry. 2017 May;54(3):414-415. doi: 10.1177/0004563217690177.
- Rossum H, Meng Q, Ramanathan L, Holdenrieder S. A word of caution on using tumor biomarker reference change values to guide medical decisions and the need for alternatives. Clinical Chemistry and Laboratory Medicine. 2021 Oct;60(4): 553-555. doi: 10.1515/cclm-2021-0933.
Correspondência
Flávia Martinello
E-mail: [email protected]
