Principais métodos clássicos de coloração em bacteriologia: aplicações, técnicas, fundamentos e limitações
Main classical staining methods in bacteriology: applications, techniques, principles, and limitations
Renata Garcia Costa1, Wagner Thadeu Cardoso Esteves2, Joseli Maria da Rocha Nogueira1
1 Fundação Oswaldo Cruz, LabMicro – Departamento de Ciências Biológicas – Rio de Janeiro, RJ, Brasil.
2 Fundação Oswaldo Cruz, Setor de Campylobacter – Laboratório de Zoonoses – IOC – Rio de Janeiro, RJ, Brasil.
Recebido em 25/09/2024
Aprovado em 09/10/2024
DOI: 10.21877/2448-3877.202400198.pt
INTRODUÇÃO
Em microbiologia, métodos de coloração podem ser utilizados para auxiliar a identificação de microrganismos, possibilitando muitas vezes um diagnóstico presuntivo e precoce na sua classificação. Estes métodos são baseados nas características citomorfotintoriais, ou seja, composição e morfologia celular e afinidade pelos corantes, em que as estruturas podem ser visualizadas e diferenciadas com auxílio de microscópio.(1)
Particularmente, as bactérias são naturalmente transparentes e possuem um índice de refração semelhante ao meio circundante, tornando-as translúcidas quando observadas ao microscópio de luz. Desta forma, faz-se necessária a utilização de corantes para aumentar o contraste entre as células bacterianas em relação ao fundo, facilitando a visualização.(2,3)
Alguns métodos servem de aporte para a diferenciação de microrganismos e estruturas bacterianas baseando-se nas características estruturais e químicas, sendo muitas vezes essenciais para orientação do diagnóstico clínico assim como em atividades de pesquisa associadas à Saúde Única e outras vertentes. Essas técnicas padronizadas não só facilitam a identificação rápida e precisa de patógenos em amostras clínicas, mas também são essenciais para estudos que exploram a morfologia, distribuição e interações microbianas.(4)
Os processos de coloração utilizados em bacteriologia podem ser classificados como: Colorações simples e diferenciais.(5)
As primeiras englobam as metodologias em que se usa apenas um corante como contraste, como por exemplo azul de metileno, cristal violeta e carbol-fucsina, com a finalidade de tornar mais visíveis as formas e arranjos celulares. O uso de um simples corante pode revelar diferenças estruturais internas, dependendo da bactéria, como por exemplo o uso do azul de metileno, capaz de revelar os grânulos de volutina produzidos por Corynebacterium diphteriae, permitindo a visualização dos corpúsculos metacromáticos corados de vermelho frente ao corpo bacilar corado de azul(6). Acrescente-se que, colorações simples também podem incluir algumas colorações especiais, idealizadas para evidenciar estruturas específicas da célula bacteriana, como esporos, flagelos, ou revelar a presença de cápsulas, aspectos que serão abordados com mais propriedade no decorrer deste artigo.(5,7)
Em contrapartida, as colorações diferenciais são técnicas mais especializadas em que são utilizados diferentes corantes, mordentes e reveladores que permitem distinguir as estruturas celulares com base nas suas propriedades químicas, como as técnicas de coloração de Gram e coloração de Ziehl-Neelsen, consideradas ferramentas essenciais no diagnóstico laboratorial de microrganismos de importância clínica,(7-9) mas que também podem ser usadas em pesquisas associadas à Saúde Única.
Embora existam na atualidade inúmeros testes fenotípicos e genotípicos para a identificação de microrganismos, os avanços na área de diagnóstico não substituem os métodos clássicos, pois estes ainda representam uma ferramenta valiosa de baixo custo, que fornece informações necessárias e básicas para identificação bacteriana, podendo em alguns casos até substituir, de forma rápida, exames mais complexos para a obtenção de um diagnóstico, como em quadros de difteria, meningite, tuberculose, hanseníase e algumas infecções sexualmente transmissíveis.(10-14)
OBJETIVO
Com base na importância desse tema, este artigo teve como objetivo realizar uma revisão narrativa mostrando o “estado da arte” associado às principais técnicas de coloração utilizadas na área de bacteriologia, destacando suas aplicações práticas e contribuições para a detecção dos microrganismos em diferentes contextos científicos e clínicos, pois acredita-se que esses assuntos são a base para o conhecimento da prática de bacteriologia e podem agregar informações pertinentes sobretudo para os alunos da área da Saúde, como um compilado para estudos acadêmicos.
METODOLOGIA
Segundo Rother,(15) os artigos de revisão narrativa são publicações amplas, adequadas para delinear e tratar o desenvolvimento ou o “estado da arte” de determinado assunto, sob o ponto de vista teórico ou contextual, não necessitando informar a metodologia para busca das referências, nem os critérios utilizados na avaliação e seleção dos trabalhos. Consistem, basicamente, de análise da literatura publicada em livros, artigos de revista impressas e/ou eletrônicas na interpretação e análise crítica pessoal dos autores. Todavia, optamos por indicar o critério que escolhemos, que tomou por base a pesquisa em livros de microbiologia disponíveis no Departamento de Ciências Biológicas – ENSP/FIOCRUZ, Acervo da Biblioteca de Manguinhos/FIOCRUZ e artigos científicos na Word Wid Web, utilizando os descritores informados.
MÉTODOS DE COLORAÇÃO UTILIZADOS EM BACTERIOLOGIA
Técnica de coloração de Gram
A coloração de Gram é a técnica diferencial mais utilizada na rotina laboratorial clínica em bacteriologia. Sua finalidade está na classificação de microrganismos quanto a suas bases tintoriais, tamanho, forma e arranjo celular.(1) A técnica de coloração de Gram foi idealizada pelo médico dinamarquês Hans Christian Joachim Gram(2) em 1884. O método consiste em submeter um esfregaço bacteriano, fixado pelo calor, a uma série sucessiva de corantes, permitindo diferenciar os microrganismos com base na composição química e integridade das paredes celulares(2) em dois grandes grupos: Gram-positivos e Gram-negativos. O principal componente da parede celular é o peptideoglicano, também conhecido como glicopeptídeo ou mureína, um biopolímero constituído de cadeias alternadas de N-acetilglucosamina (GlcNAc) e N-acetilmurâmico, que conferem rigidez à célula bacteriana (MurNAc).(7)
A célula Gram-positiva apresenta uma parede celular basicamente constituída de peptideoglicano e ácido teicoico, enquanto a Gram-negativa é um pouco mais complexa, pois apresenta uma camada tênue de peptideoglicano e uma porção externa de composição lipopolissacarídica e lipoproteínas (Figura 1 e Figura 2).
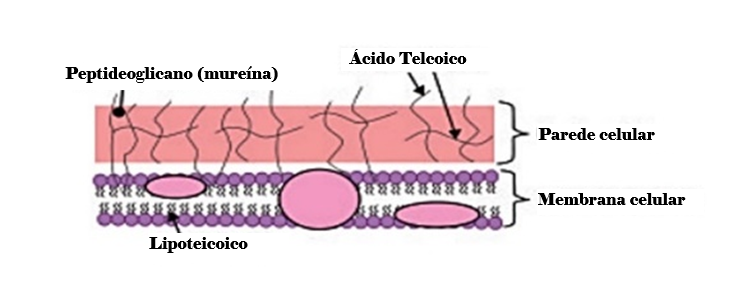
Figura 1
Estrutura básica da parede celular Gram-positiva(5)
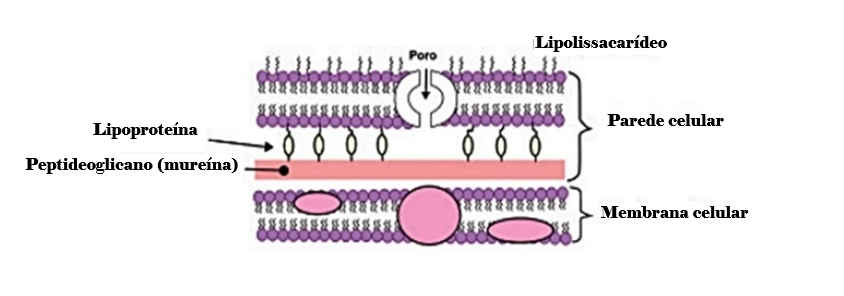
Figura 2
Estrutura básica da parede celular Gram-negativa(5)
No método clássico de coloração de Gram, um esfregaço delgado, homogêneo e seco de uma cultura bacteriana ou de um material clínico é tratado com um corante primário (cristal violeta fenicado) por 1 minuto, que penetra na parede celular e no protoplasma celular. Em sequência, utiliza-se a solução de Lugol (solução iodo-iodetada) por 1 minuto, que age como mordente, formando um complexo corante-iodo, insolúvel em água, denominado iodo-pararosanilina. Até esta etapa, tanto bactérias Gram-positivas quanto as Gram-negativas absorvem de forma idêntica o corante primário e o fixador, adquirindo inicialmente uma coloração violeta. Na sequência, é realizado o tratamento com um solvente orgânico (álcool- acetona) por 30 segundos, que tem função de descorar. Após esta etapa, a lâmina é submetida a uma lavagem com água (etapa obrigatória) para a retirada do excesso de resíduo do corante e, em seguida, coberta com fucsina de Ziehl diluída 1/10 (corante secundário) por 30 segundos, que tem a função de revelador.(2) Após todo o processo, a lâmina deve ser seca e observada no microscópio luminoso em objetiva de imersão 100X.(7)
É importante ressaltar que a solução descorante vai atuar de forma distinta de acordo com as características estruturais e diferentes graus de permeabilidade da parede celular. Em Gram-positivas, este solvente promove a contração dos poros do peptideoglicano, retendo o corante primário e mantendo-se corada de roxo (Figura 3a). No entanto, nas Gram-negativas, o solvente dissolve a porção lipídica (lipopolissacarídeos e lipoproteínas) da membrana externa, removendo o complexo cristal violeta-iodo, assumindo a coloração do corante secundário (fucsina ou safranina), revelando desta forma a coloração vermelha (Figura 3b).(9,7) A diferença geral observada nas tonalidades existe por uma divergência nas propriedades físicas e químicas das paredes celulares bacterianas, como composição, espessura, densidade, porosidade e integridade.(7,16,17)
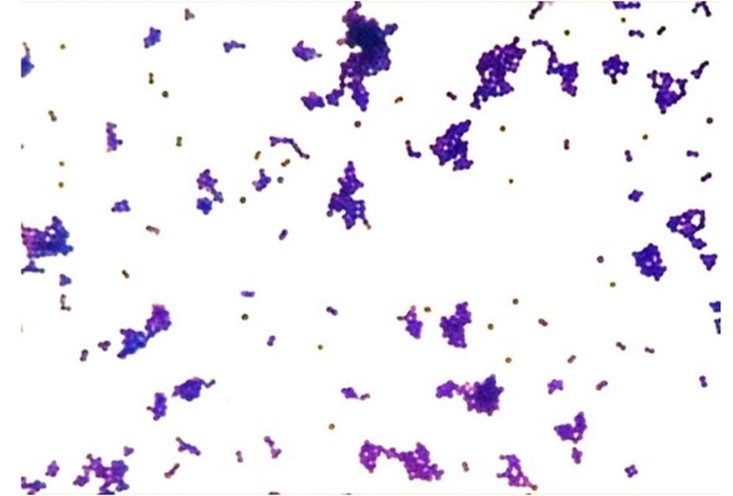
Figura 3a
Característica tintorial de Gram-positiva (DCB, FIOCRUZ, 2024)
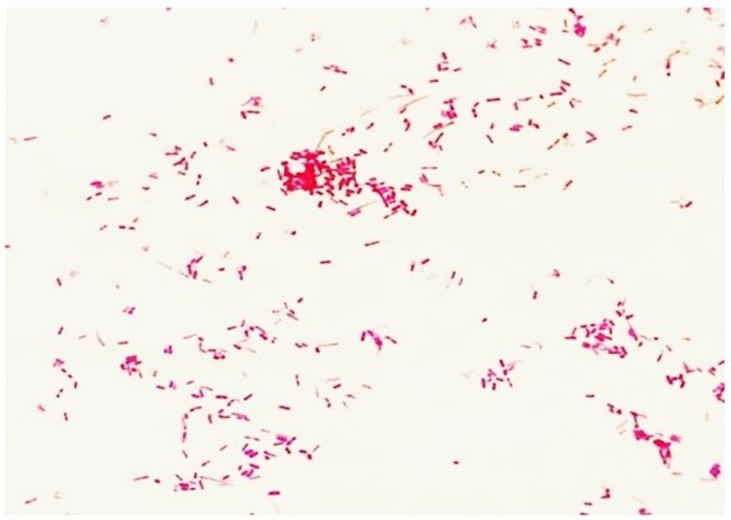
Figura 3b
Característica tintorial de Gram-negativa (DCB, FIOCRUZ, 2024)
Na literatura, alguns estudos sugerem métodos alternativos, indicando modificações e adaptações da técnica. Algumas variações estão relacionadas com alterações nas concentrações de corante, troca de reagentes, e modificações em relação ao tempo de exposição ao corante. Isto foi inicialmente embasado nos artigos de Lellis e colaboradores (2019),(18) que apontaram o potencial de toxicidade, carcinogênico e recalcificante dos corantes e o impacto para o ambiente e saúde humana devido ao descarte indevido após o uso em técnicas laboratoriais.(19)
No âmbito laboratorial, Reine e colaboradores(19) foram favoráveis à substituição dos métodos de Gram e Wirtz-Conklin clássicos (em superfície da lâmina) pelo método de imersão das lâminas em corante, comprovando sua aplicabilidade para a coloração de muitas lâminas em uma única vez, sem comprometer a confiabilidade dos resultados, evitando a saturação das soluções após muitas passagens de lâminas, o desperdício de corante e consequentemente reduzindo gastos para a realização da técnica.
Atualmente existe a recomendação de substituição do cristal violeta por violeta de metila, tendo por base sua composição química que age como fixador, não sendo necessária, então, a fixação do esfregaço em chama, que atualmente caiu em desuso e é contraindicada. Outra alteração é a substituição da solução de álcool- acetona utilizada por Hurk, pelo álcool etílico 99,5°GL, pois este é considerado mais seguro e com menos potencial de toxicidade para o manipulador, além de evitar hiperdescoloração da lâmina e tornar a técnica mais reprodutível. No entanto, a modificação mais importante foi a substituição da fucsina fenicada, utilizada como corante secundário, pela safranina. Esta modificação foi baseada em estudos relacionados ao espectro de cor, comprovando que o uso da safranina possibilita uma maior distinção e nitidez entre as bactérias Gram-negativas e Gram-positivas, por se distanciar mais da cor do corante primário, quando comparado à fucsina, em que as Gram-negativas assumem a coloração vermelho-claro e as Gram-positivas, violeta.(7,20)
TÉCNICA DE COLORAÇÃO DE GRAM
| MÉTODO CLÁSSICO | MÉTODO MODIFICADO | |
| PREPARO DO ESFREGAÇO | Prepare um esfregaço delgado e homogêneo em uma lâmina previamente limpa e desengordurada; secar e fixar passando 3 x sobre a chama do bico de Bunsen | Prepare um esfregaço delgado e homogêneo em uma lâmina previamente limpa e desengordurada e deixe secar. No método modificado a fixação não acontece pelo calor, e sim pelo uso da violeta de metila, que age como um fixador químico. |
| COLORAÇÃO DA LÂMINA | Cubra com cristal violeta e deixe agir por 1 minuto.
Escorra o corante e lave com um filete de água corrente (etapa não obrigatória, mas melhora a visualização)
Cubra com solução Lugol e deixe agir por aproximadamente 1 minuto
Retire o excesso de corante e lave em um filete de água corrente (etapa não obrigatória)
Adicione álcool-acetona, descorando por aproximadamente 30 segundos
Lave com um filete de água (etapa obrigatória)
Cubra a lâmina como o corante de fucsina de Ziehl Neelsen diluída 1/10, deixando agir por aproximadamente 30 segundos
Lave com um filete de água (etapa obrigatória)
|
Cubra o esfregaço com violeta de metila e deixe por aproximadamente 15 segundos
Adicione quantidade igual de água sobre a lâmina coberta com violeta de metila e deixe agir por mais 45 segundos
Escorra o corante e lave em um filete de água corrente
Cubra a lâmina com Lugol diluído (1/20) e deixe agir por aproximadamente 1 minuto
Escorra o Lugol e lave em um filete de água corrente
Adicione álcool etílico (99,5º GL) sobre a lâmina, descorando-a, até que não desprenda mais corante
Lave em um filete de água corrente
Cubra a lâmina com safranina e deixe agir por aproximadamente 30 segundos
Lave em um filete de água corrente |
| OBSERVAÇÃO DA LÂMINA | Deixe a lâmina secar naturalmente, leve ao microscópio e com o auxílio de óleo de imersão, observar em objetiva de imersão (100X) | |
Fonte: Nogueira e Souza(5); Brasil(7)
PRINCIPAIS MODIFICAÇÕES NO MÉTODO DE GRAM (7,20)
| MÉTODO CLÁSSICO | MÉTODO MODIFICADO | JUSTIFICATIVA |
| Cristal violeta | Violeta de metila | A violeta de metila já possui característica de fixador, dispensando a fixação do esfregaço pela chama do bico de Bunsen, que promove brusca desidratação dos componentes celulares |
| Lugol | Retirada desta etapa | ——– |
| Álcool-acetona | Álcool etílico 99,5°GL | A solução de álcool etílico 99,5°GL tem menor potencial de toxicidade e diminui os efeitos de hiperdescoloração da lâmina |
| Fucsina fenicada | Safranina | No espectro de cor, a safranina se distancia mais do corante primário quando comparada à fucsina, permitindo mais diferenciação e nitidez entre as bactérias Gram-positivas e as Gram-negativas. |
Fonte: Brasil(7); Pinto e Ribeiro(20)
Cabe ressaltar que alguns grupos de bactérias não se coram pelo método de Gram, pois apresentam determinadas características que necessitam de técnicas específicas. Podemos citar como exemplo os espirilos, que apresentam o corpo celular muito fino, dificultando a visualização por métodos clássicos; e o gênero Mycobacterium que por apresentar uma parede celular de composição diferenciada(3) necessita de coloração especializada para esta estrutura. Devemos considerar ainda, as bactérias que não possuem parede celular, como por exemplo os micoplasmas. Estas bactérias apresentam apenas 0,2µ de tamanho, podendo ser observadas somente através de microscopia eletrônica, ou microscopia de fluorescência.
TÉCNICA DE COLORAÇÃO DE ZIEHL-NEELSEN
A técnica de Ziehl-Neelsen é uma metodologia extremamente importante e rotineiramente uma das mais utilizadas na atualidade em bacteriologia clínica. Foi desenvolvida pelo bacteriologista Franz Ziehl e posteriormente modificada pelo patologista alemão Friedrich Carl Adolf Neelsen, no final do século XIX, quando buscavam alternativas para visualizar o Mycobacterium tuberculosis, agente causador da tuberculose, que não podia ser corado de forma eficaz pelos métodos tradicionais devido à sua parede celular única e diferenciada.(3)
Além de possibilitar a coloração do gênero Mycobacterium, essa técnica é um método diferencial utilizado na identificação de todos os bacilos álcool-ácido resistentes (BAAR), como também a do gênero Nocardia. A característica álcool-ácido resistente é conferida a essas bactérias devido ao alto teor de lipídios estruturais na parede celular, promovendo uma condição hidrofóbica que interfere na permeabilidade e ação de corantes aquosos e resulta na resistência à ação dos reagentes álcool-ácidos.(12,21)
Entre os principais grupos bacterianos detectados em laboratórios de análises clínicas por essa técnica, destacam-se o complexo Mycobacterium tuberculosis e Mycobacterium leprae, reconhecidos pela OMS como agentes de problemas de saúde de grande relevância para a clínica humana.(11-13,22)
O complexo Mycobacterium tuberculosis é composto atualmente de 11 espécies distintas associadas com tuberculose humana e animal. Entre elas, a espécie Mycobacterium tuberculosis, que por ser altamente adaptada é a causadora de grande parte dos casos de tuberculose em humanos, sendo considerada, sob o ponto de vista sanitário, a mais importante do complexo.(23) A tuberculose é uma doença infecciosa transmissível que afeta prioritariamente os pulmões (forma pulmonar), mas pode acometer outros órgãos e/ou sistemas,(22) portanto a coloração de Ziehl-Neelsen é a técnica empregada para evidenciar BAAR em vários materiais clínicos, que podem englobar urina, líquor, peças de biópsia, ou ser de origem pulmonar como o lavado brônquico, lavado gástrico e swab de laringe, porém o exame baciloscópico do escarro é o método reconhecido pelo Ministério da Saúde como o mais importante, tanto para o diagnóstico, como para o controle do tratamento da tuberculose pulmonar no país.(12,22)
Por possuir uma parede celular diferenciada, fazendo com que a absorção de nutrientes seja lenta, o M. tuberculosis pode levar mais de um mês para produzir colônias visíveis em meio de isolamento.(9) Neste caso, a pesquisa de BAAR em materiais clínicos pode constituir a primeira evidência de doença, permitindo um diagnóstico precoce e embasamento para o início do tratamento terapêutico, enquanto ocorre a confirmação laboratorial da cultura positiva.(22)
Em contrapartida, o Mycobacterium leprae é o agente etiológico da hanseníase, doença caracterizada pelo comprometimento dos nervos periféricos e formação de lesões e manchas em áreas da pele, com alteração da sensibilidade térmica (calor e frio), motoras e/ou anatômicas.(11,13,24)
O diagnóstico de hanseníase baseia-se essencialmente em critérios clínicos e epidemiológicos, pois o Mycobacterium leprae é um microrganismo não cultivável in vitro. Neste caso, a baciloscopia está entre os testes primários fundamentais para identificar a presença das bactérias nas regiões afetadas.(11)
A técnica de Ziehl-Neelsen é um método de fácil execução, rápido e de baixo custo, que detecta a presença dos BAAR.(12) Se executado corretamente, desde a coleta e processamento da amostra até a baciloscopia, permite uma eficácia diagnóstica em 80% dos casos.(22)
Na rotina laboratorial, a pesquisa de M. tuberculosis é realizada, na maioria das vezes, com escarro espontâneo, utilizando a porção mais purulenta, que é colocada e distendida diretamente sobre a lâmina (baciloscopia direta). As secreções purulentas e o pus, por suas características físicas, também podem ser distendidos diretamente sobre a lâmina. Por outro lado, com o objetivo de aumentar a sensibilidade da baciloscopia, todas as amostras clínicas, sempre que possível e, de acordo com a necessidade, podem receber tratamento antes da realização do esfregaço. Esse tratamento pode ser: trituração, digestão com agentes químicos, como hidróxido de sódio (NaOH) ou NaCl, concentração, sedimentação, flotação ou mesmo filtração.(12) As metodologias recomendadas pelo Ministério da Saúde que visam a descontaminação e o tratamento do escarro para a realização da baciloscopia são: método de Petroff modificado, método de N-acetil-L-cisteína-hidróxido de sódio – NALC-NaOH, método do Swab – Ogawa-Kudoh e método do ácido oxálico.(12)
Embora o M. tuberculosis seja um microrganismo de alta periculosidade cuja transmissão ocorre por via aérea (Classe III), o processamento do material clínico para a realização da baciloscopia segue as recomendações de Biossegurança NB2, enfatizando o cuidado durante a manipulação do material biológico no preparo do esfregaço.(12) Segundo o Manual de Recomendações para o Diagnóstico Laboratorial da Tuberculose,(12) o depósito do material clínico deve ser de forma fluida em lâmina, com auxílio de palito de madeira estéril, pipeta Pasteur e/ou alça de platina, preconizados de acordo com os métodos de preparo. Recomenda-se não aquecer a lâmina durante a preparação do esfregaço, não só pelo risco de formação de aerossóis no ambiente laboratorial, mas por produzir precipitados granulosos que prejudicam a coloração e a detecção do bacilo. Neste caso, a fixação do esfregaço só é realizada quando existe a garantia de que estejam completamente secos.(12)
Na técnica de coloração de Ziehl-Neelsen, utiliza-se a solução de fucsina de Ziehl (carbol-fucsina) como primeiro corante (esta é 10x mais concentrada que a fucsina utilizada no método de Gram). Nesta etapa, é necessário um tratamento com calor, para que ocorra a dilatação e a penetração do corante na parede celular das micobactérias. Desta forma, após cobrir a lâmina com fucsina de Ziehl, deve-se deixar agir por 5 a 10 minutos, aquecendo com chama branda (evitar a fervura), até o desprendimento de vapores. Após essa etapa, a lâmina é brevemente lavada e descorada com solução de álcool-ácido clorídrico a 1%. A lâmina é coberta com azul de metileno, que funciona como um contra-corante, por aproximadamente 30 segundos. Em sequência, lavar, deixar secar e observar em objetiva de imersão (100X).(12)
O diferencial da parede celular das micobactérias está na constituição da camada de peptideoglicano formada de N-glicolilmurâmico e ácidos micólicos, que são ácidos graxos de cadeia longa (gordura) presentes nesta estrutura que formam uma barreira e dificultam a entrada do corante. Os lipídios fortemente ligados na estrutura do ácido micólico vão promover a hidrofobicidade, impedindo a penetração de corantes aquosos, a ação dos mordentes e dos diferenciadores, o que não ocorre em outros gêneros bacterianos. O princípio da técnica de Ziehl-Neelsen baseia-se no fato de que após a etapa de aquecimento, ocorre uma dilatação, tornando possível transpor o corante carbol-fucsina para o interior da célula, que fica retido após o resfriamento. Este se mantém, mesmo após a descoloração com um agente ácido-alcoólico.(12)
No processo de coloração da amostra, a fucsina fenicada de Ziehl (carbol-fucsina) irá corar todos os elementos celulares de vermelho. No entanto, após o processo de descoloração com álcool-ácido, somente os bacilos álcool-ácidos resistentes (BAAR) serão capazes de preservar essa coloração e irão sobressair em relação a outros microrganismos que não possuem essa propriedade. Os compostos celulares que são descorados irão absorver a coloração do corante de fundo, azul de metileno (contra-corante), conforme demonstrado na Figura 4.(5,12)
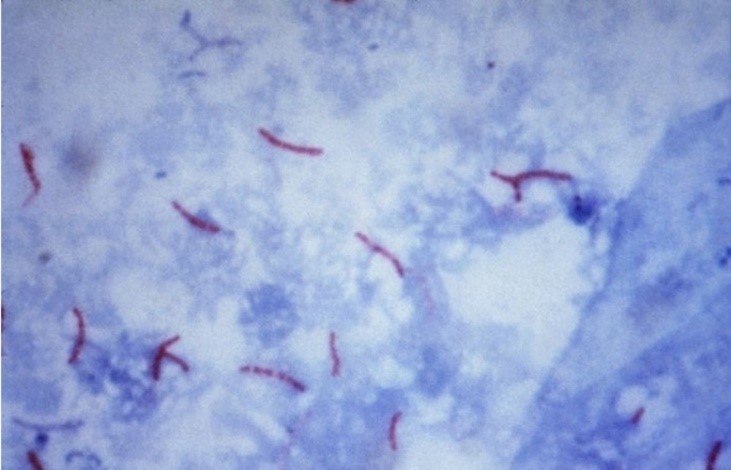
Figura 4
Mycobacterium tuberculosis corado pela técnica de Ziehl-Neelsen(12)
Segundo o Ministério da Saúde,(12) a leitura e interpretação dos resultados de baciloscopia, seguem os seguintes critérios:
Leitura e interpretação dos resultados de baciloscopia de amostras de escarro:(12)
| LEITURA | RESULTADO |
| Não são encontrados BAAR em 100 campos observados | NEGATIVO |
| 1 a 9 BAAR em 100 campos observados | Relata-se a quantidade de bacilos encontrados |
| 10 a 99 BAAR em 100 campos observados | POSITIVO + |
| 1 a 10 BAAR em 50 campos observados | POSITIVO ++ |
| Em média, mais de 10 BAAR por campo em 20 campos observados | POSITIVO +++ |
Leitura e interpretação dos resultados de baciloscopia de outras amostras clínicas:(12)
| LEITURA | RESULTADO |
| Não são encontrados BAAR em 100 campos observados | NEGATIVO |
| São encontrados BAAR em qualquer quantidade do material examinado | POSITIVO |
MÉTODO DE FONTANA-TRIBONDEAU
Este método foi idealizado por Alfonso Fontana e Louis Tribondeau,(25) em 1920, e embora seja considerado uma prática laboratorial de coloração, isso não é verdadeiro. Trata-se de uma técnica de impregnação pela prata, utilizada na visualização de bactérias espiraladas extremamente finas que não se coram pela técnica usual de Gram, como por exemplo os treponemas e as leptospiras. Na utilização desta técnica as espiroquetas são tratadas com prata amoniacal e se destacam contra um fundo claro. Desta forma, tornam-se visíveis na cor marrom-escuro ou negra sobre um fundo de cor amarelo-castanho ou marrom-claro.(5,9,25)
A metodologia consiste em depositar, sobre o esfregaço seco, algumas gotas da solução de Ruge (ácido acético glacial, formalina 40% e água destilada) deixando agir por 30 segundos (por 3 vezes). Esta etapa tem a função de fixar o esfregaço na lâmina. Isto porque, nesse tipo de material não é recomendada a fixação pelo calor, como realizado em outras metodologias, pois o aquecimento pode afetar a morfologia das espiroquetas.(5,9,25)
Após esta etapa, o esfregaço é coberto com a solução Mordente (composta de ácido tânico e ácido fênico) e submetido ao aquecimento até a emissão de vapores por 30 segundos. Lavar e posteriormente tratar com a solução impregnadora (nitrato de prata amoniacal), aquecendo ligeiramente até a emissão de vapores, deixando agir por 30 segundos. A prata então é reduzida a prata metálica, depositando-se nas espiroquetas, que poderão ser observadas em microscópio com uma coloração marrom,(5,9) conforme a Figura 5.
Entre as principais aplicações desta técnica, destaca-se sua importância para o diagnóstico de sífilis, pois a partir do material clínico é possível fazer a visualização direta do Treponema pallidum, que não pode ser cultivado in vitro.(26)
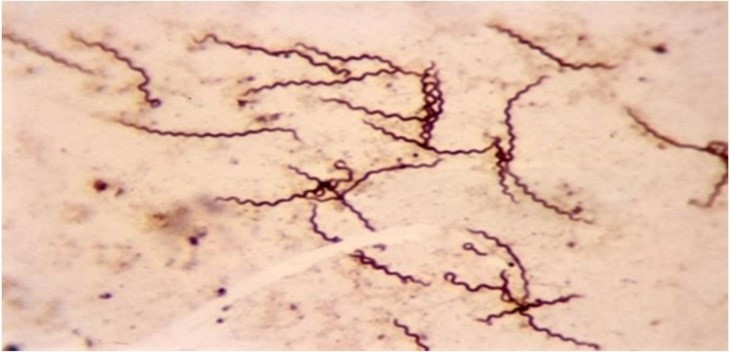
Figura 5
Treponema pallidum corado pelo método de Fontana-Tribondeau(27)
COLORAÇÃO DE ALBERT-LAYBOURN
Esse método de coloração foi sugerido inicialmente em 1920 por Henry Albert, e modificado posteriormente por Ross Laybourn(28) em 1924. Essa técnica tem sido utilizada para a pesquisa de corinebactérias no diagnóstico presuntivo de difteria e se baseia na presença de corpúsculos citoplasmáticos localizados nas extremidades dessas bactérias, conhecidos como corpúsculos metacromáticos ou corpúsculos de Babes Ernst. Estas estruturas são compostas de polifosfatos que se acumulam no interior da célula, quando outro nutriente diferente do fosfato se torna escasso, especialmente quando há pouca quantidade de sulfato. Nestas condições, detém-se a síntese dos ácidos nucleicos, e a volutina acumula-se no aguardo da sua utilização para esta síntese. Esse material rico em polifosfatos se cora muito pelo Lugol forte, dando a impressão de que são até maiores que o corpo bacilar e adquirem uma tonalidade marrom, sendo possível se observar em contraste com o corpo bacilar que se cora em verde-azulado pela solução de Laybourn.(5)
A coloração de Albert-Laybourn é indicada em diferentes estudos, como “padrão ouro” para triagem de Corynebacterium diphteriae a partir do exame direto de esfregaço de naso e orofaringe. Este microrganismo, responsável por um quadro infecioso transmissível, pode evoluir para a formação de placas pseudomembranosas típicas que se alojam nas amígdalas, laringe, faringe, nariz e até mesmo na conjuntiva e na pele.(9,21,24) Embora seja imunoprevenível e seu tratamento na atualidade seja realizado com soroterapia, quando ocorre a infecção, a rapidez no diagnóstico é um fator determinante para um bom desfecho.
O diagnóstico da doença é realizado a partir da avaliação da sintomatologia clínica, que combinada ao estudo de microscopia óptica como um teste complementar pode revelar a presença de bacilos metacromáticos no material clínico coletado, indicando presuntivamente a difteria. No entanto, a OMS preconiza, concomitantemente, a coleta do material clínico e realização da cultura bacteriana visando o isolamento de Corynebacterium sp. em meios específicos para a confirmação do diagnóstico.(21,24)
O método de Albert-Laybourn consiste em cobrir o esfregaço com a solução de Albert-Laybourn (azul de toluidina, verde malaquita, ácido acético glacial, álcool 95° e água destilada), por 3 a 5 minutos. Escorrer sem lavar e em seguida cobrir com solução Lugol forte (iodo metálico, iodeto de potássio e água destilada), deixando agir por aproximadamente 2 minutos. Após esse processo, lavar, secar e observar em microscópio, em objetiva de imersão,(5) os corpúsculos metacromáticos corados de marrom, conforme Figura 6.
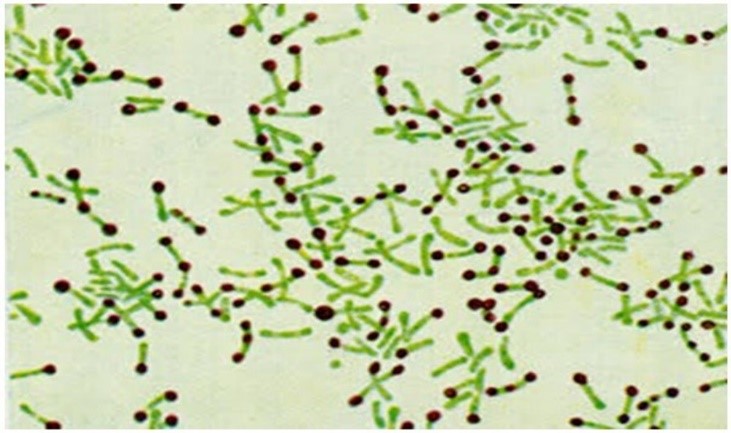
Figura 6
Corpúsculos Metacromáticos corados pelo método de Albert Laybourn(9)
COLORAÇÕES DE ESPOROS
Alguns grupos bacterianos, como os gêneros Bacillus e Clostridium, são capazes de formar estruturas de resistência chamadas endósporos. Geralmente essa condição acontece quando os microrganismos se encontram em condições desfavoráveis, com escassez de nutrientes, condições inadequadas de umidade e temperatura. Nestas condições, os microrganismos entram em fase de esporulação, produzindo no seu interior uma estrutura esférica ou ovoide resistente, cuja composição se caracteriza por altos teores de cálcio em associação ao ácido dipicolínico, relacionado à desidratação e à alta resistência, inclusive térmica.(5,7) Cada célula forma um único esporo, e essas estruturas são liberadas para o meio externo após a morte celular. Essas estruturas podem permanecer em estágio de latência ou em repouso por anos no ambiente, até encontrarem uma condição ideal para se tornarem viáveis novamente.(16)
Entre as principais funções dos endósporos destaca-se a sua proteção contra agentes físicos e químicos usados em processos de esterilização/desinfecção, visto que somente podem ser destruídos por autoclavação a 120°C durante 30 minutos.(5,7)
Apesar da importância de sua detecção, visualizar esporos em microscópio luminoso óptico pode ser difícil, devido a refringência dessas estruturas, o que os torna resistentes a diversos corantes, pois estes não penetram a parede do endósporo. Em colorações comuns, o corpo bacteriano fica corado, todavia o endósporo permanece incolor.(7)
Entre as várias técnicas de coloração de esporos destaca-se a coloração de Schaeffer-Fulton, idealizada por A.B. Schaeffer e M.D. Fulton,(29) em 1933, para a coloração de endósporos bacterianos associados a infecções clínicas humanas, como tétano e botulismo, consideradas de grande relevância para Saúde Pública(24). Outra metodologia de coloração em bacteriologia para pesquisa de esporos é a coloração de Wirtz-Conklin,(30) descrita em 1837, que torna possível a visualização dessas estruturas em microscópio. Atualmente, essa ainda é a metodologia preconizada em pesquisa de amostras ambientais e clínicas, especificamente no diagnóstico de doenças como o carbúnculo.(5)
Para realizar a coloração de esporos, você deve ter uma cultura pura da cepa suspeita que deseja estudar. Recomenda-se que esta cultura seja submetida a temperaturas extremas por 24 horas para estimular o microrganismo a esporular. Para isso, a cultura pode ser colocada em um forno a 44°C ou em uma geladeira (8°C) por 24 ou 48 horas. É importante salientar que se as temperaturas mencionadas forem deixadas muito tempo, apenas exósporos serão observados, uma vez que todos os endósporos terão deixado o bacilo. No final desta etapa, em lâmina, algumas gotas de solução fisiológica estéril serão depositadas e homogeneizadas com a cultura previamente preparada.(7)
O princípio de ambas as técnicas se baseia no uso do verde malaquita, como corante primário, e da safranina como contra-corante. Na técnica de Wirtz-Conklin, a partir de um esfregaço homogêneo, delgado e fixado, deve-se cobrir a lâmina com o corante verde malaquita. Em um béquer, aquecer água até a emissão de vapores e depositar a lâmina sobre ele, mantendo o corante aquecido por 5 minutos. Como forma alternativa, pode-se aproximar a lâmina de uma chama branda até o desprendimento de vapor, sem deixar que o corante entre em ebulição. No intervalo de 1 a 2 minutos, repetir a operação por 3 a 4 vezes. O calor tem a função de auxiliar a penetração do corante na camada espessa formada pelo córtex. Após este processo, realizar a lavagem da lâmina, para retirada do excesso do corante, de forma suave, evitando choque térmico e quebra da lâmina. Adicionar a safranina sobre o esfregaço, que age como contra-corante, e aguardar por 30 segundos.
Já na coloração de Schaeffer-Fulton, a técnica é similar respeitando o tempo e uso dos mesmos corantes, no entanto o processo não passa pela etapa de aquecimento. Em ambas as técnicas, com um esfregaço corretamente preparado, os endósporos aparecem em verde dentro de células vermelhas ou rosadas (Figura 7). Como os endósporos são altamente refrativos, podem ser detectados no microscópio óptico quando não corados, mas não podem ser diferenciados de inclusões de material armazenado sem uma coloração especial.(5,7)
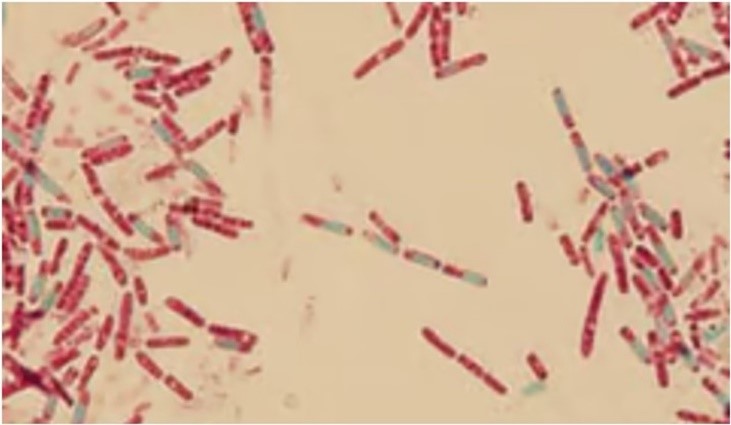
Figura 7
Coloração de esporos pela técnica de Wirtz-Conklin(27,30)
Outras metodologias menos usuais para coloração de esporos estão descritas em literatura, como a coloração de Moeller, coloração de Dorner e coloração de Dorner modificada.(31)
A técnica de Moeller tem o princípio de utilizar o ácido crômico e fucsina como corante inicial, finalizando com azul de metileno como contra-corante. Nesta técnica os esporos irão se sobressair de vermelho, em relação ao corante de fundo azul. Esta técnica consiste em cobrir o esfregaço previamente preparado com álcool que será submetido ao fogo, até naturalmente apagar. Posteriormente, a lâmina será coberta com ácido crômico a 5%, deixando agir por 5 minutos. Após a sensibilização, a lâmina deve ser lavada e adicionada a solução de fucsina fenicada, que deve agir por 10 minutos. Durante esta etapa, a lâmina deve ser aquecida até a emissão de vapores. Em sequência, é realizada a etapa de descoloração, utilizando como alternativa inicial o ácido sulfúrico a 5% ou ácido nítrico a 10%, e terminando com álcool absoluto. O esfregaço então será lavado e corado com a solução de azul de metileno (1%), como contra-corante, por 3 minutos e, após seguem lavagem e secagem da lâmina, observada em objetiva de imersão os esporos corados de vermelho e corpo bacteriano corado de azul.(31)
Para a coloração dos esporos de acordo com Dorner, o esporo é sensibilizado e corado com fucsina e nigrosina. A nigrosina tem a função de extrair todo o corante das estruturas celulares, com exceção dos esporos, assumindo uma coloração distinta (vermelha) em relação ao corpo bacteriano. Na técnica de Dorner, deve-se preparar uma suspensão concentrada de microrganismo esporulado em água destilada e adicionar um volume igual de fucsina filtrada de Kinyoun (fucsina fenicada). Posteriormente, o tubo deverá ser colocado em um banho com água fervente, onde deve permanecer de 5 a 10 minutos. Em uma lâmina limpa, misturar uma gota da suspensão anterior com uma gota de solução aquosa de nigrosina a 10%, fervida e filtrada. Espalhar e secar rapidamente com calor suave. Examinar com objetiva 100X (imersão). Nesta técnica os esporos ficam vermelhos e as células bacterianas parecem quase incolores contra um fundo cinza-escuro.(31)
Na técnica de Dorner modificada, a partir de uma lâmina fixada com uma suspensão de microrganismo esporulado, deve-se cobrir o esfregaço com uma tira de papel de filtro e adicionar fucsina fenolada. Posteriormente, submeter a lâmina ao aquecimento por 5 a 7 minutos até a liberação de vapor. Após esse processo, o papel é removido e a lâmina lavada e seca com papel absorvente. O esfregaço, então, é coberto com uma película fina de solução de nigrosina a 10%, o qual deve ser distendido com auxílio de uma segunda lâmina. Na observação em microscópio, se possível visualizar os esporos com a mesma tonalidade que foi citada na técnica acima.(31)
Cabe ressaltar que as colorações de esporos podem ser utilizadas como aporte em diferentes segmentos, seja na clínica, em indústrias de alimentos ou na área ambiental.(7,32-34)
Particularmente na clínica, a presença de esporos é preconizada na detecção de Clostridium tetani, agente etiológico do tétano.(7) Essa doença é causada por toxinas eliminadas pela bactéria, a qual tem capacidade de formar endósporos esféricos terminais com um aspecto característico, semelhante a uma “raquete”, facilmente visíveis pelas técnicas de coloração.(24)
No contexto de Saúde Única, o controle de endósporos na área de produção de alimentos representa um grande desafio, pois são estruturas muito difíceis de eliminar e representam riscos associados à deterioração de alimentos e a doenças de origem alimentar, como o botulismo.(24) O botulismo é uma doença bacteriana rara, causada pelo Clostridium botulinum, podendo ser associada à ingesta de alimentos contaminados, principalmente os enlatados e os que não têm preservação adequada.(24,32) Nas etapas de controle de qualidade na produção de alimentos, as técnicas de coloração são fundamentais, pois permitem a rápida detecção e quantificação de esporos.(33) Outra aplicabilidade envolve a pesquisa de endospóros bacterianos em amostras ambientais, principalmente nos estudos de monitoramento e eficiência de Estação de Tratamento de Água (ETA), análise de água bruta da entrada e no efluente das unidades de filtração saída da Estação de Tratamento de Esgotos (ETE), preconizados pela Portaria GM/MS nº 888, de 4 de maio de 2021.(34)
Ainda no âmbito de técnicas de coloração bacteriana, cabe ressaltar metodologias mais simples, que embora pouco utilizadas em rotinas laboratoriais têm grande valor nas atividades de pesquisa que envolvem o estudo de alguma estrutura celular bacteriana específica, como a coloração de cápsula (coloração negativa ou tinta da China, coloração da tinta da China com fucsina diluída, coloração de Hiss) e coloração de flagelos.(5,7)
COLORAÇÃO NEGATIVA
A coloração negativa, recebe esse nome, quando o meio se cora e o corpo bacteriano não. Ela pode ser realizada com apenas um corante (coloração simples)(5) como é o caso da tinta da China para observação de cápsulas, ou combinada com outros corantes como no método de Gins.(35)
Essa metodologia é muito usada para visualizar as cápsulas, que são estruturas presentes em alguns microrganismos que, entre muitas funções, protegem a célula contra a fagocitose por leucócitos polimorfonucleares e contribuem para a aderência das bactérias às células e às superfícies. Esta aderência é necessária em muitos organismos para o estabelecimento de infecções em hospedeiros apropriados ou para a manutenção da célula bacteriana em uma determinada superfície no ambiente.(35) O material capsular é geralmente de natureza polissacarídica e fosfatos, que agem com propriedade antigênica, normalmente detectada em testes sorológicos. Entre as bactérias patogênicas produtoras de cápsula, podemos citar Streptococcus pneumoniae, Klebsiella pneumoniae, Haemophilus influenzae e Neisseria meningitidis, conhecidas pelo seu potencial de patogenicidade e implicação em diversas infecções clínicas de relevância para a saúde humana.(36)
A técnica de coloração de cápsula é uma ferramenta que auxilia na identificação de microrganismos encapsulados, e muitas das vezes contribui presuntivamente para o diagnóstico. A metodologia se baseia no tratamento da célula com corantes específicos que não penetram na cápsula, podendo variar de acordo com a técnica, que geralmente vai contrastar a estrutura capsular em relação à célula bacteriana.(7,37)
Essa abordagem já era apontada no artigo de Lima e Teles,(38) que descreveram a composição, funcionalidade da cápsula, importância para classificação e correlação com formas capsulares dos diferentes microrganismos, fazendo menção histórica e comparativa de diferentes técnicas de coloração de cápsula e suas adaptações ao longo do tempo. Neste, os autores discorrem pelas técnicas idealizadas por Rosenow(39) (1911) e de Muir(40) (1915), baseadas no emprego de violeta genciana e eosina e Smith,(38) que defendiam o uso desses corantes seguido de azul de metileno. Com embasamento teórico e técnico, Lima e Teles (1942) enfatizaram a dificuldade, na época, da realização de determinadas técnicas, associando a baixa sensibilidade de diagnóstico. Esses autores citam, também, as técnicas descritas por Hiss(41) (1901) e Anthony (42) (1931), quando estudaram as formas de avaliar cápsulas produzidas por klebsiella pneumoniae. Hiss(41) (1901) idealizou dois processos distintos: o primeiro propondo o uso de violeta genciana diluída ao dobro de seu volume com água destilada, seguida da lavagem com solução aquosa a 0,25% de carbonato de potássio; e o segundo, sugerindo corar a quente com solução aquosa de violeta genciana ou fucsina, e posterior lavagem com solução de sulfato de cobre. Já na técnica de Anthony(42) (1931), o autor dispensa a fixação pelo calor, aplicando a frio uma solução a 1% de cristal de violeta como corante inicial por 2 minutos, e posteriormente o uso do sulfato de cobre agindo como descorante, similar ao processo de Hiss. Os estudos comparativos realizados por Lima e Teles(38) (1942) concluíram que a técnica de Anthony demonstrava melhores resultados, sendo possível observar cápsulas maiores e mais visíveis.
Atualmente estas técnicas antigas não são mais usadas e a literatura descreve, entre os principais métodos de detecção de cápsula, a coloração negativa, também conhecida por metodologia da tinta da China. Esta técnica simples permite a visualização de bactérias capsuladas sem a necessidade de corá-las diretamente.(5,7,16) Em microscopia de campo claro, a coloração negativa é normalmente realizada usando-se um fluido pigmentado preto (corante ácido), como a nigrosina ou tinta da China, que não tem a capacidade de penetrar na célula, colorindo o fundo e deixando as células incolores. Neste método, é necessário cultivar os microrganismos em meio rico em nutrientes, como por exemplo BHI (Broth Heart Infusion) para estimular a produção de cápsula. A metodologia consiste em depositar 1 ou 2 gotas desta cultura em uma lâmina, seguida de uma gota de tinta da China (negrosina, ou naquim) ao lado da cultura. Posteriormente, a lâmina é coberta por uma lamínula, comprimindo-a entre folhas de papel de filtro com a finalidade de retirar o excesso e obter uma quantidade tênue de corante e material. Em seguida, observar diretamente ao microscópio nas objetivas de 4X, 10X, 40X e 100X, respectivamente.(37) Cabe ressaltar que, por se tratar de células vivas, é importante obedecer aos critérios de biossegurança quanto ao uso de EPI para a manipulação da cultura e descarte das pipetas/ponteiras utilizadas e papel de filtro em recipiente destinado à autoclavação.(5,7,16)
Outro método descrito em literatura é uma variação do método da tinta da China, com a utilização de um corante adicional, que é a fucsina diluída. Neste método, as sequências preliminares são mantidas, no entanto é feito um esfregaço a partir da mistura da cultura com a tinta da China, que após secagem é submetido à coloração com fucsina diluída durante 2 minutos. Posteriormente a esse tempo, a lâmina é suavemente lavada com água, seca e observada em microscópio óptico em objetiva de imersão.(5,7,16)
COLORAÇÃO DE FLAGELOS
Os flagelos são estruturas de locomoção, formadas por apêndices muito finos, de composição proteica (flagelina), presentes em bactérias móveis. O flagelo é composto por milhares de monômeros polimerizados desta proteína, dispostos de forma a compor um único flagelo.(5,16)
Algumas dificuldades podem ser encontradas quando se deseja demonstrar este tipo de organela através de microscopia óptica, visto que a produção bacteriana de flagelos não é contínua e depende de diferentes fatores, como por exemplo o meio de cultivo, a temperatura e o estágio do crescimento.(5,16) Os flagelos são estruturas frágeis e delicadas, que podem ser facilmente desprendidas do corpo celular quando submetidas a processos bruscos de pipetagem e homogeneização. Outro fator preponderante para o desprendimento é a característica de despolimerizar com facilidade, se dissociando em monômeros de flagelina em temperaturas acima de 60ºC e pH ácido (± pH 4,0) e em presença de solventes orgânicos de álcalis e ureia. Levando em consideração tais características, para a visualização de flagelos é necessária uma coloração especial, que visa aumentar o diâmetro do flagelo. O princípio da técnica de coloração de flagelo se baseia no uso de ácido tânico, que se liga ao flagelo, aumentando o seu diâmetro e facilitando, assim, a observação. Apesar disso, ainda aparecem muito tênues na lâmina, dificultando fotografias com boa nitidez em microscopia luminosa.(5,16)
A técnica é realizada partindo de uma cultura em meio rico (normalmente BHI, conforme descrito anteriormente na coloração de cápsula) ou em ágar soja tripticase (com ou sem sangue). Uma alíquota desta cultura é transferida delicada e cuidadosamente, com auxílio de uma alça de platina, para um tubo contendo aproximadamente 3mL de água destilada e invertido 1x sem movimentos bruscos, com a finalidade de homogeneizar a suspensão. Com o auxílio de uma pipeta, retirar uma alíquota por capilaridade, deixando escoar naturalmente sobre a superfície de uma lâmina inclinada a 45°, deixando secar em ambiente. Após esse processo, a lâmina deve ser coberta com uma mistura de corantes contendo fucsina e ácido tânico, deixando agir por 5 minutos, até que se forme um brilho metálico esverdeado cobrindo metade da área. Posteriormente, retirar o corante com água antes que ele seque sobre a lâmina, secar naturalmente e observar em microscópio óptico em objetiva de imersão (100X).(5,16)
IMPORTÂNCIA NO APRENDIZADO DESTAS METODOLOGIAS
Como já comentado, apesar da bacteriologia ter avançado muito nas últimas décadas, com o surgimento de métodos moleculares e da automação, conferindo maior rapidez nos diagnósticos clínicos e mesmo nas pesquisas de saúde única, o primeiro passo da análise bacteriológica no tocante à microscopia do material clínico permanece como uma etapa de extrema importância.
Como docentes da pós-graduação e orientadores experientes, os autores têm notado a dificuldade dos alunos de entenderem a importância da microscopia, os princípios das colorações bacterianas e a sua relação com a identificação dos agentes, seja ela definitiva ou presuntivamente.
Desta forma, concebemos este artigo como uma possibilidade de reforçar esse assunto, trazendo uma abordagem histórica, estado da arte, sua aplicação e a importância de conhecer os métodos mais utilizados na pesquisa e na rotina laboratorial, mesmo na atualidade, pois acreditamos que esses conhecimentos agregarão valores práticos para os alunos da área da Saúde, especialmente para os que lidam diretamente com a identificação bacteriana nas suas mais diversas abordagens.
PRINCIPAIS LIMITAÇÕES E CONTROLE DE QUALIDADE NAS TÉCNICAS DE COLORAÇÃO
O controle de qualidade é um conjunto de medidas, procedimentos e ferramentas aplicados durante a execução de um processo, com a finalidade de garantir que tenha sido bem executado. Desta forma, algumas recomendações devem servir de requisitos obrigatórios em atividades de rotina diária:
1 – Durante a execução de qualquer técnica de coloração devem ser usar das cepas controle, como por exemplo as ATCC (American Type Culture Collection), tanto para realizar o controle de qualidade dos corantes como para se certificar de que sua metodologia foi bem realizada. O uso de cepas citomorfologicamente conhecidas será importante para o reconhecimento comparativo entre amostras, permitindo verificar a similaridade e/ou distinção das colorações e morfologias avaliadas.
2 – Os corantes devem ser preparados seguindo os protocolos recomendados e mantidos em frasco âmbar, para não sofrerem a ação da luz, o que produz alterações variadas. Devem ser bem vedados para evitar a evaporação. É recomendado que sejam sistematicamente filtrados para retirada de cristais que normalmente precipitam no fundo do frasco. No momento da execução da técnica de coloração, não é recomendado homogeneizar o corante, para não ressuspender os possíveis cristais pré-formados.
3 – As lâminas devem ser novas, previamente lavadas e desengorduradas antes de serem utilizadas.
4 – É recomendado realizar a manutenção preventiva e limpeza dos microscópios, assim como das objetivas ao término de cada atividade.
5 – A etapa da descoloração é crítica, pois a exposição prolongada ao solvente pode provocar a remoção total dos corantes utilizados, produzindo resultados questionáveis. A retenção ou não do corante primário depende, portanto, das propriedades físicas e químicas das paredes celulares bacterianas, como espessura, densidade, porosidade e integridade.
CONCLUSÃO
Apesar de todas as metodologias atuais de detecção e identificação bacteriana, as técnicas básicas de coloração em microbiologia ainda desempenham papel fundamental no diagnóstico, diferenciação e estudo de microrganismos, e o conhecimento e a aplicação adequada dessas técnicas são essenciais para profissionais de microbiologia em diferentes contextos clínicos e laboratoriais. Cada técnica apresenta princípios específicos que permitem a visualização de estruturas bacterianas distintas, e têm contribuído para avanços significativos na medicina e na pesquisa biomédica. Mesmo diante da inegável importância dessas técnicas, os autores apontam para a importância de estudos mais atuais com o objetivo de criar metodologias, visando não só a diminuição de uso de corantes com base no custo de reagentes, mas vislumbrando a redução do uso de substâncias tóxicas, o que contribuirá também para processos mais sustentáveis e preservação ambiental.
REFERÊNCIAS
- Freitas V, Picoli S. A Coloração de Gram e as Variações na sua Execução. Newslab. Novo Hamburgo. 2007; v.82 p124-128.
- Gram HCJ, Friedlaender C. Ueber die isolirte Färbung der Schizomyceten: in Schnitt-und Trockenpräparaten. Berlin: Theodor Fischer’s medicinischer Buchhandlung; 1884. (Fortschritte der Medicin; Bd. 2, 1884).
- Ziehl F. Zur Färbung des Tuberkelbacillus. Dtsch Med Wochenschr. 1882; 8:451-451.
- Kanaan S. Laboratório com interpretações clínicas. 2ª ed. Editora Atheneu; 2021.
- Nogueira JMR, Souza LF. Bacteriologia. In: Molinaro EM, Caputo LFG, Amendoeira MRR. Conceitos e Métodos para Formação de Profissionais em Laboratórios de Saúde. EPSJV – Fiocruz; 2009. p 221-397.
- Willey JM, Sherwood LM, Woolverton CJ. Prescott’s Microbiology. 8th. Ed McGraw-Hill; 2014.
- LeVeque RM, Martin N, Alst AJV, DiRita VJ. Microscopy and Staining: Gram, Capsule, and Endospore Staining. Em Cambridge, MA: JoVE Journal; Michigan State University; 2023.
- McPherson RA, Pincus MR. Henry’s Clinical Diagnosis and Management by Laboratory Methods. 24 RD. Ed St. Louis, MO E-Book. Elsevier Health Sciences; 2021.ISBN: 9780323673204.
- Trento A. Colorações usadas em microbiologia [Internet]. [São José do Rio Preto – São Paulo]: Academia da Ciência e Tecnologia; 2018. Disponível em: http://www.ciencianews.com.br/arquivos/ACET/IMAGENS/Artigos_cientificos/3-Coloracao_microbiologia.pdf. Acesso em: 23 de agosto de 2024.
- Teixeira AB, Cavalcante JCDV, Moreno ÍC, Soares IDA, Holanda FODA. Bacterial meningitis: an update. Rev Bras Análises Clínicas; 2018. 50 (4): 327-329. Disponível em: https://www.rbac.org.br/artigos/meningite-bacteriana-uma-atualizacao/. Acesso em: 02 de setembro de 2024.
- Protocolo Clínico e Diretrizes Terapêuticas da Hanseníase. Brasília, DF: Secretaria de Vigilância em Saúde. Departamento de Doenças de Condições Crônicas e Infecções Sexualmente Transmissíveis. Ministério da saúde; 2022. 152p.
- Manual de Recomendações para o Diagnóstico Laboratorial de Tuberculose e Micobactérias não Tuberculosas de Interesse em Saúde Pública no Brasil. Brasília, DF: Secretaria de Vigilância em Saúde. Departamento de Doenças de Condições Crônicas e Infecções Sexualmente Transmissíveis Ministério da Saúde; 2022. 492 p.
- Hanseníase. Agência Fiocruz de Notícias. Lab de Hanseníase do Instituto Oswaldo Cruz. Fiocruz. Ministério da Saúde; 2024. Disponível em: https://portal.fiocruz.br/doença/hanseniase. Acesso em: 20 de agosto de 2024.
- Morales PS. O tuberculosis, a coloração de Ziehl-Neelsen e a interpretação do BAAR [Internet]. Portal Afya. Disponível em: https://portal.afya.com.br/saude/o-mycobacterium-tuberculosis-e-a-classica-coloracao-de-ziehl-neelsen. Acesso em: 02 de setembro de 2024.
- Rother ET. Revisão Sistemática x Revisão Narrativa. Editorial, Acta paul. enferm. 2007. 20 (2). Disponível em: https://www.scielo.br/j/ape/a/z7zZ4Z4GwYV6FR7S9FHTByr/ Acesso em: 02 de setembro de 2024.
- Moreira JLB, Carvalho CBM, Frota CC. Visualização bacteriana e colorações. Ed. Imprensa Universitária – Universidade Federal do Ceará, CE; 2023. 68p
- Técnica de Coloração de Gram. Brasília, DF: Ministério da Saúde; 1997. 63p.
- Lellis B, Fávaro-Polonio CZ, Pamphile JA, Polonio JC. Effects of textile dyes on health and the environment and bioremediation potential of living organisms. Biotechnol Res Innov. 2019;3(2):275-90.
- Reine FU, Souza LABD, Menezes JLD, Gomes RFCC, Souza ACRD, Mota CA, et al. Método alternativo e sustentável para a realização de coloração bacteriana de Gram e Wirtz-Conklin: Relevância ambiental e econômica no ensino prático da microbiologia. Res Soc Dev. 22 de julho de 2021;10(9):e9510917585.
- Pinto AC, Ribeiro KTS. Guia prático de orientações básicas de microbiologia [Internet]. 1o Editora Itacaiúnas; 2022. Disponível em: https://editoraitacaiunas.com.br/produto/guia-pratico-de-orientacoes-basicas-de-microbiologia/. Acesso em: 20 de setembro de 2024.
- Bush LM. Nocardiosis. MSD Manual, Charles E Schmidt Coll Med Florida Atlantic University. 2023; Disponível em: https://www.msdmanuals.com/home/infections/bacterial-infections-gram-positive-bacteria/nocardiosis. Acesso em: 23 de setembro de 2024.
- Manual de recomendações para o controle da tuberculose no Brasil. Brasília, DF: Secretaria da Vigilância em Saúde. Departamento de Vigilância de Doenças Transmissíveis. Ministério da Saúde; 2019. 364p.
- Silva-Pereira TT, Soler-Camargo NC, Guimarães AMS. Diversification of gene content in the Mycobacterium tuberculosis complex is determined by phylogenetic and ecological signatures. Jun SR, organizador. Microbiol Spectr. 2024;12(2):e02289-23.
- Guia de Vigilância em Saúde. Brasília, DF: Secretaria da Vigilância em Saúde e Ambiente. Departamento de Ações Estratégicas e Epidemiologia e Vigilância em Saúde e Ambiente. Ministério da Saúde; 2024. 6ed. rev.v.3.
- Fontana A, Tribondeau P. Silver staining of spirochetes. Journal of Infectious Diseases. 1907.
- Morris SR. Sífilis.Manual MSD versão para profissionais de Saúde;2023. Disponível em: https://www.msdmanuals.com/pt-br/profissional/doenças-infecciosas/infecções-sexualmente-transmissíveis/sífilis. Acesso em: 23 de setembro de 2024.
- Métodos de Coloração em Microbiologia [Internet]. Instituto Nacional de Medicina Laboratorial. 2023 [citado 16 de agosto de 2024]. Disponível em: https://inml.com.br/metodos-de-coloracao-em-microbiologia/. Acesso em: 23 de setembro de 2024.
- Albert L, Laybourn A. A New staining method for the demonstration of volutin granules. Journal of Pathology and Bacteriology; 1934.
- Schaeffer AB, Fulton MD. A simplified method of staining endospores. 17 de fevereiro de 1933;77(1990):194. Disponível em: https://pubmed.ncbi.nlm.nih.gov/17741261/. Acesso em: 05 de setembro de 2024.
- Wirtz R, Conklin R. A new method for ataining bacterial spores. Stain Technology; 1937.
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, et al. Proposal of a simplified technique for staining bacterial spores without applying heat – Successful modification of Moeller’s Method. Eur J Med Res. 2007.
- Martin BXB, Carraro DC, Souza DCR, Duarte EMPD, Ribeiro, SM, Gomes AB. Tipos de Botulismo: Uma revisão bibliográfica. Brazilian Journal Surgery and Clinical Research; 2019. Vol 26, N2, p 43-48.
- Silva ND, Junqueira VCA, Silveira NFDA. Manual de Métodos de Análise Microbiológica de Alimentos e Água [Internet]. 6o Blucher; 2021. Disponível em: https://www.blucher.com.br/livro/detalhes/manual-de-metodos-de-analise-microbiologica-de-alimentos-e-agua-1847. Acesso em: 20 de setembro de 2024.
- Ministério da Saúde. Portaria GM/MS no 888, de 04 de maio de 2021. Altera o Anexo XX da Portaria de Consolidação GM/MS no 5, de 28 de setembro de 2017, para dispor sobre os procedimentos de controle e de vigilância da qualidade da água para consumo humano e seu padrão de potabilidade. Diário Of União. 2021;(85):127-127.
- Manual virtual de aulas práticas do DEMIP/ICBS/UFRGS [Internet]. Departamentos de Microbiologia, Imunologia e Parasitologia (Instituto de Ciências Básicas da Saúde) e Interdisciplinar (Campus Litoral Norte) da Universidade Federal do Rio Grande do Sul. 2024. Disponível em: https://www.ufrgs.br/aulaspraticasdemip/?page_id=845. Acesso em: 20 de agosto de 2024.
- Cunha AMG. Análises clínicas. 2ª Vol. (Coleção Manuais de Farmácia, v.5). Salvador: Editora Sanar SA; 2021. 416 p.
- Barbosa FHF, Barbosa LPJL. Alternativas metodológicas em Microbiologia viabilizando atividades práticas. Revista de Biologia e Ciências de terra. Campina Grande. 2010; v10, n2, p 134-143.
- Lima JPDEC, Teles LQ. Demonstração de cápsulas bacterianas. Instituto Adolpho Lutz. 1942; 21p. Disponível em: http://www.ial.sp.gov.br/resources/insituto-adolfo-lutz/publicacoes/rial/40/rial-22_1942/b36.pdf. Acesso em: 17 de setembro de 2024.
- Rosenow EC. A New Stain for Bacterial Capsules with Special Reference to Pneumococci. J Infect Dis. 1o de julho de 1911;9(1):1-8. Disponível em: https://academic.oup.com/jid/article-abstract/9/1/1/821027. Acesso em: 10 de setembro de 2024.
- Muir R. Staining of bacterial capsules in films and sections. J Pathol Bacteriol. 1o de janeiro de 1915;20(2):257-9. Disponível em: https://onlinelibrary.wiley.com/doi/10.1002/path.1700200203. Acesso em: 20 de setembro de 2024.
- Hiss PH. A Contribution to the physiological differentiation of Pneumococcus and Streptococcus, and to methods of staining capsules. J Exp Med. 1o de fevereiro de 1905;6(4-6):317-45. Disponível em: https://pubmed.ncbi.nlm.nih.gov/19866975/. Acesso em: 20 de setembro de 2024.
- Anthony EE. A Note on Capsule Staining. 1931;73(1890):319-20. Disponível em: https://www.science.org/doi/10.1126/science.73.1890.319. Acesso em: 20 de setembro de 2024.
Correspondência
Joseli Maria da Rocha Nogueira
E-mail: [email protected]
