Prevalência de infecção pelo SARS-CoV-2 em profissionais de saúde em um Hospital Universitário no Rio de Janeiro durante a pandemia de COVID-19 em 2020
Prevalence of SARS-CoV-2 infection in healthcare professionals at a University Hospital in Rio de Janeiro during the COVID-19 pandemic in 2020
Mauricea Francisco da Silva Romero Gonzalez1
Ricardo de Souza Carvalho1
Isabelle de Carvalho Rangel1
Patrick Menezes1
Beatriz Pereira de Azevedo1
Fernando Raphael de Almeida Ferry1
1Hospiral Universitário Gaffrée e Guinle, Universidade Federal do Estado do Rio de Janeiro-UNIRIO, Rio de Janeiro, Brasil.
Recebido em 10/03/2021
Aprovado em 29/04/2021
DOI: 10.21877/2448-3877.202100959
INTRODUÇÃO
O Coronavírus da Síndrome Respiratória Aguda Grave 2 (SARS-CoV-2) foi notificado pela primeira vez em 31 de dezembro de 2019 à Organização Mundial de Saúde (OMS), sendo identificado como o patógeno que causa a doença de Coronavírus 19 (COVID-19). Trata-se de um betacoronavírus pertencente ao mesmo subgênero de epidemias anteriores: Coronavírus da Síndrome Respiratória Aguda Grave 2 (SARS-CoV), na China em 2002, e o Coronavírus da Síndrome Respiratória do Oriente Médio (MERS-CoV), no Oriente Médio em 2012, sendo transmitido através de gotículas respiratórias e aerossóis de pessoas infectadas.(1,2)
Após o primeiro surto de COVID-19 em Wuhan, China, uma onda de infecções causadas pelo SARS-CoV-2 espalhou-se da China para os continentes asiático, europeu, africano, americano e Oceania, levando a OMS a declarar, em 30 de janeiro, estado de Emergência de Saúde Pública de Importância Internacional (ESPII) e logo após, em 11 de março de 2020, pandemia por COVID-19,(3,4) adotando diretrizes para o diagnóstico laboratorial, manejo clínico, prevenção da infecção, controle nos serviços de saúde, comunicação de riscos e envolvimento da comunidade.(5,6)
O primeiro caso registrado e notificado pelo Ministério da Saúde (MS) de infecção por COVID-19 no Brasil foi o de um homem após retorno de viagem da Itália, em 26 de fevereiro de 2020. Logo após, houve um aumento dramático de casos de pessoas infectadas, levando o governo brasileiro em março de 2020 a implementar medidas de distanciamento físico.(7)
A sintomatologia causada pela COVID-19 assemelha-se à de outras viroses e as Diretrizes para o Diagnóstico e Tratamento do COVID-19 pela Comissão Nacional de Saúde da China classificou a gravidade do COVID-19 em três estágios: leve, quando os sintomas clínicos são leves, sem achados radiológicos anormais; moderado, quando há a manifestação de febre, tosse e outros sintomas estão presentes com pneumonia na tomografia computadorizada (TC) de tórax, e grave, quando há desconforto respiratório com frequência respiratória abaixo de 30/min, saturação de oxigênio ≤ 93%, pressão parcial de oxigênio no sangue arterial ≤ 300 mmHg e crítico, podendo evoluir para insuficiência respiratória, choque, tromboembolismo e disfunções vitais, exigindo monitoramento em unidades de tratamento intensivo.(8) A taxa de letalidade varia segundo faixa etária e condições clínicas associadas.(2) Hoje, a COVID-19 representa grande ameaça à saúde pública por já ter causado a morte em 6% dos infectados no mundo. Dados recentes da OMS computaram 98,2 milhões de casos notificados e mais de 2,1 milhões de mortes desde o início da pandemia.(9)
A pesquisa do vírus SARS-CoV-2 constitui importante etapa no monitoramento da taxa de incidência e gerenciamento do processo epidemiológico durante a pandemia de COVID-19 e os testes laboratoriais para o seu diagnóstico podem ser divididos em duas categorias: aqueles que detectam diretamente o vírus (seu genoma ou antígenos) e aqueles que detectam a resposta imunológica humana à sua presença (anticorpos IgM, IgA e IgG). Apesar de o método RT-PCR (uma técnica para amplificar um fragmento de RNA específico em DNA complementar usando a enzima transcriptase reversa) ter sido aprovado pela OMS como o “padrão ouro” de diagnóstico para detecção do SARS-CoV-2, testes de resposta imunológica são importantes para determinar a imunidade protetora em várias categorias da população infectada pelo SARS-CoV-2, permitindo monitorar o progresso da infecção em pacientes hospitalizados, rastreio de contactantes e sobretudo fornecer vigilância epidemiológica em nível regional, podendo ser realizados após o período agudo da doença ou exposição com infecção assintomática, para avaliar a resposta imunológica e sua duração, bem como respostas à vacinação contra o vírus. Desta forma, o teste rápido que detecta a presença de anticorpos contra o vírus SARS-CoV-2 pode ser utilizado para o estudo em uma população com o objetivo de estudar a sua imunidade contra a COVID-19.(10)
Estudos de Oliveira et al.,(11) a partir de um inquérito sorológico com pacientes ambulatoriais do Hospital das Clínicas na cidade de São Paulo (Brasil), demonstraram que 32,8% dos participantes que testaram positivo para anticorpos IgG anti-SARS-CoV-2 eram assintomáticos. Neste mesmo contexto, Hallal et al.,(12) em estudo semelhante porém com um grande estudo transversal onde foram realizados dois inquéritos sorológicos de Soroprevalência em 133 cidades englobando todos os estados brasileiros, demonstraram a alta heterogeneidade da prevalência com uma variação de 0% a 25,4%. Estas pesquisas de Oliveira e Hallal concluíram que a proporção de pacientes que desconheciam ter tido contato com o vírus reflete a escassez de exames realizados na população.(13)
Embora haja estudos de prevalência da COVID-19 na população mundial em geral, há uma compreensão limitada das taxas de infecção entre os profissionais de saúde, mesmo estes representando um componente particularmente importante nesta pandemia por SARS-CoV-2.(14) Indo de encontro com essa necessidade, alguns estudos de prevalência de anticorpos para SARS-CoV-2 entre profissionais de saúde tem demonstrado os fatores de risco para sua transmissão.
Os profissionais que trabalham na assistência à saúde na linha de frente no combate à pandemia causada pela COVID-19 colocam-se em posição de maior risco à infecção do que outros indivíduos da comunidade(15) e a falta de apresentações clínicas que caracterizem os indivíduos assintomáticos representam grande desafio para o controle da pandemia. Desta forma, o estudo da transmissão assintomática e suas implicações para a vigilância refletem a importância do estudo temporal e a dinâmica da infecção.(10)
Pesquisas realizadas em um hospital universitário, na Turquia demonstraram que, entre profissionais assistenciais, há um alto risco de transmissão da SARS-CoV-2 ao fornecer cuidados aos pacientes, apontando para a importância da pesquisa periódica do vírus, com o objetivo de o detectar precocemente e promover o isolamento destes profissionais infectados.(16)
Sotgiu et al.,(17) utilizaram um teste rápido de imunoensaio (Fluxo Lateral Point-of-Care) e demonstraram que 7,4% dos profissionais em atividade possuíam imunoglobulinas IgG e que 14,4%, apesar de assintomáticos, possuíam a doença ativa, apresentando imunoglobulinas IgM.
Estudos de Sotgiu e colaboradores(17) demonstraram que os resultados encontrados nos estudos de prevalência demonstram a importância em se obter respostas às questões epidemiológicas a respeito de anticorpos para COVID-19. Durante a pandemia, métodos como os de testagens simples, rápidos e em massa para detectar a infecção por SARS-CoV-2 são fundamentais para a tomada de medidas eficazes e de vigilância no combate à infecção. Desta forma, o teste rápido de Imunoensaio de fluxo lateral (LFIA) para o diagnóstico de COVID-19, representa uma tecnologia eficiente para o diagnóstico rápido de infecções por coronavírus. Estes testes são realizados pela metodologia da imunocromatografia,(18) são fabricados na forma de kits e requerem apenas uma gota de sangue, soro ou plasma. Os resultados são lidos visualmente pelo aparecimento de faixas nas zonas de controle e testes podem ser usados para estudos de triagem em locais como estações ferroviárias, aeroportos, clínicas privadas, hospitais rurais e unidades de diagnóstico não equipadas. Sua aplicação mais racional é a triagem em massa da população de grupos de risco, bem como de pessoas com uma forma assintomática da doença.(19,20)
Com o objetivo de avaliar a sensibilidade de três testes imunocromatográficos (ICT) para detecção rápida de anticorpos contra SARS-CoV-2,(21) destacou a importância da realização dos testes sorológicos quando o tempo de início dos sintomas for maior que uma semana, uma vez que a sensibilidade dos três ensaios de ICT foi notavelmente maior durante os estágios intermediário e tardio da doença.
OBJETIVOS
Realizar a soroprevalência qualitativa de anticorpos IgG e IgM anticoronavírus nos profissionais de saúde sintomáticos ou assintomáticos, das áreas assistencial e administrativa do Hospital Universitário Gaffrée e Guinle, no Rio de Janeiro, através de testes rápidos imunocromatográficos.
MATERIAIS E MÉTODOS
A iniciativa do estudo de prevalência de infecção pelo SARS-CoV-2 entre os profissionais de saúde do Hospital Universitário Gaffrée e Guinle foi proposta pela direção da instituição, que teve como objetivo principal quantificar a real exposição dos seus profissionais ao SARS-CoV-2, desde a decretação da pandemia pelo novo coronavírus pela Organização Mundial de Saúde em 11 de março de 2020,(13) e, secundariamente, subsidiar tomadas de decisões a respeito de medidas de prevenção e bloqueio da difusão da COVID-19 entre os trabalhadores do hospital. Deste modo, o estudo foi devidamente apresentado e aprovado pelo Comitê de Ética em Pesquisa do HUGG e todos os participantes que concordaram em participar do estudo assinaram o TCLE.
Para realização da pesquisa foi realizado o cálculo amostral tomando como base a população total de profissionais de saúde do hospital de 1.958 indivíduos, segundo o departamento de gestão de pessoas da instituição, entre médicos, enfermeiros, fisioterapeutas, residentes, recepcionistas, assistentes sociais, técnicos administrativos, entre outros. Tomou-se como base uma margem de erro amostral de 4,5% e um nível de confiança de 95% obtendo-se um tamanho amostral de 391 profissionais.
Todos os profissionais testados foram informados sobre os objetivos do estudo, riscos e vantagens. O material e as informações só foram coletados após assinatura do termo de consentimento livre e esclarecido.
Para execução dos testes foram adquiridos dois testes imunocromatográficos para pesquisa de anticorpos IgM e IgG para SARS-CoV-2: o kit COVID-19 IgG/IgM ECO Test® (ECO DIAGNÓSTICA, Nova Lima – MG, Brasil), doravante denominado TR-ECO e o kit Medtest Coronavírus (COVID-19) IgG/IgM (MedLevensohn e Hangzhou Biotest Biotech, Hangzhou, China), doravante denominado TR-MEDTEST. Ambos os testes se trata de ensaio imunocromatográfico de fluxo lateral sobre membrana para detecção qualitativa em 10-15min de AC IgM e IgG de maneira individualizada para o SARS-CoV-2. Segundo a análise de acurácia para testes diagnósticos registrados na ANVISA para a COVID-19,(5) ambos os testes demostraram alta sensibilidade e especificidade (Quadro 1).
Quadro 1 – Realização de testes diagnósticos aprovados pela ANVISA no Brasil para COVID-19
| COVID-19 IgG/IgM ECO Test | MedTest coronavírus (COVID-19) |
| IgG
Sensibilidade: 95% Especificidade: 99%
|
IgG
Sensibilidade: 97,4% (95%CI: 86,2-99,9%) Especificidade: 99,3% (95%CI: 96,2-99,9%) Precisão: 98,9 % (95%CI: 96,1-99,9%) |
| IgM
Sensibilidade: 90% Especificidade: 94% |
IgM
Sensibilidade: 86,8% (95%CI: 71,9%-95,6%) Especificidade: 98,6% (95%CI:95,0%-99,8%) Precisão: 96,1% (95%CI: 92,2%-98,4%) |
Fonte: Bulas TR-ECO® / TR-MEDTEST®
O protocolo para realização do estudo consistiu inicialmente na realização de pesquisa de AC através do TR-ECO em todos os profissionais de saúde convocados para testagem entre o período de 10/09/2020 a 12/11/2020. Todos os indivíduos da pesquisa concordaram em realizar um segundo teste imunocromatográfico comparativo, no caso o TR-MEDTEST, simultaneamente com o TR-ECO, isto é, com a mesma amostra de sangue coletado. Todos os profissionais participantes foram submetidos a um pequeno questionário e responderam sobre sinais e sintomas relacionados à COVID-19, realização de RT-PCR para SARS-CoV-2, desempenho de função assistencial ou administrativa, participação na assistência direta a pacientes com COVID-19, presença de comorbidades, além de sexo e idade. Para os casos de profissionais com critérios clínicos ou epidemiológicos, bem como todos os casos com detecção de AC IgM reagente, independente do teste imunocromatográfico realizado, foram afastados das atividades laborativas e submetidos ao RT-PCR para SARS-CoV-2.
Para o estudo foi considerado como critério de infecção pelo SARS-CoV-2 (atual ou passada) a presença de ao menos um resultado positivo em qualquer um dos testes executados para detecção de infecção pelo SARS-CoV-2 (RT-PCR, IgG ou IgM).
Para estudo dos dados, foram realizadas análises descritivas dos testes realizados, da prevalência de infecção pelo SARS-CoV-2 e das características dos profissionais de saúde. Para análise da normalidade foram utilizados os testes de Kolmogorov-Smirnov. Para análise das associações entre as variáveis de interesse ou exposição com a infecção pelo SARS-CoV-2, foram realizados o teste qui-quadrado ou o teste exato de Fischer e para a comparação de medianas foi utilizado o teste U de Mann-Whitney. Para análise de concordância foi utilizado o coeficiente de concordância kappa (k) entre os testes imunocromatográficos em comparação com o RT-PCR para SARS-CoV-2. Para quantificar os fatores preditores de infecção pelo SARS-CoV-2, foram realizadas a regressão logística uni e multivariada. A força da associação entre os fatores preditores foi expressa como razão de chances (OR, do inglês Odds-Ratio), juntamente com o intervalo de confiança de 95% e P-valor. As análises estatísticas foram consideradas significativas quando o valor de P ≤ 0,05. Todas as análises foram realizadas no programa estatístico IBM SPSS®, versão 27.0 para Mac.
RESULTADOS
Foram incluídos no estudo 391 profissionais de saúde que realizaram ao menos uma testagem para pesquisa de anticorpos IgG/IGM e/ou RT-PCR para SARS-CoV-2, segundo os critérios anteriormente citados, resultando em 891 testes imunocromatográficos para detecção de AC IgM/IgG – 391 profissionais realizaram TR-ECO (Tabela 1) e TR-MEDTEST (Tabela 2) e 109 teste de RT-PCR (Tabela 3). Os resultados dos testes imunocromatográficos e do RT-PCR estão apresentados nas respectivas tabelas.
Tabela 1 – Resultado TR-ECO
| Frequência | Porcentagem | Porcentagem válida | Porcentagem acumulativa | ||
| Válido | IgM+/IgG+ | 8 | 2,0 | 2,0 | 2,0 |
| IgM-/IgG+ | 146 | 37,3 | 37,3 | 39,4 | |
| IgM-/IgG- | 237 | 60,6 | 60,6 | 100,0 | |
| Total | 391 | 100,0 | 100,0 |
Tabela 2 – Resultado TR-MEDTEST
| Frequência | Porcentagem | Porcentagem válida | Porcentagem acumulativa | ||
| Válido | IgM+/IgG+ | 41 | 10,5 | 10,5 | 10,5 |
| IgM+/IgG- | 11 | 2,8 | 2,8 | 13,3 | |
| IgM-/IgG+ | 42 | 10,7 | 10,7 | 24,0 | |
| IgM-/IgG- | 297 | 76,0 | 76,0 | 100,0 | |
| Total | 391 | 100,0 | 100,0 |
Tabela 3 – Resultado RT-PCR SARS-CoV-2
| Frequência | Porcentagem válida | ||
| Válido | Não Reativo | 75 | 68,8% |
| Reativo | 34 | 31,2% | |
| Total | 109 | 100,0% | |
Dos profissionais participantes, a maioria composta por 271 indivíduos (69,7%) eram do sexo feminino e 118 (30,3%) do sexo masculino. A mediana da idade de todos os profissionais foi de 40 anos (IIQ 34-49). Quanto à atividade profissional, 181 (46,3%) profissionais desempenhavam atividade estritamente assistencial, isto é, diretamente no atendimento aos pacientes, e 100 (25,6%) profissionais desempenhavam atividades não-assistenciais; 110 (28,1%) profissionais não informaram atividade profissional. Quanto ao local das atividades, 268 (68,5%) profissionais desempenhavam suas atividades em áreas de enfrentamento à COVID-19, enquanto 13 (3,3%) profissionais desempenhavam suas atividades em outras áreas e 110 (28,1%) profissionais não informaram suas áreas de atuação.
Quanto aos resultados dos testes realizados para detecção do SARS-CoV-2, 178 profissionais (45,5% – IC 95% 40,4% – 50,6%) apresentaram ao menos um resultado positivo conforme critério da pesquisa para infecção pelo SARS-CoV-2. Não houve diferença significativa entre as medianas das idades dos pacientes que apresentaram infecção pelo SARS-CoV-2 (mediana 40 anos, IIQ 34-53) e dos que não apresentaram infecção (mediana 39 anos, IIQ 32-49), valor de P= 0,148. Também não houve diferença entre o sexo dos profissionais com infecção e sem infecção pelo SARS-CoV-2 (OR = 1,02; IC 95% 0,59 – 1,78).
Dos 178 profissionais que apresentaram infecção pelo SARS-CoV-2, apenas 115 (64,6%) responderam sobre a presença de sintomas relacionados à COVID-19, sendo que 71 (61,7%) relataram sintomas relacionados à COVID-19, enquanto que 44 (35,4%) dos profissionais relataram que não apresentaram nenhum sintoma, portanto considerados assintomáticos, e 63 não informaram sobre presença ou não de sintomas, sendo excluídos desta análise. Dos 127 relatos de sintomas relacionados à COVID-19 foram mais frequentemente apresentados pelos profissionais infectados: cefaleia 46,5% (59/127); perda de olfato 32,3% (41/127); perda de paladar 30,7% (39/127); tosse seca 27,6% (35/127); diarreia 24,4% (31/127); dores no corpo 27,6% (35/127); outros 13,4% (17/127); dores nas pernas 11,8% (15/127); tonteira 11,8% (15/127) e febre 9,4% (12/127), conforme o Gráfico 1. Importante salientar que os indivíduos com infecção sintomática pelo SARS-CoV-2 apresentaram mais de um sintoma e por isso o somatório do percentual dos sintomas ultrapassa os 100%.
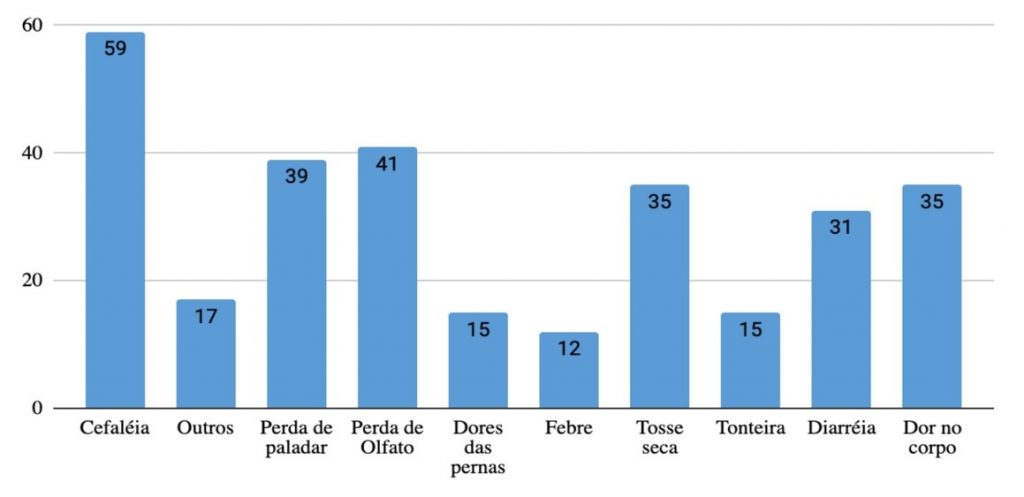
Gráfico 1. Frequência de sintomas relacionados à COVID-19 em pacientes com SARS-CoV-2 detectado.
Para avaliar a concordância dos testes imunocromatográficos foi utilizado o coeficiente de concordância kappa (k). Para a detecção da IgG através do TR-ECO obteve-se um k= 0,27 (p<0,01) e para a detecção da IgM pelo mesmo método um k=0,27 (p=0,44) tendo como teste de referência a detecção prévia do SARS-CoV-2 através de RT-PCR. Da mesma forma, foi realizada a mesma análise para a IgG do TR-MEDTEST, obtendo um k=0,40 (p<0,01) e para IgM pelo mesmo TR-MEDTEST, k= 0,42 (p<0,01) (Tabela 4).
Em relação à soroconversão após infecção confirmada por RT-PCR para SARS-CoV-2, 23 (67,7%) pacientes dos 34 com RT-PCR reagente apresentaram IgG e/ou IgM reagentes com o TR-ECO, enquanto 11 pacientes (32,3%) não apresentaram detecção de AC para SARS-CoV-2 pelo teste. Resultados semelhantes foram obtidos pelo TR-ECO, com 22 (64,7%) pacientes apresentando AC IgG e/ou IgM detectados, enquanto 12 (35,3%) não apresentaram AC detectados pelo método (Quadro 2).
A regressão logística univariada foi realizada para cada sintoma isoladamente e os resultados da Odds Ratio (OR) e dos Intervalos de Confiança de 95% estão expressos na Tabela 5.
Foi também realizada uma regressão logística binária multivariada com o intuito de verificar quais os sintomas seriam preditores para infecção pelo SARS-CoV-2 e o modelo contendo os sintomas de perda de paladar, perda de olfato e tonteira foi estatisticamente significativo [X2(2) = 44,3; p < 0,0001; R2 Nagelkerke = 0,20], porém perda de paladar não apresentou significância (p=0,06).
Não houve diferença estatística significativa entre os profissionais que desempenhavam suas atividades assistenciais e os profissionais que desempenhavam atividades administrativas quanto à chance de infecção pelo SARS-CoV-2, OR = 1,0 (IC 95% 0,6 – 1,7). Da mesma forma, não houve diferença estatística significativa entre os profissionais que desempenharam atividades assistenciais em áreas de enfrentamento da COVID-19 em comparação com aqueles que exerciam suas atividades administrativas em outras áreas da COVID-19, OR = 1,97 (IC 95% 0,6 – 6,5).
Tabela 4 – Resultado da concordância dos TR com a detecção do SARS-CoV-2 por RT-PCR
| Kappa | P-valor | Interpretação | ||
| TR-ECO | IgG | 0,27 | <0,01 | Sofrível |
| IgM | 0,27 | 0,44 | Não significativa | |
| TR-MEDTEST | IgG | 0,40 | <0,01 | Sofrível |
| IgM | 0,42 | <0,01 | Regular | |
Quadro 2 – Resultado soroconversão RT-PCR SARS-COV-2 x Testes rápidos
| Teste | Pesquisa de Anticorpo para SARS-CoV-2 | Pacientes com RT-PCR SARS-CoV-s Detectável |
| TR-ECO | IgM e/ou IgG reagentes | 23 (67,7%) |
| IgM e IgG Não reagentes | 11 (32,3%) | |
| TR-MEDTEST | IgM e/ou IgG reagentes | 22 (64,7%) |
| IgM e IgG Não reagentes | 12 (35,3%) |
Tabela 5 – Tabela com resultado da Regressão Logística Univariada e Multivariada para infecção pelo SARS-CoV-2.
| Sintomas preditores para
SARS-CoV-2 |
Frequência
N=127 |
Regressão Logística Univariada
N=277 |
Regressão Logística Multivariada
N=277 |
|||||||||
| OR | IC 95% para OR | P | R2 | OR | IC 95% para OR | P | *R2 | |||||
| Limite inferior | Limite superior | Limite inferior | Limite superior | |||||||||
| Perda de olfato | 32,3% | 7,5 | 3,5 | 16,2 | <0,001 | 0,15 | 3,1 | 1,1 | 9,3 | <0,05 | 0,20 | |
| Perda de paladar | 30,7% | 9,0 | 3,9 | 21,2 | <0,001 | 0,16 | 3,2 | 0,9 | 10,7 | 0,062 | ||
| Tonteira | 11,8% | 6,6 | 1,8 | 23,2 | <0,01 | 0,05 | 4,1 | 1,1 | 16,0 | <0,05 | ||
| Dores no corpo | 27,6% | 3,0 | 1,6 | 5,6 | <0,001 | 0,06 | ||||||
| Diarreia | 24,4% | 2,4 | 1,2 | 4,5 | <0,01 | 0,03 | ||||||
| Cefaleia | 46,5% | 1,7 | 1,1 | 2,7 | 0,032 | 0,02 | ||||||
| Febre | 9,4% | 2,1 | 0,8 | 5,6 | 0,12 | 0,01 | ||||||
| Tosse seca | 27,6% | 1,7 | 1,0 | 3,0 | 0,06 | 0,02 | ||||||
| Outros sintomas | 13,4% | 2,1 | 0,9 | 4,9 | 0,06 | 0,02 | ||||||
| Dores nas pernas | 11,8% | 1,8 | 0,8 | 4,3 | 0,14 | 0,01 | ||||||
*R2 de Nagelkerke.
DISCUSSÃO
Poucos são os estudos mundiais que demonstram evidências sorológicas em multiprofissionais envolvidos com a assistência na saúde; mesmo estes, pela proximidade com os pacientes infectados pelo vírus, serem grandes vetores potenciais para a sua disseminação.(22) No número absoluto de mortes, os Estados Unidos – cujo primeiro óbito foi registrado em 29 de fevereiro –, a Índia e o Brasil chamam atenção, sendo os países mais afetados do mundo também no número de casos.
O Brasil é um dos países mais impactados pela pandemia COVID-19,(23) e o presente estudo demonstrou que 44,2% de uma população representativa de profissionais expostos ao vírus durante um período da pandemia por COVID-19 desenvolveram anticorpos anti-IgG SARS-CoV-2 de forma sintomática (40,5%) ou assintomática (23,7%). Estudo semelhante realizado por Crawford et al.,(24) no Reino Unido, demonstrou evidência sorológica em 18% dos profissionais de saúde (115 de 633) que testaram como soropositivos, com taxa de COVID-19 sintomático de 27,5% em comparação com uma taxa assintomática de 15,1%. Hipotetizamos que taxas maiores apresentadas em nosso estudo podem estar relacionadas com a educação efetiva proposta nos dois países no uso dos equipamentos de proteção individual adequados.
Em relação às associações demográficas de soroprevalência de SARS-CoV-2 entre os profissionais, não foram encontradas relevâncias significativas quanto a idade e sexo, assemelhando-se e confirmando os achados de Patel,(22) com exceção de raça-cor, onde dados encontrados por ele sugerem associação entre variabilidade genética e imunidade inata, embora ainda não haja dados que comprovem a especulação em SARS-CoV-2.
É fato que o número total de casos reais de COVID-19 na instituição é muito maior do que os confirmados, bastando observar o número de participantes que se abstiveram de responder o questionário no que se refere a sinais e sintomas.
A regressão logística multivariada apontou a perda de olfato e a tonteira como fatores preditores para SARS-CoV-2, sintomas altamente subjetivos e contrários à maioria dos estudos publicados. A febre, sintoma importante em processos infecciosos, que na maioria dos estudos publicados apresenta proporção de relevância, como no de Wang et al.,(18) no presente estudo não representou proporção apreciável, o que requer atenção clínica especial.
Segundo o CDC, os testes de triagem têm como objetivo identificar as pessoas infectadas que são assintomáticas e não têm exposição conhecida, suspeita ou relatada ao SARS-CoV-2. A triagem ajuda a identificar casos desconhecidos para que medidas possam ser tomadas para prevenir futuras transmissões. Exemplos de triagem incluem: testar funcionários em um ambiente de trabalho; testar alunos, professores e funcionários em uma escola ou universidade; testar uma pessoa antes ou depois da viagem; teste em casa para alguém que não tem sintomas associados ao COVID-19 e nenhuma exposição conhecida a alguém com COVID-19.(25)
De acordo com Xavier et al.,(26) o uso racional dos marcadores laboratoriais específicos deve respeitar a cronologia da doença, e a interpretação correta pode fornecer subsídios para um melhor manejo dos pacientes acometidos, bem como identificar portadores assintomáticos ou com poucos sintomas. Para vigilância epidemiológica, é necessário coletar amostras clínicas para detecção viral ou resposta imune em larga escala para definir uma situação real dessa doença em todo o mundo.
CONCLUSÃO
A triagem de rotina dos profissionais envolvidos na assistência em saúde deve ser implementada para reduzir a transmissão viral e medidas de segurança devem ser enfatizadas como uso adequado de equipamentos de proteção individual para proteger esses trabalhadores essenciais de futuras ondas pandêmicas.
Nesse contexto, os testes rápidos utilizados em rastreios da infecção por SARS-CoV-2 são uma necessidade urgente, para permitir um plano eficaz e rápido de diagnóstico e para prevenir futuras transmissões. Ainda que os testes rápidos não sejam recomendados como única forma de diagnóstico da doença, observamos ser uma excelente alternativa para a triagem inicial e testagem em massa da população com a qual contamos desde o início da pandemia como ferramenta laboratorial.
Considerando-se a orientação da OMS quanto à necessidade de testagem em massa das populações, a expansão da pandemia e as barreiras atuais à realização de RT-PCR compatível com a demanda, as empresas produtoras de reagentes diagnósticos laboratoriais passaram a desenvolver testes para pesquisa de anticorpos e antígenos relacionados ao vírus. A literatura relacionada à produção de anticorpos (anticorpogênese) frente a um estímulo antigênico evidencia ser esta uma resposta individual. Logo, concluímos em nossos achados que a quantidade de anticorpos formados poderá variar e ocasionar diferentes momentos de detecção destes anticorpos, embora a grande maioria dos trabalhos em infecções por coronavírus assinalam que, por volta do sétimo e oitavo dia, eles já sejam evidenciados, ressaltando, então, que alguns pacientes poderão levar tempo menor ou maior.
Estabelecer estratégias de testagem para COVID-19 é fundamental para o aumento do acesso aos testes para definir a soroprevalência. Cabe notar que uma grande quantidade de novos estudos continua sendo produzida todos os dias e que as recomendações apresentadas estão sujeitas a mudanças conforme vão sendo produzidas novas evidências.
AGRADECIMENTOS
Aos muitos membros da equipe médica, de enfermagem da linha de frente e ao pessoal de laboratório do Hospital Universitário Gaffrée e Guinle pelo tratamento dispensado a esses pacientes.
Abstract
The seroprevalence of SARS-CoV-2 was determined from a cross-sectional epidemiological survey carried out at the Gaffrée and Guinle University Hospital in the city of Rio de Janeiro, Brazil from October to November 2020 during the COVID-19 pandemic in the population of employees who worked in that period. Sociodemographic characterization was performed in addition to the analysis of associations between the variables of interest or exposure with SARS-CoV-2 infection to establish which signs and symptoms were more prevalent. For the study, blood samples were collected and immunochromatographic assays (COVID-19 IgG/IgM ECO Test® and Medtest® Coronavirus (COVID-19) IgG/IgM) were used to detect IgG and IgM anti-SARS-CoV-2. A sample calculation obtaining 391 health professionals showed that 173 (44.2%) individuals had at least one positive result for SARS-CoV-2 infection. There was no significant difference between the median ages of patients who had SARS-CoV-2 infection (median 40 years, IIQ 34-53) and those who did not have infection (median 39 years, IIQ 32-49), P value = 0.148. There was also no difference between the sex of professionals with and without SARS-COV-2 infection (OR = 1.02; 95% CI 0.59 – 1.78). Of the 173 professionals who had SARS-COV-2 infection, 70 (40.5%) reported symptoms related to COVID-19, while 41 (23.7%) professionals reported that they had no symptoms and 62 (35.8%) did not report on the presence or absence of symptoms, being excluded from the analysis. The symptoms most frequently presented by the infected professionals were: headache 46.5% (59/127); loss of smell 32.3% (41/127); loss of taste 30.7% (39/127); dry cough 27.6% (35/127); diarrhea 24.4% (31/127); body pain 27.6% (35/127); another 13.4% (17/127); leg pain 11.8% (15/127); dizziness 11.8% (15/127) and fever 9.4% (12/127). Establish a surveillance protocol with an easy and quick test for COVID-19 policies among frontline and care professionals is imperative to control the transmission of SARS-CoV-2 and define epidemiological criteria that guide the decision-making regarding the isolation of symptomatic and asymptomatic infected professionals.
Keywords
COVID-19; SARS-CoV-2; Seroprevalence
REFERÊNCIAS
- Patel R, Babady E, Theel ES, Storch GA, Pinsky BA, ST. George K, et al. Report from the American Society for Microbiology COVID-19 International Summit, 23 March 2020: Value of Diagnostic Testing for SARS–CoV-2/COVID-19.
- Pereira D, Costa C, Santos C, Dantas E. Epidemiological, clinical and therapeutic aspects of COVID-19. Health Biol Sci. 2020;8(1):1-8; doi: 10.12662/2317-3206jhbs.v8i1. 3297.p1-8.2020.
- Davenne E, Giot Jb, Huynen P. Coronavirus et COVID-19: le point sur une pandémie galopante. Rev Med Liege. 2020 Abr; 75(4): 218-225.
- Manrique F, Calderon A, González C, et al. SIR model of the COVID-19 pandemic in Colombia. Rev Salud Publica 2020 Jan-Fev; 22(1): 1–9.
- BRASIL. MINISTÉRIO DA SAÚDE. COVID-19: Painel coronavírus. 2020. Disponível em: <https://covid.saude.gov.br/>. Acesso em: 08 de maio de 2021.
- Lanarm, Coelho C, Gomes M, Cruz O, Bastos L, Villela D, et al. Emergência do novo coronavírus (SARS-CoV-2) e o papel de uma vigilância nacional em saúde oportuna e efetiva. Cad. Saúde Pública 2020; 36:e00019620.
- Villela EFM, López, RVM Sato, APS, et al. Surto de COVID-19 no Brasil: adesão às medidas preventivas nacionais e impacto na vida das pessoas. pesquisa online. BMC Public. Health 21, 152 (2021). https://doi.org/10.1186/s12889-021-10222-z
- Feng Y, Ling Y, Bai T, Xie Y, Huang J, Li J, et al. COVID-19 with Different Severities: A Multicenter Study of Clinical Features. Am J Respir Crit Care Med. 2020 Jun 1;201(11):1380-1388. doi: 10.1164/rccm.202002-0445OC. PMID: 32275452; PMCID: PMC7258639.
- World Health Organization (WHO). Population-based age-stratified seroepidemiological investigation protocol for COVID-19 virus infection. Geneva: WHO; 2020. [acessado 2020 Mar 21]. Disponível em: www.who.int/publications-detail/population-based-age-stratified-seroepidemiological-investigation-protocolfor-covid-19-virus-infection.
- Park S, Cornforth D, Dushoff J, Weitz J. The time scale of asymptomatic transmission affects estimates of epidemic potential in the COVID-19 outbreak. Epidemics. 2020; 31:100392. doi: 10.1016/j.epidem.2020.100392.
- Oliveira, Wanderson Kleber de et al. Como o Brasil pode deter a COVID-19. Epidemiol. Serv. Saúde, Brasília, v. 29, n. 2, e2020044, 2020.
- Hallal, Pedro Curi et al. Evolução da prevalência de infecção por COVID-19 no Rio Grande do Sul, Brasil: inquéritos sorológicos seriados. Ciênc. saúde coletiva, Rio de Janeiro, v. 25, supl. 1, p. 2395-2401, jun. 2020.
- World Health Organization (WHO). Laboratory testing strategy recommendations for COVID-19. Interim guidance. Reference: WHO/2019-nCoV/lab_testing/2020.1, 21 March 2020.
- Brzostek S, Yang H, Chadburn A, Orlander D, Na A, Thomas R et al. COVID-19 Viral and Serology Testing in New York City Health Care Workers, American Journal of Clinical Pathology, Volume 154, Edition 5, November de 2020, páginas 592-595.
- Ferioli M, Cisternino C, Leo V, Pisani L, Palange P, Nava. Protegendo profissionais de saúde da infecção por SARS-CoV-2: indicações práticas. Eur Respir Rev, 29 (155) (2020), p. 200068.
- Celebi A, & Eroglu Çakmakoglu E. (2020). Nova doença coronavírus 2019 (COVID-19) e desafios em práticas odontológicas. International Dental Research, 10 (3), 100-115. https://doi.org/10.5577/intdentres.2020.vol10.n3.5
- Sotgiu G, Dobler CC. Social stigma in the time of coronavirus disease 2019. Eur Respir J 2020; 56: 2002461 [https://doi.org/10.1183/13993003.02461-2020].
- Wang W, Chen, HE Q. et al. Características clínicas de pacientes internados com doença coronavírus 2019 (COVID-19) na província de Sichuan. BMC Infect Dis 21, 155 (2020). https://doi.org/10.1186/s12879-021-05825-1.
- Pan Y, Li X, Yang G, Fan J, Tang Y, Zhao J, et al. Serological immunochromatographic approach in diagnosis with SARS-CoV-2 infected COVID-19 patients. J Infect. 2020.
- Biosciences / Orient Gene Biotech Official Website. O teste rápido de ponto de atendimento COVID-19 IgG / IgM. Disponível online: https://stocknewsnow.com/companynews/5035338834942348/AYTU/101843 . Acesso em 15 de janeiro de 2021.
- Guedez-López GV, Alguacil-Guillén M, González-Donapetry P, Bloise I, Tornero-Marin C, González-García J, Mingorance J, García-Rodríguez J; SARS-CoV-2 Working Group. Evaluation of three immunochromatographic tests for rapid detection of antibodies against SARS-CoV-2. Eur J Clin Microbiol Infect Dis. 2020 Dec;39(12):2289-2297. doi: 10.1007/s10096-020-04010-7. Epub 2020 Aug 17. PMID: 32808111; PMCID: PMC7431115.
- Patel M, Meera N, Pirozzoli E, Cienfuegos M, Aitken E. Prevalência e fatores sociodemográficos do anticorpo SARS-CoV-2 em profissionais de saúde multiétnicos. Clinical Medicine Jan 2021, 21 (1) e5-e8; doi: 10.7861 / clinmed.2020-0619.
- Orellana Y, et al. Excess deaths during the COVID-19 pandemic: underreporting and regional inequalities in Brazil. Cad. Saúde Pública; 37(1): e00259120, 2021.
- Crawford Forrest W, Jones S, Cartter M, Dean SG, Warren JL, Li, Z, et al. (2021) Impact of close interpersonal contact on COVID-19 incidence: evidence from one year of mobile device data. Submitted.
- CDC. Interim Guidelines for COVID-19 Antibody Testing [Internet]. 2020. Available from: https://www.cdc.gov/coronavirus/2019-ncov/lab/resources/antibody-tests-guidelines.html.
- Xavier, Ana Lúcia R. et al. COVID-19: manifestações clínicas e laboratoriais na nova infecção por coronavírus. J. Bras. Patol. Med. Lab., Rio de Janeiro, v. 56, e3232020, 2020.
Correspondência
Mauricea Francisco da Silva Romero Gonzalez
Hospital Universitário Gaffrée e Guinle – UNIRIO/EBSERH
Rua Mariz e Barros, 775 – Maracanã,
Rio de Janeiro – RJ, 20270-004
E-mail: [email protected]
