Prevalência de Campylobacter spp. termofílicos em primatas não humanos da espécie Macaca mulatta provenientes de centro criatório para uso como biomodelos
Prevalence of thermophilic Campylobacter spp. in non-human primates of the Macaca mulatta species from a breeding center for use as biomodels
Paula Borba Cruz1
Fernanda Nunes Santos2
Wagner Thadeu Cardoso Esteves3
Jaime Antonio Abrantes1
Fabio Alves da Silva4
Ana Cristina Araújo Pinto4
Daniel Rouede de Andrade Oliveira4
Joseli Maria da Rocha Nogueira5
- Mestre. DCB-ENSP – Fiocruz – Rio de Janeiro-RJ, Brasil..
- Doutorado. DCB-ENSP – Fiocruz – Rio de Janeiro-RJ, Brasil.
- Mestre. Lab. Zoonoses bacterianas – IOC – Fiocruz – Rio de Janeiro-RJ, Brasil.
- Graduado(a). Primatologia – ICTB – Fiocruz – Rio de Janeiro-RJ, Brasil.
- Doutorado. Fiocruz – Chefe do Laboratório de Microbiologia – ENSP – Fiocruz – Rio de Janeiro-RJ, Brasil.
Instituição: Fundação Oswaldo Cruz – Fiocruz – Rio de Janeiro-RJ, Brasil.
Artigo recebido em 13/12/2017
Artigo aprovado em 16/02/2018
DOI: 10.21877/2448-3877.201800654
INTRODUÇÃO
As bactérias do gênero Campylobacter são microaerófilas, morfotintorialmente se apresentam como bastonetes Gram-negativos, encurvados, em forma de S ou de forma espiralada, não são esporuladas e medem 0,2 a 0,5 mm de diâmetro de largura e 0,5 a 5,0 mm de comprimento; podem se apresentar com formas cocoides nos cultivos antigos e geralmente são móveis graças a um flagelo localizado em uma ou nas duas extremidades da célula.(1-3) São quimiorganotróficos, têm metabolismo respiratório; são incapazes de utilizar açúcares (nem oxidação nem fermentação); apresentam na sua bioquímica de identificação a prova citocromo oxidase positiva; produção da enzima catalase variável; não hidrolisam a gelatina nem a ureia (com exceção às linhagens atípicas do Campylobacter lari e linhagens do Campylobacter sputorum biovar Paraureolyticus) e são desprovidos de lipase.(4)
Este gênero foi proposto em 1963 por Sebald e Véron para uma bactéria conhecida pelo nome de “Vibrio fetus”. Na década de 70, incluíram no gênero Campylobacter novas espécies e, em função de suas características fenotípicas, elas foram repartidas em três grupos: os que produzem a enzima catalase e não produzem H2S (Campylobacter fetus subsp. fetus e Campylobacter fetus subsp. venerealis); os que produzem a enzima catalase e produzem H2S (C. coli e C. jejuni) e os que não possuíam a enzima catalase (Campylobacter sputorum subsp. bubulus e Campylobacter sputorum subsp. sputorum).(5) Atualmente, esse gênero conta com 32 espécies e 13 subespécies.(6)
O reconhecimento nos últimos anos de algumas espécies como patógenos humanos reforçou também a importância do Campylobacter na medicina veterinária, já que alguns são reconhecidamente agentes de importantes zoonoses (doenças transmitidas de animais vertebrados ao homem) como C. jejuni, C. coli e C. fetus subsp. fetus. Estudos em modelos animais têm ajudado a elucidar alguns dos mecanismos patogênicos desses agentes, especialmente quanto aos fatores de virulência.(7)
Campylobacteriose e a sua ocorrência em Primatas não Humanos (PNH)
A campilobacteriose já era uma doença conhecida desde o século XIX, entretanto só foi reconhecida como zoonose e estudada em detalhe a partir da década de 1970. A doença tem distribuição mundial e pode causar desde diarreias autolimitadas até graves enterocolites.(8) Em humanos já foi identificado como causador da síndrome de Guillain-Barré e também como causador de septicemias fatais, sendo considerada pela OMS e pelo CDC como uma das principais doenças diarreicas do mundo.(9,10)
A doença foi detectada e descrita pela primeira vez em animais de laboratório, em 1982, por Fox e colaboradores.(11) O mecanismo de virulência primária utilizado pelo Campylobacter spp. para produzir colite ainda é obscuro. No entanto, já é reconhecida participação de enterotoxinas e citocinas no processo de “invasão” bacteriana no organismo.(12)
A partir do final da década de 1980 surgiram os primeiros relatos de infecções de animais do gênero Macaca com C. jejuni,(13) tendo sido descrita no mundo e em diferentes localidades no Brasil a susceptibilidade à bactéria C. jejuni, por diferentes espécies do gênero Macaca de centros de criação em cativeiro destinadas ao uso como biomodelos.(3,14,15)
Paul-Murphy,(16) em 1993, fez a primeira correlação de casos de enterocolites geradas por infecções bacterianas em Macaca mulatta. Estudos seguintes demonstraram que as enterocolites recorrentes causadas por Campylobacter spp. eram a principal causa de morbidade em colônias de primatas não humanos mantidos em cativeiro.(17)
Segundo Pielsticker e colaboradores,(18) apesar de alguns animais portarem Campylobacter sp. de forma assintomática, outros podem desenvolver os sintomas clássicos da doença, não tendo ainda sido explicada a razão desta variação na ocorrência, pois, em contrapartida, já houve também alguns registros de animais da espécie Macaca mulatta desenvolvendo a forma grave da doença, inclusive com septicemia.(19) A imunidade pode ser um fator importante na manifestação da campilobacteriose nestes animais, pois os filhotes desmamados com menos de seis meses são mais susceptíveis a desenvolver a forma grave e geralmente evoluem a óbito.(20,21)
Em função dos relatos associados à presença deste microrganismo em animais de cativeiro, foi reforçada a necessidade de se pesquisar este agente e acompanhar o “status” sanitário, fazendo avaliações clínicas e microbiológicas periódicas em animais mantidos em instalações de criação,(22) de forma a viabilizar a experimentação científica com estes animais, já que a presença de tais infecções também pode interferir no desenvolvimento das pesquisas de medicamentos e vacinas, além de gerar resultados duvidosos.(23) Segundo Sasseville e Diters,(24) as análises periódicas deste “status” sanitário têm permitido verificar que os animais infectados na colônia são fonte potencial de contaminação para os animais saudáveis e os tratadores que fazem o manejo e têm contato direto.
Detecção do agente bacteriano
A detecção de Campylobacter sp. em amostras de fezes pelo método “ouro”, preconizado pelo Ministério da Saúde,(25) consiste na cultura em meio ágar seletivo, a 42ºC e atmosfera com oxigênio reduzido pela passivação do cobre.
Os métodos moleculares, apesar de eficientes,(6) ainda são bastante custosos e, além de necessitar de um laboratório adaptado para essa metodologia, possuem, segundo Gandra,(26) menor sensibilidade quando comparados às demais metodologias.
Os imunoensaios poderiam ajudar em tal questão devido à redução do tempo de execução em relação à cultura e o custo/facilidade de realização em relação aos métodos moleculares, mas também possuem problemas de acurácia por apresentarem resultados falsos positivos e negativos.(27) Além disso, em alguns testes, antes de detectar o antígeno, a amostra deve passar por um meio de enriquecimento ou processo de filtração, o que eleva o tempo de detecção a patamares próximos aos da cultura clássica.(28)
Com base nos recursos disponíveis e na necessidade da detecção de Campylobacter spp. para verificação do status sanitário de uma colônia de criação de Macaca mulata, foi realizada, por metodologia clássica de cultivo, a pesquisa da presença deste microrganismo.
MATERIAL E MÉTODOS
As amostras de PNH adultos (a partir de 1 ano de vida), foram coletadas pela equipe do setor de criação do Instituto de Ciência e Tecnologia em Biomodelos (ICTB) pertencente à Fundação Oswaldo Cruz (Fiocruz) durante o manejo médico anual realizado no período de Abril a Julho de 2016 (Comissão de ética no uso animal – CEUA -Fiocruz – licença LW 5/16).
Com os animais anestesiados, retirou-se material fecal por meio da utilização de swabs estéreis que, após introdução na ampola retal, foram acondicionados em meio de transporte Cary & Blair. Foram coletados, no total, 52 swabs fecais (10% da colônia) e enviados para o Setor de Campylobacter do Laboratório de Zoonoses Bacterianas do IOC- Fiocruz.
Posteriormente foram semeados em meio de cultura seletiva à base de ágar Columbia, acrescido com 0,4 g% de carvão ativado, 0,5 mL% de solução redutora de oxigênio (FBP-0,5mL% de sulfato ferroso, bissulfito de sódio e piruvato de sódio) e 0,5mL% de solução de antibiótico (cefalotina 81mg+ lactato de trimetoprim 25mg + vancomicina 50 mg + actidione 10mg + colistina 11mg + água destilada 25 mL). As placas contendo os meios semeados por esgotamento foram incubadas a 42ºC por 48 horas (temperatura ideal para isolamento de Campylobacter termofílico), em atmosfera ideal de microaerofilia, gerada pelo método da passivação de cobre.(29)
Após a incubação, o diagnóstico inicial foi realizado com base na morfologia colonial (transparentes com brilho d’água) e características morfotintoriais em microscopia de campo claro, a partir do método de Gram, seguindo a descrição de Lauria-Filgueiras e Hofer.(1) A identificação presuntiva das amostras foi obtida pela observação de bastonetes curvos ou em forma de “S”, Gram-negativos ou presença de células cocoides, características de amostras em estágio degenerativo.
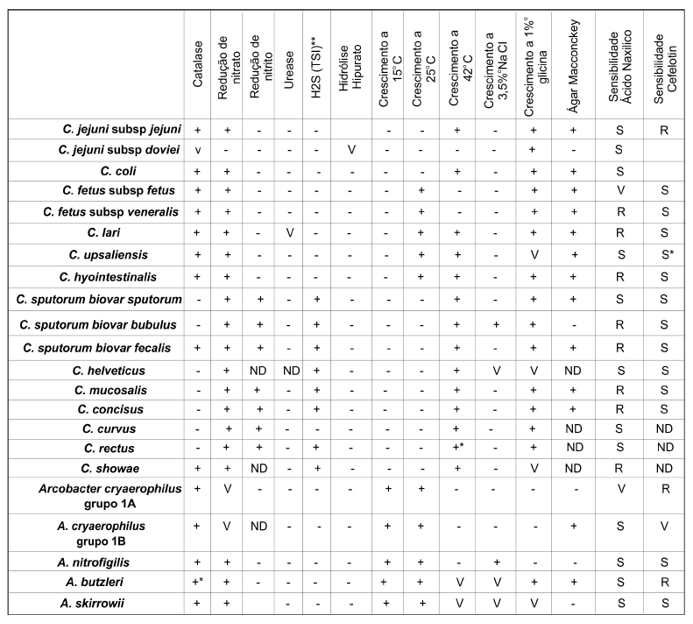
Quando as amostras apresentaram colônias típicas e morfologia esperada, foi realizada, para diagnóstico confirmatório, uma série de testes bioquímicos clássicos (Quadro 1) para confirmação do gênero bacteriano e identificação ao nível de espécie.(25,29)
Antes da avaliação bioquímica, uma alíquota da amostra foi armazenada em tubo contendo água peptonada pH 7,0-7,2 com 20% de glicerol e estocada a -70C seguindo as recomendações de Esteves.(4)
Resultados e Discussão
A partir da realização da técnica clássica de cultivo, não foi possível demonstrar em 38 (73%) das amostras de M. mulatta a presença de Campylobacter spp., já que não foi detectado nenhum tipo de crescimento nos meios seletivos. Neste grupo de primatas, somente 14 (27%) animais apresentaram cultivo positivo para o gênero; destes, em 13,46% das amostras foi encontrada C. coli, 11,54% apresentaram C. jejuni e, em 1,92%, não foi possível definir a espécie (Tabela 1).
O percentual de isolamento da espécie C. coli neste trabalho corrobora com os resultados encontrados por Andrade e colaboradores,(29) que analisaram esta mesma colônia, de 1995 a 1999 e em 2002 e 2003, tendo publicado um estudo há exatamente 10 anos. Apesar da mudança esperada pela rotatividade de indivíduos, verifica-se a manutenção deste gênero bacteriano e a preponderância da espécie C. coli mostrando não só esse mesmo perfil, mas que a redução da carga bacteriana e o controle deste micro-organismo não ocorreram, já que valores semelhantes foram encontrados nesse estudo.
Gonçalvez e colaboradores(30) relatam que o hábito diurno, o sedentarismo e preferência alimentar dos animais da espécie Macaca mulatta por frutas reduz o contato com outras fontes de contaminação por Campylobacter spp., o que sugere que outras espécies do gênero Macaca mantidos em cativeiro, de hábitos diversos, podem apresentar ainda maiores percentuais de isolamento, como ocorreu nos estudos de Cruz e colaboradores,(31) que, analisando uma colônia de Macaca fascicularis, detectaram a presença do gênero Campylobacter em 75,86% dos animais estudados.
Os percentuais Campylobacter spp. encontrados reproduzem também o que foi descrito anteriormente na literatura para animais provenientes de criatórios,(1,3,14,29) refletindo novamente a susceptibilidade moderada de Macaca mulatta.
Destacamos que, assim como observado no trabalho de Andrade e colaboradores,(29) nos indivíduos onde ocorreu isolamento de Campylobacter, não foi detectado nenhum sintoma clínico mais severo, já que muitos animais possuem diarreia recorrente, sugerindo alguma forma de adaptação dos animais a esse microrganismo. Por outro lado, esta possível simbiose(32) do microrganismo com os primatas estudados não minimiza o fato de que Campylobacter spp. continua presente nestas colônias, possibilitando infecções cruzadas e possível interferência nos procedimentos experimentais. O que reforça mais ainda mais a necessidade de monitoramento microbiológico constante destes animais, não só para melhoria do status sanitário da colônia e garantia da qualidade dos animais fornecidos, mas também para evitar o risco de contaminação dos profissionais que lidam com esses primatas.
Abstract
Objective: Campylobacteriosis is one of the major enteric diseases in the world. It occurs not only in humans but also in non-human primates, being thus important in the health monitoring of colonies of animals from scientific breeding grounds. It is caused by bacteria of the genus Campylobacter, whose detection in animal breeding laboratory, allows not only to control the disease and prevent its dissemination, but to ensure the quality of the research that will be carried out on these biomodels. Based on the importance of this isolation, our objective was to verify the health status of a colony of Macaca mulatta, using as reference the presence of Campylobacter spp. Methods: During the annual medical management, 52 fecal swabs were collected from adult non-human primates, representing a percentage of 10% of the total colony. This material was submitted to the sowing / incubation scheme and identification of Campylobacter sp. following the recommendations of microbiological cultivation, including isolation, Gram-test and biochemical tests. The entire process took from 5 to 7 days in microaerophilic atmosphere. Results: Campylobacter were isolated in 14 specimens. Of these, seven were C. coli carriers, six C. jejuni carriers and in one specimen it was not possible to define the Campylobacter species isolated. Conclusion: Despite the low prevalence (27%), these results reinforce the need for constant microbiological monitoring of primates belonging to the colony, aiming at not only the quality of the animals provided, but minimizing the risk of contamination within the colony and of contagion by professionals dealing with animals, since Campylobacter has an important zoonotic potential.
Keywords
Campylobacter; Primatas; Macaca mulatta
REFERÊNCIAS
- Lauria-filgueiras AL, Hofer E. Diversity of Campylobacter isolates from three activated sludge systems. Memorias Do Instituto Oswaldo Cruz. 1998 Jun; 93(3):295-8.
- Bergey, DH, Holt JG. Group 2: Aerobic/microaerobic motile heliccal/vibrioid Gram negative bacteria. In: Bergey DH, Holt JG. Manual of determinative bacteriology. 9. ed., Philadelphia. Lippincott Williams & Wilkins, 2000. p 41.
- Lauria-filgueiras AL. Circulação de espécies termofílicas de Campylobacter em primatas não humanos mantidos em cativeiro. Rio de Janeiro. Tese (Doutorado em Biologia Parasitária) – Instituto Oswaldo Cruz-Fiocruz; 2000.
- Esteves WTC, Ferreira AP, Siciliano S. Potencial impacto na Saúde Pública por Campylobacter spp. Estudo de caso: curso inferior do rio São João, RJ, Brasil. Cadernos de Saúde Coletiva. 2011; 19:74-81.
- Veron, M, Chatelain R. Taxonomic Study of the Genus Campylobacter Sebald and Veron and Designation of the Neotype Strain for the Type Species, Campylobacter fetus (Smith and Taylor) Sebald and Veron. Int J Syst. Bacteriol. 1973;23:122–34.
- Medeiros VM, Bricio SML, Clementino MM. Identificação de Campylobacter jejuni e Campylobacter coli isoladas de carcaças resfriadas de Frango pela Multiplex PCR. Vigil. sanit. Debate. 2015;3(3):97-103. Disponível em: http://www.visaemdebate.incqs.fiocruz.br/ (Acesso em 12/12/2017).
- On SL, Atabay HI, Corry JE, Harrington CS, Vandamme P. Emended description of Campylobacter sputorum and revision of its infrasubspecific (biovar) divisions, including C. sputorum biovar paraureolyticus, a urease-producing variant from cattle and humans. Int J Syst. Bacteriol. 1998;48(1):195-206.
- Acha PN, Szyfres B. Zoonoses and communicable diseases common to man and animals. In: Pan American Health Organization. Pan American Sanitary Bureau, Regional Office of the World Health Organization, Washington, D.C, 2001. Disponível em: http://www.paho.org/hq/index.php?option=com_docman&task=docview&gid=19187&Itemid =270&lang=en (Acesso em: 14 dez. 2017).
- CDC, Centers for Disease Control and Prevention, Waterborne, and Environmental Diseases. Campylobacter, 3 jun. 2014. Disponível em: http://www.cdc.gov/foodsafety/diseases/campylobacter/index.html. (Acesso em: 4 fev. 2016).
- WHO, World Health Organization. Campylobacter. outubro 2011. Disponível em: http://www.who.int/mediacentre/ factsheets/fs255/en (Acesso em: 16 fev. 2016).
- Fox JG. Campylobacteriosis – a “new” disease in laboratory animals. Laboratory Animal Science. 1982;32(6):625-37.
- Wassenaar TM. Toxin Production by Campylobacter spp. Clin Microbiol Rev. 1997;10(3):466-76.
- Russell RG, Blaser MJ, Sarmiento JI, Fox J. Experimental Campylobacter jejuni Infection in Macaca nemestrina. Infect Immun. 1989;57(5):1438-44.
- Cysne LB. Análise comparativa do perfil clínico, hematológico e microbiota intestinal associados com quadros diarreicos e não diarreicos de macacos cynomolgus (Macaca fascicularis) cativos. Dissertação (Mestrado em Pesquisa Clínica em Doenças Infecciosas) – Instituto de Pesquisa Clínica Evandro Chagas; 2007.
- Clemmons EA, Jean SM, Machiah DK, Breding E, Sharma P. Extraintestinal campylobacteriosis in rhesus macaques (Macaca mulatta). Comp. Med. 2014;64(6):496-500.
- Paul-murphy J. Bacterial enterocolitis in nonhuman primates. Zoo and Wild Animal Medicine: current therapy, 1993.3(2):344-51.
- Sestak K, Merritt CK, Borda J, Saylor E, Schwamberger SR, Cogswell F, et al. Infectious agent and immune response characteristics of chronic enterocolitis in captive rhesus macaques. Infect Immun. 2003;71(7):4079-86.
- Pielsticker C, Glünder G, Rautenschlein S. Colonization properties of Campylobacter jejuni in chickens. Eur J Microbiol Immunol (Bp). 2012;2(1):61-5.
- Dassanayake RP, Zhou Y, Hinkley S, Stryker CJ, Plauche G, Borda JT, et al. Characterization of cytolethal distending toxin of campylobacter species isolated from captive macaque monkeys. J Clin Microbiol. 2005;43 (2):641-9.
- Baze WB, Bernacky BJ. Campylobacter-induced fetal death in a rhesus monkey. Vet Pathol. 2002;39(5):605-7.
- Kalashnikova VA, Dzhikidze EK, Stasilevich ZK, Chikobava MG. Detection of Campylobacter jejuni in healthy monkeys and monkeys with enteric infections by PCR. Bull Exp Biol Med. 2002;134(3):299-300.
- Andrade MCR. Principais doenças de primatas não humanos. In: Andrade A. Animais de laboratório: criação e experimentação. Rio de Janeiro: Fiocruz, 2002. p.155-65.
- Saisse AO, Borges CCA, Lopes CAA, Cysne LB, Frisso MAA, Lisboa AO, et al. Controle sanitário. In: Andrade A, Andrade MCR, Marinho AM, Ferreira Filho J. Biologia, manejo e medicina de primatas não humanos na pesquisa biomédica. Rio de Janeiro: Fiocruz, 2010. p.259-313.
- Sasseville VG, Diters RW. Impact of infections and normal flora in nonhuman primates on drug development. ILAR journal. 2008;49(2):179-90.
- Brasil, 2011. Ministério da Saúde. Manual Técnico de Diagnóstico Laboratorial de Campylobacter. Disponível em: http://u.saude.gov.br/images/pdf/2015/janeiro/09/manual-tecnico-diagnostico-laboratorial-Campylobacter.pdf. (Acesso em: 23 set. 2016).
- Gandra EA, Gandra TKV, Mello WS, Godoi HS. Técnicas moleculares aplicadas à microbiologia de alimentos. Maringá Acta Science Technology. 2008;30(1):109-18.
- Oyarzabal AO, Battie C. Immunological Methods for the Detection of Campylobacter spp. – Current Applications and Potential Use in Biosensors. In: Abuelzein E. In: Immunolabelled and Related Techniques. InTech, 2012. Trends in Immunolabelled and Related Techniques Disponível em: https://www.intechopen.com/books/trends-in-immunolabelled-and-related-techniques/immunological-methods-for-the-rapid-detection-of-campylobacter-spp-current-applications-and-potent (Acesso em 24 Jul. 2016).
- Bessède E, Delcamp A, Sifré E, Buissonnière A, Mégraud F. New methods for detection of campylobacters in stool samples in comparison to culture. J Clin Microbiol. 2011;49(3):941-4.
- Andrade MC, Gabeira SC, Abreu-Lopes D, Esteves WT, Vilardo Mde C, Thomé JD, et al. Circulation of Campylobacter spp. in rhesus monkeys (Macaca mulatta) held in captivity: a longitudinal study. Mem Inst Oswaldo Cruz. 2007;102(1):53-7.
- Gonçalves MAB, Silva SLS, Tavares MCH, Grosmann NV, Cipreste CF, Castro PHG. Comportamento e bem estar animal. In: Andrade A, Andrade MCR, Marinho AM, Ferreira Filho J. Biologia, manejo e medicina de primatas não humanos na pesquisa biomédica. Rio de Janeiro: Fiocruz; 2010.p.207-57.
- Cruz PB, Santos FN, Esteves WTC, Abrantes JA, Cysne LB, Pinto ACA, et al. Pesquisa de microbiota normal e de bactérias potencialmente patogênicas em material fecal de primatas não humanos da espécie Macaca fascicularis de cativeiro. Revista da Sociedade Brasileira de Ciência em Animais de Laboratório. 2016; 4(2):147-48.
- Carrapiço F, Rita O. Simbiogénese e Evolução. In: Evolução. Conceitos e Debates, Levy A, Carrapiço, F, Abreu H, Pina M. (eds). Esfera do Caos, Lisboa. 2009. p.175-98.
Correspondência
Joseli Maria da Rocha Nogueira
Fundação Oswaldo Cruz – Fiocruz
Av. Brasil 4365 – Manguinhos
Rio de Janeiro-RJ, Brasil
