Falso negativo em colpocitologia: Estudo transversal retrospectivo no monitoramento da qualidade do Instituto Nacional de Câncer – INCA/RJ
False-negative in colpocytology: retrospective cross-sectional study in monitoring the quality of the Instituto Nacional de Câncer – INCA/RJ
Shirley Borges de Souza Quintana1, Glória Regina Ferreira da Silva1, Ana Celina Palmieri Parente Moreira1, Marcel de Souza Borges Quintana2, Simone Maia Evaristo1, Mario Lucio Cordeiro Araujo-Junior1
1 Instituto Nacional de Câncer – INCA, Setor Integrado de Tecnologia em Citopatologia – SITEC. Rio de Janeiro, RJ – Brasil.
2 Fundação Oswaldo Cruz – FIOCRUZ, Instituto Nacional de Infectologia Evandro Chagas – INI. Rio de Janeiro, RJ – Brasil.
Recebido em 24/11/2023
Aprovado em 08/04/2024
DOI: 10.21877/2448-3877.202400156
INTRODUÇÃO
Sem considerar os tumores de pele não melanoma, o câncer de colo do útero ocupa a sexta posição entre os tipos mais frequentes de câncer. Nas mulheres, é o terceiro câncer mais incidente, sendo considerado um importante problema mundial de saúde pública (INCA, 2022).(1) Segundo o plano de ação para redução da incidência e mortalidade por câncer do colo do útero junto ao Programa Nacional de Controle do Câncer de Colo do Útero – PNCCU, o rastreamento populacional é realizado através do exame de Papanicolaou ou colpocitológico, mundialmente conhecido e útil para detectar células pré-cancerosas e cancerosas no colo do útero (Freitas, 2023).(2) Esse exame é recomendado prioritariamente para mulheres de 25 a 64 anos com periodicidade de três anos, após dois exames consecutivos normais, no intervalo de um ano. Para mulheres com mais de 64 anos de idade e que nunca se submeteram ao exame citopatológico, deve-se realizar dois exames com intervalo de um a três anos. Se ambos os exames forem negativos, essas mulheres podem ser dispensadas de exames adicionais (INCA, 2016).(3)
Falsos negativos são os esfregaços classificados como negativos pelo escrutino de rotina realizado pelos citotécnicos, mas que foram considerados como alterados pelo método de revisão do Monitoramento Interno da Qualidade (MIQ) e então reclassificados como células atípicas de significado indeterminado ou alteração mais grave a partir de revisão detalhada (INCA, 2016).(4)
O técnico em citopatologia, conhecido como citotécnico ou citotecnologista, apoia o diagnóstico colpocitológico, extremamente importante no processo da detecção precoce no PNCCU. A principal atribuição do citotécnico é realizar o escrutino no esfregaço citológico (Santos, 2020),(5) e seu êxito vai depender da precisão em diferenciar corretamente os casos atípicos dos normais. Entretanto, a baixa sensibilidade do exame de Papanicolaou tem sido alvo de várias críticas, pois suas taxas podem variar de 6% a 56% de resultados falsos negativos que podem ocorrer nas fases pré-analítica e/ou analítica. Os erros mais comuns da fase pré-analítica são o tempo prolongado entre a coleta e fixação, a não representatividade da junção escamo-colunar (JEC), a sobreposição celular e a hipocelularidade no esfregaço. Já na fase analítica pode-se apontar as principais causas no erro do escrutino ou de interpretação. Quanto ao erro de escrutino, encontramos a não identificação e reconhecimento de células neoplásicas representadas no esfregaço, seja por falta de atenção e concentração, tempo insuficiente para análise do esfregaço, fadiga mental ou pouca experiência do profissional. O erro de interpretação se dá quando as células neoplásicas são reconhecidas, porém são interpretadas como benignas ou subavaliadas e classificadas erroneamente, seja pela inexperiência do citotecnologista ou por informações clínicas inadequadas (Costa et al., 2021 e Paula, 2017).(6,7)
Macios (2023)(8) apresenta, em estudo no Programa Polonês de Rastreio do Câncer Cervical, a má interpretação como o principal motivo de FN na fase analítica, indicativo da necessidade de mais treinamento de pessoal para aumentar a qualidade da triagem.
São quatro os métodos de revisão para monitorar a qualidade do esfregaço cervical que corroboram para minimizar os achados dos índices de FN: Revisão aleatória de 10% dos esfregaços negativos (R-10%); Revisão dos esfregaços selecionados com base em critérios clínicos de risco (RCCR); Revisão rápida de 100% dos esfregaços negativos (RR-100%) e Pré-escrutínio rápido de todos os esfregaços (PER). A escolha do método de MIQ fica a critério do laboratório e pode se basear na avaliação do volume de exames e do quantitativo de profissionais, para não exceder a carga de trabalho (INCA, 2016).(4)
O MIQ é um sistema de controle interno da qualidade dos exames realizados, estabelecendo critérios de avaliação, com registro dos resultados encontrados, permitindo identificação de não conformidades, com implementação de ações corretivas e preventivas. Além disso, promove a educação continuada, fortalecimento da uniformização dos critérios citomorfológicos para reduzir os achados falsos negativos e falsos positivos (Etlinger et al., 2012).(9)
O objetivo deste artigo foi analisar o indicador falso negativo do período de 2008 a 2018 encontrado pelo MIQ do Setor Integrado de Tecnologia em Citopatologia – SITEC do Instituto Nacional de Câncer – INCA.
METODOLOGIA
Este estudo, transversal retrospectivo, consiste na análise do indicador falso negativo da fase pós-analítica (análise estatística dos resultados dos exames colpocitológicos) do MIQ/SITEC/INCA, conforme proposto na Portaria nº 3388/2013, QualiCito – Qualificação Nacional em Citopatologia na prevenção do câncer de colo do útero no âmbito da Rede de Atenção à Saúde das Pessoas com Doenças Crônicas(10) e no Manual de Gestão da Qualidade para Laboratórios de Citopatologia.(4)
Os dados primários deste estudo foram coletados a partir do registro dos resultados de exames de revisão dos laudos colpocitológicos do SITEC/INCA, laboratório Tipo I e Tipo II, instituição de referência em citopatologia oncológica que presta serviço para os municípios do estado do Rio de Janeiro. Tais dados foram armazenados em planilhas de Excel ao longo de todo o período do estudo, compreendendo os anos de 2008 a 2018.
Os critérios estabelecidos para definir como resultado falso negativo consistiu na falha da interpretação de células atípicas que apresentaram critérios citomorfológicos para lesão intraepitelial escamosa de baixo grau (LSIL) ou alto grau (HSIL) ou alterações que sugerem LSIL, mas que foram insuficientes para uma interpretação definitiva como tal (ASC-US), ou alterações citológicas sugestivas de HSIL, mas insuficientes para uma interpretação definitiva (ASC-H) ou ainda células com critérios para carcinoma invasivo, que foram interpretadas como benignas. Tais resultados são decorrentes de fadiga, cansaço ou subavaliação por inexperiência do profissional Citotécnico, responsável pelo escrutino.
No SITEC/INCA a primeira leitura dos exames colpocitológicos é realizada pelos citotécnicos. A revisão de, no mínimo, 10% aleatórios dos casos classificados como negativos e todos os casos com informações clínicas de risco é feita pelos profissionais que compõem a equipe de MIQ (citotécnicos experientes e/ou profissionais de nível superior habilitado) que possuem experiência superior a dez anos nessa profissão. Cem por cento dos casos positivos ou suspeitos são encaminhados à equipe de médicos citopatologistas para o diagnóstico final.
O método de confecção do esfregaço foi o convencional, e toda a leitura das lâminas foram realizadas alternando-se o sentido vertical com o horizontal, lembrando uma “barra grega”, em microscopia óptica de luz comum, com objetivas de 10x e 40x.
Os diagnósticos foram classificados como a seguir: a) Dentro dos limites da normalidade no material examinado; b) Alterações celulares benignas reativas ou reparativas; c) Atipias celulares de significado indeterminado em células escamosas (ASC) – possivelmente não neoplásicas (ASC-US) ou não se pode afastar lesão de alto grau (ASC-H); d) Lesão intraepitelial de baixo grau (LSIL); e) Lesão intraepitelial de alto grau (HSIL) ou não podendo excluir microinvasão (HSIL-M); f) Carcinoma escamoso invasor; g) Atipias de significado indeterminado em células glandulares (AGC) – possivelmente não neoplásicas (AGC-SOE) ou não se pode afastar lesão de alto grau (AGC-NEO); h) Adenocarcinoma in situ (AIS); i) Adenocarcinoma invasor (cervical, endometrial ou sem outras especificações); j) Células de origem indefinida – possivelmente não neoplásicas (AOI) ou não se pode afastar lesão de alto grau (AOI-H); k) Outras neoplasias malignas (INCA, 2016).(4)
As frequências absolutas e relativas (proporções) dos falsos negativos foram apresentadas e também os respectivos intervalos de confiança de 95%. Todos os dados obtidos para análise foram organizados e analisados utilizando-se os programas Microsoft Excel 2010 e R versão 4.3.2.(11)
ÉTICA
O estudo foi aprovado pelo Comitê de Ética em Pesquisa – (CEP) do INCA, CAAE 32632314.6.0000.5274.
RESULTADOS
Dos 1.812.492 (um milhão, oitocentos e doze mil, quatrocentos e noventa e dois) exames colpocitológicos satisfatórios realizados no período de 2008 a 2018 no SITEC/INCA, foram revisados 12%, ou seja, 196.803 (cento e noventa e seis mil e oitocentos e três) exames pelo MIQ através dos métodos de Revisão aleatória de 10% e Revisão dos esfregaços selecionados com base em critérios clínicos de risco. Foi encontrado o total de 2.811 (dois mil, oitocentos e onze) exames falsos negativos, conforme mostra a Tabela 1.
Tabela 1
Totais de Exames Lidos, Revisados e Falsos negativos.
| ANO | Exames Lidos | Negativos Revisados MIQ | FN | |
| N | % | |||
| 2008 | 226.614 | 13.690 | 149 | 1,1 |
| 2009 | 238.583 | 14.067 | 210 | 1,5 |
| 2010 | 218.899 | 16.672 | 277 | 1,7 |
| 2011 | 220.399 | 25.882 | 378 | 1,5 |
| 2012 | 219.723 | 25.802 | 321 | 1,2 |
| 2013 | 119.638 | 16.770 | 283 | 1,7 |
| 2014 | 120.673 | 20.349 | 331 | 1,6 |
| 2015 | 113.419 | 19.349 | 154 | 0,8 |
| 2016 | 111.584 | 16.563 | 262 | 1,6 |
| 2017 | 104.312 | 12.215 | 105 | 0,9 |
| 2018 | 118.648 | 15.444 | 341 | 2,2 |
| Total | 1.812.492 | 196.803 | 2.811 | 1,4 |
A proporção de falsos negativos encontrados em cada ano correspondeu a 1,1% (n=149) no ano de 2008; 1,5% (n=210) em 2009; 1,7% (n=277) em 2010; 1,5% (n=378) em 2011; 1,2% (=321) em 2012; 1,7% (n=283) em 2013; 1,6% (n=331) em 2014; 0,8% (n=154) em 2015; 1,6% (n=262) em 2016; 0,9% (n=105) em 2017 e 2,2% (n=341) em 2018. A proporção no período foi de 1,4% (IC95%: 1,38% – 1,48%). O Gráfico 1 apresenta tais resultados.
Para o total de exames identificados como falsos negativos pelo MIQ/SITEC/INCA (n=2.811), os diagnósticos de ASC-US corresponderam a 47,4% (n=1.332 casos), ASC-H corresponderam a 5,9% (n=167), AGC-SOE a 3,8% (n=108), AGC-NEO a 0,6% (n=16), LSIL a 38,2% (n=1074), HSIL a 3,7% (n=103) e neoplasia maligna invasora (carcinoma escamoso invasor, adenocarcinoma invasor – cervical, endometrial ou sem outras especificações – e outras neoplasias malignas) a 0,4% (n=11). A Tabela 2 apresenta os resultados total absoluto e relativo por período (n(%)) para cada categoria diagnóstica dos exames falsos negativos encontrados de 2008 a 2018. O Gráfico 2 mostra o percentual por categoria diagnóstica.
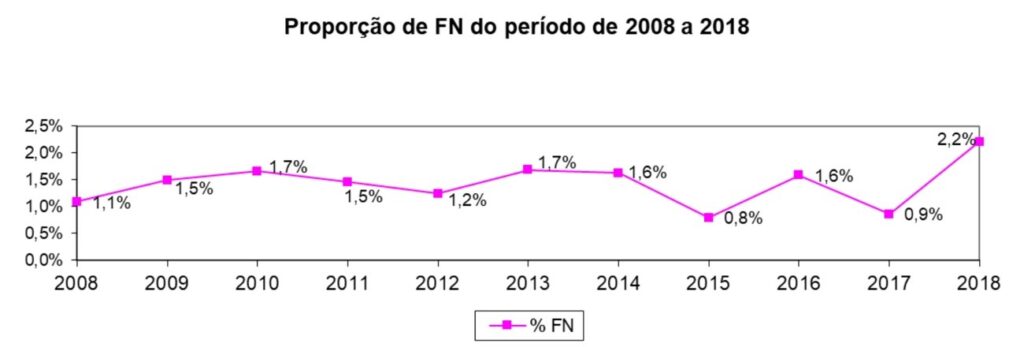
Gráfico 1
Proporção de falsos negativos do SITEC/INCA no período de 2008 a 2018.
Tabela 2
Total absoluto e relativo por período (n(%)) para cada categoria diagnóstica dos exames falsos negativos encontrados no período de 2008 a 2018.
| ANO | ASC-US | ASC-H | AGC-SOE | AGC-NEO | LSIL | HSIL | NEOPLASIA MALIGNA INVASORA | n (%) |
| 2008 | 75 (50,34) | 9 (6,04) | 8 (5,37) | 0 (0,00) | 53 (35,57) | 4 (2,68) | 0 (0,0) | 149 (100) |
| 2009 | 96 (45,71) | 3 (1,43) | 19 (9,05) | 5 (2,38) | 73 (34,76) | 13 (6,19) | 1 (0,48) | 210 (100) |
| 2010 | 110 (39,71) | 11 (3,97) | 28 (10,11) | 1 (0,36) | 119 (42,96) | 8 (2,89) | 0 (0,00) | 277 (100) |
| 2011 | 144 (38,10) | 34 (8,99) | 13 (3,44) | 0 (0,00) | 161 (42,59) | 22 (5,82) | 4 (1,06) | 378 (100) |
| 2012 | 137 (42,68) | 17 (5,30) | 9 (2,80) | 5 (1,56) | 145 (45,17) | 6 (1,87) | 2 (0,62) | 321 (100) |
| 2013 | 118 (41,70) | 18 (6,36) | 3 (1,06) | 1 (0,35) | 135 (47,70) | 8 (2,83) | 0 (0,00) | 283 (100) |
| 2014 | 175 (52,87) | 25 (7,55) | 4 (1,21) | 0 (0,00) | 115 (34,74) | 11 (3,32) | 1 (0,30) | 331 (100) |
| 2015 | 77 (50,00) | 7 (4,55) | 7 (4,55) | 1 (0,65) | 54 (35,06) | 7 (4,55) | 1 (0,65) | 154 (100) |
| 2016 | 168 (64,12) | 10 (3,82) | 3 (1,15) | 0 (0,00) | 78 (29,77) | 3 (1,15) | 0 (0,00) | 262 (100) |
| 2017 | 67 (63,81) | 4 (3,81) | 4 (3,81) | 0 (0.00) | 25 (23,81) | 5 (4,76) | 0 (0,00) | 105 (100) |
| 2018 | 165 (48,39) | 29 (8,50) | 10 (2,93) | 3 (0,88) | 116 (34,02) | 16 (4,69) | 2 (0,59) | 341 (100) |
| Total | 1.332 (47,4) | 167 (5,9) | 108 (3,8) | 16 (0,6) | 1.074 (38,2) | 103 (3,7) | 11 (0,4) | 2.811 (100) |
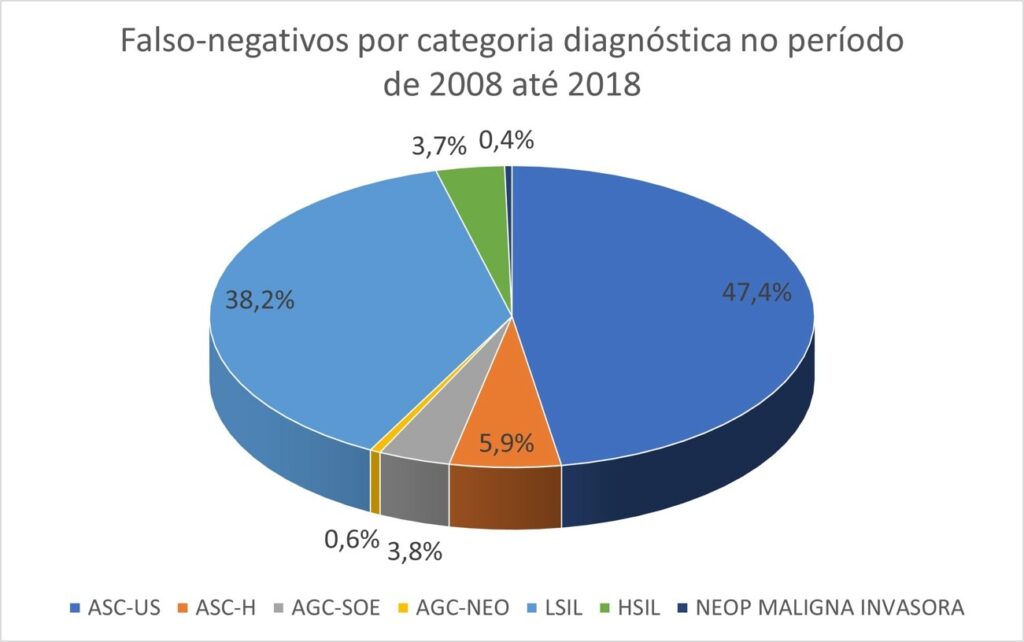
Gráfico 2
Falsos negativos por categoria diagnóstica no período de 2008 a 2018.
DISCUSSÃO
Entre janeiro de 2008 e dezembro de 2018, a proporção de falsos negativos do MIQ/SITEC/INCA foi de 1,4% (IC95%: 1,38% – 1,48%) apresentando uma variação de 0,8% a 2,2%. Tal resultado representou uma proporção aceitável, considerando os valores mencionados no Manual de Gestão da Qualidade, onde os falsos negativos podem variar de 2% a 13% (INCA, 2016).(4)
Machado (2018)(12) afirma que o método mais utilizado no escrutino de rotina é o R-10%, conceituado como releitura dos esfregaços que foram classificados como negativos no escrutino de rotina, embora este método tenha sido considerado ineficaz por alguns autores. Entretanto, Araújo Jr. et al. (2015)(13) afirmam que a análise dos resultados sobre o método R-10% é adequada, especialmente para laboratórios com grande número de exames, e eficaz para identificar pontos que precisam ser trabalhados em educação continuada, a fim de se obter índices seguros que atendam às normativas estabelecidas pela QualiCito e pelas referências na literatura nacional e internacional.
O método RCCR consiste em revisar os esfregaços classificados como negativos no escrutínio de rotina que tenham indicações clínicas relevantes que podem estar associadas a maior risco para neoplasias intraepiteliais ou carcinoma invasivo de colo do útero (INCA, 2016).(4)
O Manual de Gestão da Qualidade (INCA, 2016)(4) cita estudo que mostrou que a R-10% obteve uma taxa de resultado falso negativo de 3%, ao passo que a RCCR obteve taxa de 5,9%.
Em nosso estudo foi observado que as categorias ASC (ASC-US + ASC-H) e LSIL foram as mais prevalentes, 53,3% e 38,2% respectivamente. Comparando com estudo conduzido pela Sociedade Tailandesa de Citologia envolvendo 124 laboratórios em 76 províncias durante 2010-2014, utilizando o método de revisão aleatória de 10% (R-10%), a taxa de resultados anormais foi de 0,63% e também representados por ASC-US (54%) e L-SIL (21%). A taxa média de falsos negativos, medida no nível de L-SIL e superior, foi de 13,8% (Koonmee, 2017).(14)
Segundo Kattoor (2022),(15) a literatura mostra que a categoria limítrofe de células escamosas atípicas (ASC) pode ser usada quando as características morfológicas definidoras são qualitativa ou quantitativamente insuficientes para o diagnóstico de LSIL e HSIL ou lesão mais grave. A classificação binária dessa categoria de significado indeterminado foi mantida no Sistema Bethesda(16) e inclui: ASC-US, quando a atipia é vista em células maduras, e ASC-H, que não pode descartar lesão de alto grau, quando alterações são vistas em células imaturas.
A categoria ASC é a mais prevalente de todas as interpretações anormais de citologia cervical: as ASC-US estão presentes em mais de 90% das interpretações de ASC na maioria dos laboratórios e as ASC-H, menos de 10% (Nayar, 2018).(16)
Esta categoria gera dúvidas, sendo a principal delas as aplicações subjetivas e inconsistentes e a baixa reprodutibilidade interobservador e intraobservador. No entanto, estudos têm mostrado que se eliminarmos ASC-US, a taxa de LSIL aumentará; se o ASC-H for eliminado, as possibilidades de detectar lesões verdadeiras são reduzidas. Portanto, há fortes razões para manter a categoria ASC (Kattoor 2022).(15)
A lesão intraepitelial escamosa de baixo grau (LSIL) se traduz em alterações de células escamosas associadas à infecção por HPV e apresenta critérios bem definidos, em que as células podem estar isoladas ou em aglomerados ou grupos. As alterações são geralmente confinadas a células escamosas maduras (intermediárias ou superficiais), onde o aumento nuclear ocupa mais de três vezes a área de núcleos normais e uma relação núcleo-citoplasmática baixa. Os núcleos são geralmente hipercromáticos, com variação do tamanho e contorno das membranas nucleares variáveis. Binucleação e multinucleação são comuns. Nucléolos geralmente estão ausentes ou não visíveis. Cavitação perinuclear ou coilocitose é ampla e bem definida, mas não é necessária para interpretação de LSIL (Nayar, 2018).(16).
Em nosso estudo esta categoria foi a segunda mais presente (LSIL = 38,2%), e foram verificados, em revisão sistemática entre os profissionais do monitoramento da qualidade do SITEC/INCA, os fatores que poderiam corroborar para presença deste índice (em fase de elaboração). Foram encontrados esfregaços parcialmente dessecados, esfregaços purulentos, hemorrágicos, sobreposição celular, citolítico, ceratinização e hipocelularidade das células atípicas que comprometeram a qualidade dos exames na fase analítica.
De acordo com diversos autores, são vários os fatores que comprometem a qualidade do exame citopatológico e ocasionam altos índices de resultados falsos negativos, como citados por Lin et al. (2022),(17) em pesquisa retrospectiva do Departamento de Patologia e Medicina Genômica do Hospital Metodista em Houston, EUA, destacando três categorias que podem resultar em diagnósticos falsos negativos: variância de amostragem (células neoplásicas não presentes na preparação citológica), variância de triagem (células neoplásicas não reconhecidas usando triagem automatizada ou manual pelo citotécnico) e variância diagnóstica ou interpretativa (células neoplásicas classificadas erroneamente).
O percentual do indicador HSIL encontrado na releitura pelo MIQ correspondeu a 0,05%. Quando comparado com a média percentual geral do SITEC/INCA do mesmo período, que foi 0,5%, podemos perceber que, apesar dos achados de HSIL na releitura pelo monitoramento da qualidade, tal expressão representa que as lesões pré-malignas de alto grau têm sido identificadas corretamente no momento do escrutino. Tal indicador deve estar acima de 0,4%, valor baseado em resultados obtidos em países com programas de triagem bem-sucedidos, capazes de reduzir a incidência e mortalidade por câncer de colo do útero (Tobias et al., 2016).(18) A identificação correta desse tipo de alteração, em conjunto com a confirmação diagnóstica, o tratamento e o seguimento adequado, pode evitar a evolução para o câncer (Bortolon et al., 2012).(19)
Fazendo um breve histórico de como funciona a detecção dos falsos negativos em diversos países, citamos a seguir alguns exemplos. A Sociedade Tailandesa de Citologia, que em pesquisa nacional por um período de 5 anos de revisão dos exames colpocitológicos a taxa média de falsos negativos foi de 13,8% (Koonmee, 2017).(14) Na Coreia, em estudo transversal incluindo 33.531 mulheres que se submeteram ao rastreamento de rotina do câncer de colo do útero foi encontrada taxa de falsos negativos de 46,9% (Song, 2020).(20) Na Polônia, Macios (2023),(21) em auditoria de lâminas FN coletadas entre 2010-2013 no Programa de Rastreio do Câncer Cervical entre os testes de triagem, identificou 2,1% por 10.000 triagens NLIM (negativo para lesão intraepitelial ou malignidade) e 1,6% em todas as triagens. Segundo o England audit report (2022),(22) do Reino Unido, no Programa de Triagem Cervical, 41,9% dos exames retrospectivos de mulheres diagnosticadas com câncer cervical com idade entre 25 e 49 anos foram atualizados para citologia limítrofe ou mais grave após revisão não cega e 45,9% entre as mulheres da faixa etária entre 50 e 64 anos.
Em revisão retrospectiva de esfregaços cinco anos anteriores a um esfregaço mostrando lesões intraepiteliais escamosas de alto grau ou carcinoma cervical, diversos autores apresentaram o diagnóstico de FN em mais de 50% das lâminas revisadas. São eles: DeMay apresentou 51,9%; Kenter et al.: 53,3%; Bulk et al.: 61,1%; Komerska et al.: 54,2% (Apud Macios, 2022);(23) Cardoso Filho (2018)(24) identificou 4,97% e Ma et al. (2020)(25) identificaram 31,7% em exames de pacientes do Departamento de Obstetrícia e Ginecologia do Primeiro Hospital da Universidade de Pequim, China.
Estudos de pesquisa cuidadosos demonstraram que a triagem retrospectiva pode identificar anormalidades em lâminas diagnosticadas como negativas em mais de 50% dos casos analisados. Pesquisas de programas entre laboratórios de hospitais universitários baseados nos EUA mostram a detecção de anormalidades em porcentagens significativamente mais baixas, geralmente na faixa de 10% a 30%. A maioria dos casos identificados é reclassificada na categoria de células escamosas atípicas de significado indeterminado, semelhante ao nosso estudo. Os casos de lesão intraepitelial escamosa de alto grau identificada são identificados como uma minoria de casos em praticamente todos os laboratórios pesquisados. Nos casos reavaliados como lesão intraepitelial escamosa de alto grau, um padrão citológico comum é o de algumas células displásicas isoladas, pequenas, “metaplásicas imaturas” (Wilbur, Apud Koonmee, 2017).(14)
Comparando a proporção de FN desses estudos citados, podemos observar uma discrepância entre os índices apresentados (4,97% a 61,1%), conduzindo nosso pensamento ao indicador índice de positividade (IP) do laboratório. Tal indicador expressa a prevalência de alterações celulares nos testes de citopatologia e a sensibilidade do programa de rastreamento para detectar lesões na população examinada (Tobias et al., 2016).(18) O IP baixo pode apontar a presença de exames falsos negativos, entretanto, quando o IP está dentro do desejável, ou seja, entre 3% e 10% pode significar que a proporção de FN também se encontra dentro do parâmetro esperado. Em países onde o rastreamento foi bem-sucedido na redução das taxas de incidência e mortalidade por câncer de colo do útero, como Estados Unidos e Reino Unido, o percentual de positividade foi de 6,8% e 6,4%, respectivamente (Almeida, 2019).(26) Os índices do SITEC/INCA, tanto da média de IP (2013 a 2018), que foi 6,3%, como da proporção de FN, que foi igual a 1,4% (2008 a 2018), estão dentro do padrão esperado.
Agregando informações sobre a proporção de FN, referentes aos exames colpocitológicos, o Monitoramento Externo da Qualidade – MEQ do SITEC/INCA, uma estratégia proposta pelo Ministério da Saúde a fim de monitorar a qualidade do trabalho de laboratórios públicos ou privados que prestam serviço ao Sistema Único de Saúde, ao revisar cerca de 24.520 exames encontrou a proporção de 2,5% de resultados falsos negativos, em laboratório do estado do Rio de Janeiro no período de 2013 a 2019 (em fase de elaboração). Rocha (2018)(27) apresenta no MEQ as proporções de 1,83% e 1,50% de resultados falsos negativos em dois laboratórios também no estado do Rio de Janeiro.
Como medidas para redução dos números de falsos negativos em colpocitologia, no Brasil tem-se investido na qualidade do exame citopatológico através de Portarias, por exemplo a nº 3388/2013 (QualiCito),(10) como também através da implementação do Manual de Gestão da Qualidade para Laboratório de Citopatologia (INCA, 2016),(4) no qual se referencia sobre o aprimoramento dos MIQ e MEQ em Citopatologia, fornecendo medidas para detectar, corrigir e reduzir erros ocasionados nas fases pré-analítica, analítica e pós-analítica, evitando, assim, os resultados falsos negativos.
Costa (2021)(28) acrescenta como fator importante a capacitação contínua dos profissionais atuantes na área da saúde, seja na coleta, no preparo da lâmina, na coloração ou na análise microscópica, com maior acurácia e critérios rigorosos na identificação morfológica das células dos exames citopatológicos como também o aumento na detecção das lesões intraepiteliais escamosas de alto grau (HSIL); dá ênfase à otimização na qualidade da digitação e transporte do laudo; à melhoria dos indicadores da qualidade para os laboratórios de citopatologia, por exemplo o índice de positividade. Tudo isso pode refletir diretamente na boa qualidade e confiabilidade dos exames, tendo ênfase, aqui, o exame colpocitológico.
Diversos países têm implantado o rastreio combinado de DNA-HPV e citologia, apresentando vantagens que podem corroborar para a redução de FN, como: aumento significativo na detecção de lesões pré-cancerosas de colo do útero em um curto período de rastreamento com teste de HPV; maior positividade em mulheres abaixo de 30 anos; alta taxa de encaminhamento para colposcopia; mais detecção de HSIL e de câncer cervical em estágio inicial. Na Argentina, num estudo com cerca de 49.000 testes realizados de 2012 a 2014, os pesquisadores descreveram uma taxa de adesão à colposcopia de 74,6%. Estudo recente no Reino Unido avaliou o desempenho do rastreio com testes de HPV em mulheres não vacinadas, com relato de 26,9% de testes positivos e 10,4% de encaminhamentos diretos para colposcopia na faixa etária entre 24 e 29 anos (Teixeira, 2023).(29)
O Sistema Único de Saúde brasileiro (SUS) lançou um projeto piloto em Recife, capital do estado de Pernambuco, com a inclusão dessa nova estratégia. Entretanto, essa realidade precisará ser debatida e pactuada para que possa ser expandida para todo o país (BRASIL, 2023).(30) Vale lembrar que com essa nova estratégia pode-se considerar que o número de casos de FN provavelmente diminuirá, no entanto não atingirá um zero absoluto (Macios, 2023).(21) Segundo o England audit report (2022),(22) nenhum teste de triagem é perfeito e resultados de triagem falsos negativos poderão ocorrer mesmo quando a equipe estiver devidamente treinada, operando com a mais alta qualidade e atendendo a todos os padrões do programa de triagem.
Contudo, é fundamental investir no monitoramento da qualidade dos exames colpocitológicos, estabelecer critérios de avaliação com registro dos resultados encontrados, permitir a identificação de não conformidades e realizar a implementação de ações corretivas e preventivas através da educação continuada e fortalecimento da uniformização dos critérios citomorfológicos para redução dos achados falsos negativos.
CONCLUSÃO
Concluímos que os exames falsos negativos estão sobretudo relacionados às categorias indeterminadas (ASC), em especial ao ASC-US, visto a subjetividade dessa categoria diagnóstica. O MIQ trabalha para homogeneizar os critérios e atualizar conceitos através de educação continuada agregada à educação permanente, levando a uma melhora na proporção do FN e, consequentemente, na média do IP, permitindo que tais indicadores se apresentem dentro de um padrão esperado.
REFERÊNCIAS
- Instituto Nacional de Câncer (INCA). Estimativa 2023: incidência de câncer no Brasil / Instituto Nacional de Câncer. – Rio de Janeiro: INCA, 2022.
- Freitas VCA, Soares PRAL, Nicolau AIO, Lima TM e Pinheiro AKB. Citopatológico do colo uterino e adequabilidade da amostra: ensaio clínico randomizado controlado. Acta Paul Enferm. 2023;36:eAPE00972
- Instituto Nacional de Câncer (INCA). Diretrizes Brasileiras para o rastreamento do câncer do colo do útero, 2ª edição revista, ampliada e atualizada, Rio de Janeiro, RJ, 2016.
- Instituto Nacional de Câncer (INCA). Manual de Gestão da Qualidade para Laboratórios de Citopatologia, 2ª edição revista e ampliada. Rio de Janeiro, RJ, INCA, 2016.
- Santos S e Villardi R. Formação de citotécnicos com metodologia híbrida: contribuição para a detecção precoce do câncer do colo do útero no Brasil. Rev. Saúde Digital Tec. Educ., Fortaleza, CE, v. 5, n. 3, p.01-17, ago./dez. 2020. ISSN: 2525-9563.
- Costa COM, Melo CMS, Lima ES, Cunha JCR, Serejo APM e Morais HÁ. Fatores que provocam resultados falso-negativos nos exames de citologia oncótica: uma revisão integrativa. Research, Society and Development, v. 10, n. 10, e361101019079, 2021.
- Paula AC, Souza NG, Prado TC e Ribeiro AA. Indicadores do monitoramento interno da qualidade dos exames citopatológicos do Laboratório Clínico da Pontifícia Universidade Católica de Goiás (PUC-GO). 2017;49(2):200-5.
- Macios A, Komerska K and Nowakowski A. Reasons for truly negative cytology reports preceding the diagnoses of invasive cervical cancer. Results of a false‐negative cytology audit in Polish Cervical Cancer Screening Programme. Cancer Med. 2023 Jun; 12(12): 13800-13810.
- Etlinger D, Pereira SMM, Sakai YI, Yamamoto LSU, Iglezias SD, Basso MC e Loreto CD. Análise das discordâncias diagnósticas dos exames citopatológicos do Programa de Monitoramento Externo da Qualidade no Estado de São Paulo, Brasil, 2000-2010. Revista Brasileira de Cancerologia. 2012;58(3):481-488.
- Portaria nº 3.388, de 30 de dezembro de 2013. Institui a Qualificação Nacional em Citopatologia na prevenção do câncer do colo do útero (QualiCito), no âmbito da Rede de Atenção à Saúde das Pessoas com Doenças Crônicas. Diário Oficial [da República Federativa do Brasil]. Brasília (DF); 2013 December 13.
- R Core Team (2023). _R: A Language and Environment for Statistical Computing_. R Foundation for Statistical Computing, Vienna, Austria. <https://www.R-project.org/>.
- Machado EP, Alves MBM, Irie MMT, Zrzebiela FF, Reche PM e Borato DCK. Controle interno da qualidade em citopatologia: o dilema da subjetividade. RBAC. 2018;50(3):244-9
- Araújo MLC Jr, Santana DA, Almeida LB, Quintana SBS, Silva GRF and Fonseca RCSP. Quality in cytopathology: an analysis of the internal quality monitoring indicators of the Instituto Nacional de Câncer. J Bras Patol Med Lab, v. 51, n. 2, p. 102-107, April 2015.
- Koonmee S, Bychkov A, Shuangshoti S, Bhummichitra K, Himakhun W, Karalak, et al. A False-Negative Rate of Papanicolaou Testing: A National Survey from the Thai Society of Cytology. Acta Cytol . 2017;61(6):434-440. doi: 10.1159/000478770. Epub 2017 Jul 25.
- Kattoor J and Kamal MM. The gray zone squamous lesions: ASC-US / ASC-H. 2022; 19:30. Published online 2022Apr30.
- Nayar R, Wilbur DC. Sistema Bethesda para Relato de Citologia Cervical. Definições, Critérios e Notas Explicativas. 3ªed. São Paulo: Livraria Livromed, 2018.
- Lin M, Narkcham S, Jones A, Armylagos D, DiPietro B, Okafor O, et al. False-negative Papanicolaou tests in women with biopsy-proven invasive endocervical adenocarcinoma/adenocarcinoma in situ: a retrospective analysis with assessment of interobserver agrément. J Am Soc Cytopathol. 2022 Jan-Feb;11(1):3-12.
- Tobias AHG, Amaral RG, Diniz EM and Carneiro CM. Quality Indicators of Cervical Cytopathology Tests in the Public Service in Brazil. RBGO Gynecology and Obstetrics Vol. 38 No. 2/2016.
- Bortolon PC, Silva MAF, Corrêa FM, Dias MBK, Knupp VMAO, Assis M e Claro IB – Avaliação da Qualidade dos Laboratórios de Citopatologia do Colo do Útero no Brasil. Revista Brasileira de Cancerologia 2012; 58(3):435-44.
- Song T, Seong SJ, Lee SK, Kim BR, Ju W, Kim KH, et al. Searching for an ideal cervical cancer screening model to reduce false-negative errors in a country with high prevalence of cervical cancer. Journal of Obstetrics and Gynaecology, 40:2,240-246, 2020.
- Macios A, Komerska K and Nowakowski A. Reasons for truly negative cytology reports preceding the diagnoses of invasive cervical cancer. Results of a false‐negative cytology audit in Polish Cervical Cancer Screening Programme. Cancer Med. 2023 Jun; 12(12): 13800-13810.
- Public Health England. Research and analysis: Audit report. Accessed October 10, 2022. https://www.gov.uk/government/publications/cervical-screening-invasive-cervical-cancer-audit-2013-to-2016/audit-report#audit-findings
- Macios A and Nowakowski A. False Negative Results in Cervical Cancer Screening. Risks, Reasons and Implications for Clinical Practice and Public Health. June 2022,12,1508. Disponível em: https://doi.org/10.3390/diagnostics12061508 – https://www.mdpi.com/journal/diagnostics.
- Cardoso Filho LI, Tavares SBN, Siqueira MLB, Passos EN, Araújo NLAS, Martins JMA, et al. Internal quality control indicators in cervical cytopathology of a university laboratory. Cytopathology. 2018 Aug;29(4):355-360. doi: 10.1111/cyt.12571. Epub 2018 Jun 12.
- Ma DY, Dong Y, Feng H, Wang TT, Zhao J. Analysis of factors influencing the false-negative diagnosis of cervical/vaginal liquid based cytology. Zhonghua Bing Li Xue Za Zhi. 2020 Aug 8;49(8):806-811.
- Almeida LMR e Moreira MR. Análise comparativa dos resultados de exames colpocitológicos realizados em Governador Valadares-MG com aqueles realizados no país, região sudeste e Minas Gerais. RBAC. 2019;51(4):306-14.
- Rocha VSO, Malfacini SS, Gomes AM e Rocha CRM. External Quality Monitoring of the Cervical Cytopathological Exams in the Rio de Janeiro City. Rev Bras Ginecol Obstet 2018;40:338-346.
- Costa COM, Melo CMS, Lima ES, Cuha JCR, Serejo APM e Morais HA. Fatores que provocam resultados falso-negativos nos exames de citologia oncótica: uma revisão integrativa. Research, Society and Development, v. 10, n. 10, e361101019079, 2021.
- Teixeira JC, Vale DB, Discacciati MG, Campos CS, Bragança JF e Zeferino LC. Cervical Cancer Screening with DNA-HPV Testing and Precancerous Lesions Detection: A Brazilian Population-based Demonstration Study. Rev Bras Ginecol Obstet 2023;45(1):21-30.
- BRASIL, . Ministério da Saúde lança estratégia nacional para prevenção e eliminação do câncer do colo do útero. Publicado em 22/03/2023. Disponível em: https://shorturl.at/motB7
Correspondência
Shirley Borges de Souza Quintana
E-mail: [email protected]
