Exames laboratoriais para o diagnóstico do diabetes com ênfase nos testes de sobrecarga
Laboratory tests for diabetes diagnosis with an emphasis on glucose load testing
Mauren Isfer Anghebem1,2, Clara Helena Zonatto2, Jaqueline Souza Chaves Taniguchi Leite 2, Victor Melgarejo Marques2, Alceu de Oliveira Toledo Júnior3, Fabiane Gomes de Moraes Rego1,4, Geraldo Picheth4
1 Departamento de Análises Clínicas da Universidade Federal do Paraná/UFPR, Curitiba, PR, Brasil.
2 Escola de Medicina e Ciências da Vida da Pontifícia Universidade Católica do Paraná, Curitiba, PR, Brasil.
3 Departamento de Análises Clínicas e Toxicológicas da Universidade Estadual de Ponta Grossa; Diretor Técnico do Laboratório do Hospital Vicentino, Ponta Grossa, PR, Brasil.
4 Programa de Pós-Graduação em Ciências Farmacêuticas da Universidade Federal do Paraná/UFPR, Curitiba, PR, Brasil.
Recebido em 02/11/2024
Aprovado em 16/11/2024
DOI: 10.21877/2448-3877.202400217.pt
INTRODUÇÃO
Diabetes mellitus é o nome dado a um grupo heterogêneo de distúrbios metabólicos decorrentes da falta e/ou incapacidade da insulina em exercer adequadamente seus efeitos, resultando em hiperglicemia crônica.(1)
O diabetes apresenta um longo período subclínico definido por hiperglicemia e pode permanecer sem diagnóstico, caso não seja realizada uma triagem ou outros mecanismos de identificação precoce. Em todos os tipos de diabetes, o alvo primário para minimizar as consequências da hiperglicemia crônica é o controle glicêmico.(2) Por esta razão, o laboratório de análises clínicas é essencial para o diagnóstico e monitoramento desta condição.
Três exames laboratoriais são utilizados para fins diagnósticos: a glicemia, de jejum (GJ) e ao acaso ou randômica (GR), o teste de tolerância à glicose via oral (TTGO) e a hemoglobina glicada fração A1c (HbA1c).(3)
A determinação da glicemia após 8 horas em jejum informa a concentração glicêmica no momento da coleta, visto que reflete a regulação da glicose no estado pós-absortivo, em que se espera um aumento da razão dos hormônios glucagon/insulina no plasma. A HbA1c reflete a glicemia média dos últimos 2 a 3 meses, avaliando o status glicêmico de longo prazo. E o TTGO reflete o metabolismo da glicose e a resposta da liberação de insulina após uma sobrecarga controlada de glicose.(4) Cada um dos exames apresenta vantagens e desvantagens que devem ser ponderadas.
Esta revisão narrativa, baseada na busca de literatura na base de dados PubMED utilizando os descritores, em inglês e português, “diabetes”, “diabetes mellitus”, “diabetes gestacional”, “diagnóstico do diabetes”, “teste de sobrecarga de glicose”, “TTGO” e “curva glicêmica”, tem como objetivo informar sobre os critérios atuais para o diagnóstico do diabetes, incluindo o diabetes gestacional, e destacar ensaios laboratoriais utilizados no diabetes, com ênfase nos testes de sobrecarga de glicose, destacando suas diferenças, finalidades e limitações.
CRITÉRIOS ATUAIS PARA O DIAGNÓSTICO LABORATORIAL DO DIABETES
Em março de 2024, o posicionamento da Federação Internacional de Diabetes (IDF, International Diabetes Federation) reuniu evidências de que a glicemia determinada 1 hora após a sobrecarga de glicose via oral (TTGO-1h) é mais eficaz na classificação do estado glicêmico quando comparada com dosagens isoladas de GJ ou HbA1c, além de permitir a detecção precoce de pessoas com risco aumentado para progressão para Diabetes mellitus do tipo 2 (DM2), característica também conhecida como pré-diabetes.
Diversos estudos fundamentaram a recomendação da TTGO-1h para o diagnóstico de diabetes e pré-diabetes, por ser um preditor mais sensível de DM2, doença cardiovascular, microangiopatia e mortalidade em comparação com os critérios usados até então,(5-9) com destaque para uma metanálise de 15 estudos totalizando 35.551 participantes representando etnias caucasianas e não caucasianas (46,2%), incluindo ameríndios, japoneses, mexicanos americanos e sul-asiáticos. Este estudo identificou que o valor de corte de TTGO-1h de 209mg/dL apresentou boa sensibilidade e especificidade para detectar o DM2. Ao valor de corte de 209mg/dL (IC 95% 10,6, 12,6) foi associado uma sensibilidade de 0,92 (0,87, 0,95), especificidade de 0,91 (0,88, 0,93), com área sob a curva (AUC) de 0,939 (região de confiança de 95% para sensibilidade, 0,904, 0,946) e um valor preditivo positivo de 45%.(10)
Com base nestas premissas, o posicionamento recomenda o uso de glicemia no TTGO-1h com pontos de corte validados de 155mg/dL (8,6 mmol/L) para hiperglicemia intermediária e ≥209mg/dL (11,6 mmol/L) para caracterizar o DM2. A hiperglicemia intermediária, ou “pré-diabetes”, é um estado que abrange a região entre uma glicemia “normal” e aquela que caracteriza o diabetes, e inclui os quadros de glicemia de jejum alterada e tolerância diminuída à glicose.(11)
Assim, no Brasil, os critérios laboratoriais atuais para o diagnóstico de diabetes e pré-diabetes consideram este novo ponto de corte e são assim definidos: glicemia de jejum acima de ou igual a 126mg/dL, HbA1c maior ou igual a 6,5%, glicemia no TTGO-1h acima de ou igual a 209mg/dL ou glicemia no TTGO-2h acima de ou igual a 200mg/dL. Se somente um exame estiver alterado, este deverá ser repetido para confirmação. Na presença de sintomas típicos de hiperglicemia (poliúria, polidipsia, polifagia, perda de peso rápida ou cetoacidose), é recomendado que o diagnóstico seja estabelecido com a glicemia plasmática obtida ao acaso, quando esta for acima de ou igual a 200mg/dL (Tabela 1).(4)
Tabela 1: Critérios laboratoriais para o diagnóstico de diabetes e pré-diabetes
| Critérios | Normal | Pré-diabetes | Diabetes |
| Glicemia de jejum* | < 100mg/dL | 100-125mg/dL | ≥ 126mg/dL |
| Glicemia ao acaso** | – | – | ≥ 200mg/dL |
| Glicemia de 1 hora no TTGO# | < 155mg/dL | 155-208mg/dL | ≥ 209mg/dL |
| Glicemia de 2 horas no TTGO# | < 140mg/dL | 140-199mg/dL | ≥ 200mg/dL |
| HbA1c | < 5,7 % | 5,7-6,4% | ≥ 6,5 % |
Legenda: TTGO: teste de tolerância à glicose via oral; HbA1c: hemoglobina glicada. * Associada a sintomas clássicos de diabetes. ** Considera-se como jejum a cessação de ingesta calórica de 8 a 12 horas. # Carga oral equivalente a 75g de glicose anidra diluída em água.
Fonte: Adaptado de Rodacki et. al., 2024.(4)
DIAGNÓSTICO LABORATORIAL DO DIABETES GESTACIONAL
O Diabetes mellitus gestacional (DMG) é definido como uma intolerância aos carboidratos a qual se inicia durante a gestação, porém não preenche critérios diagnósticos de DM fora da gestação.(12)
O diagnóstico de DMG também tem evoluído ao longo dos anos para identificar a hiperglicemia detectada pela primeira vez na gestação. Duas categorias podem ser evidenciadas durante a gestação: diabetes manifesto que foi evidenciado apenas na gestação (do inglês, overt diabetes) ou DMG.(12)
Em 1979, o Grupo Nacional de Dados de Diabetes (National Diabetes Data Group – NDDG) recomendou a realização de um teste de desafio com a administração de 50g de glicose e dosagem de glicemia após 1 hora, na primeira consulta pré-natal de mulheres grávidas com fatores de risco, conhecido como teste de O’Sullivan. Este exame tinha por objetivo o diagnóstico de DMG antes de 24 a 28 semanas de gestação, o diabetes gestacional de início precoce. No caso de resultado positivo, seria realizado um TTGO de 3 horas com sobrecarga de 100g de glicose.(13)
Em 2010, a Associação Internacional de Grupos de Estudo sobre Diabetes e Gravidez (International Association of the Diabetes and Pregnancy Study Groups – IADPSG) desenvolveu novos critérios diagnósticos de DMG com base nos resultados do estudo prospectivo Hiperglicemia e Resultado Adverso na Gravidez – HAPO, do inglês Hyperglycemia and Adverse Pregnancy Outcome. O critério da IADPSG propôs usar um valor de GJ de 92 a 126mg/dL durante as primeiras 24 semanas de gestação para definir DMG de início precoce. Este limite é idêntico ao usado após 24 semanas de gravidez.(14)
Em 2011, a Associação Americana de Diabetes (American Diabetes Association – ADA) e, em 2013, a Organização Mundial de Saúde – OMS acataram os critérios do IADPSG para o diagnóstico de DMG.(15) Entretanto, a OMS destacou que, caso a glicemia após sobrecarga seja ≥ 200mg/dL seria definida a presença de DM diagnosticado na gestação (overt diabetes), e não de DMG.(12)
Em 2017, a Sociedade Brasileira de Diabetes (SBD) juntamente com a Federação Brasileira das Associações de Ginecologia e Obstetrícia (FEBRASGO), a Organização Pan-americana de Saúde (OPAS) e o Ministério da Saúde do Brasil definiram uma proposta conjunta de padronização do rastreamento e diagnóstico do DMG no país. Os critérios brasileiros foram adaptados dos critérios da OMS,(16) conforme fluxograma da Figura 1.
Na primeira consulta pré-natal de gestantes sem conhecimento do diagnóstico prévio de DM, é recomendado solicitar GJ com o objetivo de detectar diabetes manifesto (overt diabetes) e DMG precoce. O diagnóstico de DMG deve ser considerado nas gestantes com GJ entre 92mg/dL e 125mg/dL em qualquer momento da gestação. Para todas as gestantes sem diagnóstico prévio de DM, independentemente da presença de fatores de risco, é recomendado que a investigação diagnóstica do DMG seja feita entre a 24ª e 28ª semana de gestação, através da realização de TTGO, com dosagem da glicose plasmática em jejum, 1 e 2 horas após a ingestão de 75g de glicose anidra. No rastreamento do DMG, após a 24a semana, quando o valor da glicemia de 2 horas no TTGO com 75g estiver ≥ 200mg/dL deve ser considerada a presença de DM diagnosticado na gestação (overt diabetes; diabetes manifesto) e não de DMG.(16)
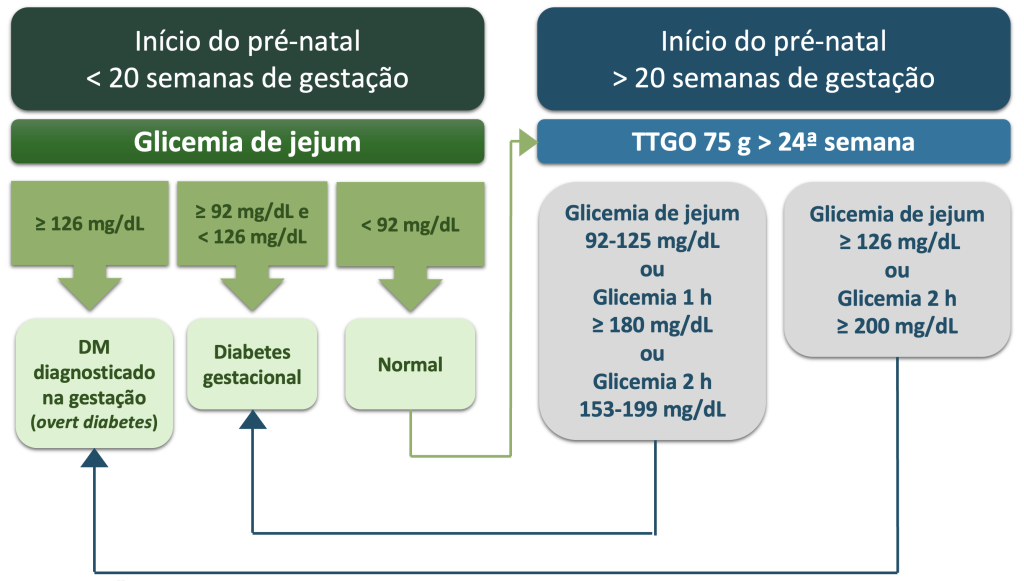
Figura 1
Classificação da hiperglicemia em gestantes sem DM previamente diagnosticado.
Legenda: DM: Diabetes mellitus; TTGO: teste de tolerância à glicose via oral; Fonte: Adaptado de Zajdenverg et al., 2024.(16)
Outras estratégias são recomendadas por entidades internacionais, como é o caso do Colégio Americano de Obstetras e Ginecologistas (American College of Obstetricians and Gynecologists – ACOG), que endossou uma abordagem em duas etapas, conhecido como estratégia de dois passos ou two-step.(17) Ou seja, o diagnóstico do DMG pode ser realizado com qualquer uma das duas estratégias: 1. One-step ou estratégia de um passo: que é o TTGO de 75g derivado dos critérios do IADPSG, já mencionado anteriormente, ou 2. Two-step ou estratégia de dois passos: que é uma abordagem mais antiga de “duas etapas” com uma triagem de 50g, sem jejum, seguida por um TTGO de 100g para aqueles com triagem positiva. Esta estratégia se baseia nos critérios de O’Sullivan e Mahan.(3)
Na estratégia one-step, o TTGO é realizado com 75g de glicose e o diagnóstico de DMG é feito quando qualquer um dos seguintes valores de glicose plasmática é atingido ou excedido: glicose plasmática ³ 92mg/dL, glicose plasmática de 1 hora ³ 180mg/dL, glicose plasmática de 2 horas ³ 153mg/dL. Na estratégia two-step, se a glicose plasmática de 1 hora após a carga com 50g de glicose, sem jejum, realizada entre a 24a e 28 a semanas de gestação em indivíduos sem diagnóstico prévio de diabetes for ³ 130, 135 ou 140mg/dL, é realizado um segundo passo; o TTGO com 100g de glicose, após jejum. Neste caso, o diagnóstico de DMG é feito quando pelo menos dois dos seguintes quatro valores de glicose plasmática (medidos em jejum, 1, 2 e 3 horas durante o TTGO) são atingidos ou excedidos: glicemia plasmática em jejum: 95mg/dL, glicose plasmática de 1 hora ³ 180mg/dL, glicose plasmática de 2 horas: 155mg/dL, glicose plasmática de 3 horas: 140mg/dL.
Uma vez que diferentes critérios diagnósticos identificarão diferentes graus de hiperglicemia materna e risco materno/fetal, existe grande discordância entre especialistas sobre qual é a melhor estratégias para o diagnóstico de DMG.(18-20)
EXAMES LABORATORIAIS NO CONTEXTO DO DIABETES
Cada um dos exames laboratoriais recomendados para o diagnóstico do diabetes tem vantagens e limitações, resumidas na Tabela 2.
Tabela 2: Vantagens e limitações dos exames laboratoriais de rotina para o diabetes
| Ensaio | Vantagem | Limitação |
| GJ | · Quantificação automatizada simples
· Baixo custo · Amostra única · Disponível em todos os locais · Critérios estabelecidos |
· Necessita jejum ≥ 8 horas
· Variabilidade biológica grande · Variação diurna · Amostra não é estável (“glicólise”) · Vários fatores afetam a concentração da glicose (estresse, doença aguda) · A concentração varia com a fonte da amostra (venosa, capilar ou arterial) · Concentração no sangue total diferente do plasma · A GJ tem menor associação com as complicações do DM (comparado à HbA1c) · Reflete a homeostase da glicose em um único momento no tempo |
| TTGO | · Indicador sensível do risco para desenvolver diabetes
· Marcador precoce de comprometimento da homeostase da glicose |
· Baixa reprodutibilidade
· Preparo longo do paciente · Teste demorado e inconveniente para o paciente · Dose oral de glicose pode ser impalatável · Maior custo · Influenciado por vários medicamentos · Sujeito às mesmas limitações da GJ, como amostra não estável · Necessidade de realizar o teste pela manhã |
| HbA1c | · Paciente não necessita de jejum
· Amostra pode ser obtida em qualquer horário do dia · Pequena variação biológica · Amostra estável · Não afetado por fatores agudos como estresse e exercício · Reflete a concentração de glicose em longo período anterior à coleta · Dosagem padronizada (NGSP) · Amostra única de sangue total · A concentração prediz o desenvolvimento de complicações microvasculares do DM · Aplicação na orientação do tratamento. |
· Pode ser alterada por outros fatores além da glicose, como alteração no tempo de vida dos eritrócitos, etnicidade
· A presença de hemoglobinopatias interfere no resultado · Pode não estar disponível em todos os laboratórios · Custo maior |
Legenda: GJ: glicemia de jejum; TTGO: teste de tolerância à glicose via oral; HbA1c: hemoglobina glicada; NGSP: National Glycohemoglobin Standardization Program (Programa Nacional de Padronização de Glico-hemoglobina). Fonte: Adaptado de Sacks et al., 2023.(21)
A GJ apresenta boa reprodutibilidade, é amplamente disponibilizada em serviços de saúde e os métodos analíticos para sua determinação já estão bem estabelecidos. No entanto, sua análise requer jejum e seus valores podem ser afetados por condições agudas e quadros de estresse, por exemplo, comuns durante coletas pediátricas. Além disso, em amostras coletadas sem inibidores de glicólise, como o fluoreto ou iodoacetato, a glicose pode reduzir de 5% a 7% por hora, podendo afetar a interpretação do ensaio.(22) Os laboratórios clínicos utilizam primariamente métodos enzimáticos, sendo a glicose oxidase e hexoquinase-UV os predominantes para a quantificação da glicose plasmática, os quais são bem estabelecidos e reprodutíveis. Para evitar erros de classificação de indivíduos, a dosagem da glicose deve minimizar o erro analítico total e os métodos devem ser isentos de vieses mensuráveis. Com base na variação biológica, a medição da glicose deve ter imprecisão analítica £ 2,4%, bias £ 2,1% e erro total £ 6,1%.(21)
A HbA1c apresenta como características relevantes não necessitar de jejum e indicar a glicemia média pregressa entre 2 a 3 meses. Entre as desvantagens deste exame estão o custo expressivamente maior quando comparado ao da GJ e sua disponibilidade limitada em alguns países em desenvolvimento. Além disso, por ser uma medida indireta da glicemia, pode sofrer influência de alguns fatores não glicêmicos, como variantes de hemoglobina, medicamentos (hidroxiureia, vitamina C, aspirina etc.), raça, idade, função renal, entre outros.(22) O método utilizado para a determinação da HbA1c deve ser certificado pelo Programa Nacional de Padronização de Glicohemoglobina (National Glycohemoglobin Standardization Program – NGSP, www.ngsp.org) e padronizado ou rastreável ao ensaio de referência do Diabetes Control and Complications Trial (DCCT). Só assim os resultados de HbA1c de diferentes laboratórios são harmonizados e comparáveis com os reportados no DCCT.(3)
Alguns estudos sugerem que a GJ é mais precisa que a HbA1c no diagnóstico de diabetes; enquanto a HbA1c se mostra mais específica, porém menos sensível quando comparada à GJ e ao TTGO.(23,24)
A GJ e a HbA1c são os exames laboratoriais recomendados e amplamente utilizados em razão da sua relativa conveniência e reprodutibilidade em comparação com o TTGO. O TTGO apresenta a melhor sensibilidade entre os três exames e é considerado padrão ouro para a detecção de pessoas sob risco aumentado para o desenvolvimento de diabetes, classificadas como pré-diabetes ou hiperglicemia intermediária. A HbA1c tem baixa sensibilidade (47% a 67%) e alta especificidade (98% a 99%) para o diagnóstico de DM, em relação à glicemia determinada 2 horas após a sobrecarga de glicose via oral com dose de 75g de glicose (TTGO-2h).(4)
O TTGO-2h apresenta elevada variabilidade (16,7%) quando comparado à GJ (5,7%) e à HbA1c (3,6%).(25) Logo, entre as desvantagens do TTGO estão a baixa reprodutibilidade, o tempo prolongado para a realização do exame e a possibilidade de desconforto (náusea e vômitos) após a ingesta da sobrecarga de glicose.(22)
A acurácia e a aplicabilidade dos exames laboratoriais para fins de diagnóstico da hiperglicemia são analisadas através de estudos clínicos, e diferentes estratégias e valores de corte vêm sendo propostos no decorrer do tempo. Há 30 anos, por exemplo, valores de glicemia de jejum acima de ou iguais a 140mg/dL eram usados para diagnosticar diabetes, e não existia a categoria de risco aumentado para diabetes, hoje denominada “pré-diabetes”.(26) Os critérios diagnósticos para diabetes também evoluíram ao longo do tempo para incorporar a HbA1c a partir de 2010, previamente utilizada apenas para o monitoramento.(27,28)
Testes de Sobrecarga de Glicose
A tolerância à glicose avalia a capacidade do organismo responder a uma carga de glicose.(29) Todo exame em que há ingesta oral de quantidade conhecida de glicose anidra diluída em água, com posterior determinação da glicemia plasmática em tempo pré-definido, é chamado de teste de sobrecarga de glicose. No Brasil, o teste de tolerância à glicose via oral (TTGO), com dosagem da glicose plasmática em jejum, seguida de determinação da glicemia 1h e 2h após a sobrecarga é, genericamente, denominado de teste de sobrecarga de glicose. Entretanto, a dosagem de glicemia de jejum, seguida de 5 ou 6 determinações de glicemia em tempos definidos, após sobrecarga de glicose, como por exemplo os tempos 0 (jejum), seguidos de coletas aos 30, 60, 90, 120 e 180 minutos, conhecida como curva glicêmica, também é um teste de sobrecarga de glicose.(30) Este exame é frequentemente solicitado pelos clínicos, embora não existam intervalos de referência e critérios de corte definidos ou recomendados na literatura atual.
TTGO-1h e TTGO-2h
O TTGO foi proposto há mais de 100 anos como uma dosagem capaz de avaliar a resposta do organismo a uma carga suprafisiológica de glicose.(31) Seu uso como ferramenta no contexto do diagnóstico do diabetes evoluiu consideravelmente ao longo do último século.(32)
O TTGO é o método de referência para a avaliação da tolerância à glicose, apesar da reprodutibilidade reconhecidamente baixa e de apresentar um elevado coeficiente de variação no TTGO-2h.(33,34) As evidências reforçam que o TTGO-1h é mais eficaz na classificação do estado glicêmico quando comparado a dosagens isoladas de GJ ou HbA1c. Indivíduos com hiperglicemia intermediária (pré-diabetes) e DM2 apresentaram maior adiposidade, pressão arterial, ácido úrico, pior perfil lipídico e inflamatório e redução progressiva de sensibilidade à insulina, quando comparados com indivíduos normoglicêmicos. O TTGO-1h consegue identificar indivíduos com este perfil de risco cardiometabólico desfavorável.(35)
Deve ser destacado que o TTGO é o ensaio de referência para o diagnóstico de DMG, em que as concentrações plasmáticas de glicose em jejum apresentam sensibilidade diagnóstica reduzida. Relevante apontar que, em gestantes sem diagnóstico prévio de DM, um TTGO alterado pode ser fator de risco independente para hiperglicemia pós-parto.(17,36)
Curva glicêmica
A determinação seriada de glicemia após sobrecarga com glicose permite a observação de uma curva glicêmica, definida pelo padrão de aumento e queda das concentrações de glicose após a sobrecarga de glicose. A forma da curva reflete, portanto, a função das células beta pancreáticas e o risco metabólico.(29) Diferenças no formato da curva glicêmica são documentadas desde a década de 1950, porém só recentemente pesquisadores consideraram usar as características da curva de glicose como uma ferramenta preditiva.(37)
Estudos têm evidenciado que o formato da curva de glicose pode ser utilizado para predizer a intolerância à glicose e o risco de progressão para DM2.(30,38) O perfil da curva glicêmica é definido como monofásico, bifásico ou trifásico, ou não classificado, conforme representado na Figura 2. Uma curva monofásica pode ser definida como um aumento na glicemia entre 30 e 90 minutos seguido por um declínio entre 90 e 120 minutos. Uma curva de resposta bifásica pode ser definida como uma diminuição da glicose após um aumento inicial, seguida por um segundo aumento.(39) O padrão bifásico é encontrado em 20% a 30% dos adultos sem diabetes.(38)
Indivíduos com uma curva monofásica apresentam menor sensibilidade à insulina e diminuição da função das células em comparação com indivíduos com uma curva bifásica.(40,41) Um perfil de resposta glicêmica bifásica ou trifásica (não classificada), caracterizado por aumento, queda e subsequente aumento de glicose após a sobrecarga glicêmica, tem sido associado a melhor função das células beta e concentrações mais baixas de glicose em comparação com um padrão monofásico.(37,41-43) Uma coorte multiétnica de adultos com diagnóstico recente de DM2 comparou as diferenças no formato da curva glicêmica, considerando sexo, raça, índice de massa corporal e diferenças metabólicas entre os dois formatos de curva mais comuns, monofásico e de aumento contínuo (apenas elevação da concentração de glicose no período do exame). O grupo estudado que apresentou curva com aumento contínuo da glicose foi associado com maior disfunção de células beta e valores de HbA1c mais elevados em comparação ao grupo com curva de padrão monofásico. Estes dados sugerem que a forma da curva pode também servir como um biomarcador para diabetes.(29)
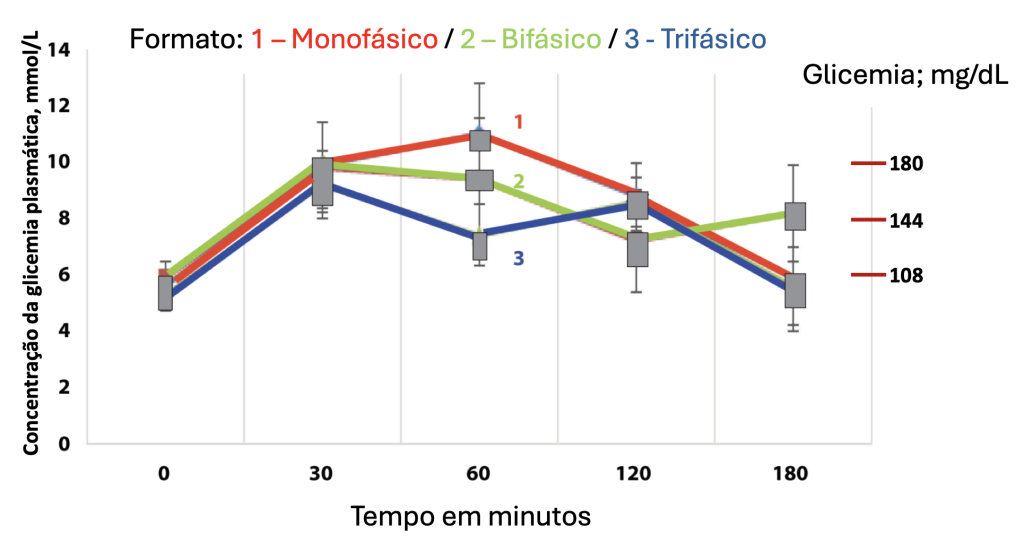
Figura 2
Padrões de formato da curva glicêmica.
Legenda: O eixo das ordenadas, numerado de 0 a 14, representa a concentração de glicose plasmática, em mmol/L. O eixo das abscissas, numerado de 0 a 180, representa o tempo, em minutos. A linha azul representa uma curva glicêmica de padrão monofásico. A linha vermelha representa uma curva glicêmica de padrão bifásico. A linha verde representa uma curva glicêmica de padrão trifásico. Fonte: Adaptado de Cheng et al., 2019.(37)
FATORES QUE INFLUENCIAM O TESTE DE SOBRECARGA DE GLICOSE
A performance do TTGO é diretamente afetada por fatores pré-analíticos e analíticos, além daqueles relacionados à dosagem laboratorial da glicemia. A reprodutibilidade do TTGO tem sido questionada por décadas, mas este exame continua sendo considerado “padrão ouro” para o diagnóstico de DM2 e DMG.(44-46)
Fatores pré-analíticos, como a variação biológica ou intraindividual, o esvaziamento gástrico, a solução de glicose para a sobrecarga de diferentes fabricantes, a liberação de hormônios hiperglicemiantes como o cortisol e a adrenalina, a idade e o sexo podem afetar a reprodutibilidade do TTGO;(47) assim como fatores analíticos, como a calibração do analisador, o método e os reagentes utilizados na determinação da glicemia plasmática.(47,48) Estas variáveis fazem com que o TTGO apresente reprodutibilidade de 64% a 80%.(47,49)
Na sequência, apresentamos e discutimos alguns fatores que influenciam este exame.
Dieta
O preparo adequado para a realização do TTGO é fundamental para evitar resultados falsamente elevados em razão da baixa ingesta de carboidratos nos dias que antecedem o exame. Os mecanismos pelo qual dietas com baixo teor de carboidratos afetam o metabolismo da glicose são complexos e não estão totalmente compreendidos. Alguns propõem que o mecanismo se deve em parte à perda da primeira fase de liberação de insulina, resultando na redução da captação periférica e hepática de glicose e na supressão incompleta da produção hepática de glicose. A baixa ingesta de carboidratos também afeta a sensibilidade à insulina, além de estar associada a um aumento nos ácidos graxos livres no plasma, o que pode reduzir a secreção de insulina.(50)
Alguns estudos mostraram que uma dieta com baixa ingesta de carboidratos não afetaria o resultado do TTGO e que manter a dieta usual antes de se submeter ao exame refletiria melhor a capacidade do indivíduo de metabolizar a glicose.(51,52) Contudo, para manter uma abordagem padronizada e aumentar a reprodutibilidade do método, o TTGO deve ser precedido por dieta sem restrição de carboidratos e com ingesta mínima diária de 150g de carboidratos durante os 3 dias que antecedem o exame, o qual deve ser realizado após jejum de 8 a 10 horas.(3,53)
Exercícios físicos
A prática de exercícios físicos pode alterar resultados de exames laboratoriais. Apesar dos dados contraditórios da literatura sobre a duração e intensidade do exercício que afetaria o resultado de exames, a atividade física influencia a forma como o organismo processa os nutrientes, como a glicose.(54-56)
No início da atividade física, ocorre uma inibição da secreção de insulina e, consequentemente, hiperglicemia. Este mecanismo ocorre para fornecer energia para o organismo. Elevação na glicemia plasmática pode ser observada 4 horas após exercícios extenuantes como uma maratona, retornando ao basal dentro de 24 horas.(57)
Após esta fase inicial de hiperglicemia, a glicose é utilizada pelas células musculares de forma independente da insulina, provavelmente por aumento no número de transportadores de membrana ativos, ocasionando hipoglicemia. A redução prolongada da concentração de glicose é influenciada pela adrenalina – antagonista da insulina – que deixa de ser liberada após esforço físico exaustivo, fazendo com que o efeito da insulina se torne predominante e potencialize a hipoglicemia por, aproximadamente, 2 horas após o término da atividade física.(58) Portanto, é recomendado que nas 24 horas que antecedem a realização do TTGO, exercícios físicos extenuantes sejam evitados.
Fumo
Outro fator interferente do TTGO é o tabaco. O fumo prejudica de forma aguda a tolerância à glicose e a sensibilidade insulínica; logo, não é permitido fumar durante a realização do TTGO.(59-61)
Solução de glicose
A composição da solução de glicose a ser administrada de forma oral, incluindo os excipientes adicionados para melhorar o paladar e o olfato, pode impactar na secreção endógena de insulina e, consequentemente, na concentração de glicose plasmática,(48) razão pela qual é interessante padronizar e validar a solução de glicose.
A maioria das instituições que realizam TTGO utilizam como fonte de sobrecarga oral de glicose uma solução líquida comercial contendo 75g de D-Glicose pura dissolvidas em 300mL de água, pela praticidade, padrão de qualidade do preparo comercial e possibilidade de oferecer opções aromatizadas para minimizar o desconforto. A percepção humana do sabor doce pode ser alterada pela temperatura, o que motiva a recomendação de oferecer a solução de glicose em temperatura fria em vez de temperatura ambiente, para reduzir náusea, especialmente em gestantes.(62)
Se o estabelecimento for preparar a solução de glicose (in house), deve cumprir as boas práticas laboratoriais para garantir que a solução final esteja na concentração padronizada. A água com gás parece melhorar os efeitos colaterais desagradáveis da solução de glicose, mas afeta o resultado do TTGO ao promover um nível glicêmico pós-carga de 1 hora mais alto do que os testes realizados com água sem gás. Assim, a água com gás não deve ser usada.(62)
No caso de TTGO em crianças ou pessoas com baixo peso, se recomenda administrar 1,75g de glicose por kg, até o máximo de 75g. Para uma criança de 12kg, por exemplo, devem ser ingeridos 84mL da solução de glicose a 75g, conforme exemplificado na Figura 3.

Figura 3
Cálculo do volume de solução de glicose para crianças e pessoas de baixo peso.
Fonte: Autores.
Esvaziamento gástrico
O comportamento de absorção da solução de glicose apresenta variação intra/interindividual, impactando também na variabilidade das concentrações de glicose no TTGO.(1) Isso porque a taxa de esvaziamento gástrico tem alta variabilidade individual e é um fator que afeta a concentração de glicose plasmática. A sobrecarga de glicose administrada durante o TTGO só consegue passar para o compartimento sanguíneo após ser esvaziada do estômago, digerida em monossacarídeos e transportada através do epitélio intestinal. A capacidade de transporte do intestino delgado e grosso excede os 75g de glicose oferecidos durante o TTGO, portanto, uma etapa limitante da taxa de absorção de glicose é a taxa de esvaziamento gástrico.(63) Ou seja, o esvaziamento gástrico é um dos principais fatores que influenciam a resposta glicêmica na primeira hora após o TTGO ou após uma refeição e é responsável por 30% a 35% da variabilidade na glicemia pós-prandial.(63)
Para minimizar o impacto do esvaziamento gástrico no resultado do TTGO a ingestão do volume total da solução de glicose deve ocorrer, preferencialmente, dentro de 5 minutos.(1)
Êmese
A intolerância gástrica à solução de glicose tem sido relacionada à alta osmolaridade da solução, causada pela alta concentração de glicose, o que também retarda o esvaziamento gástrico.(64) A êmese é o principal motivo de falha na realização do TTGO;(65) então é possível sugerir que o indivíduo faça uso de antiemético antes da realização do TTGO.(64)
Em caso de êmese, o exame deve ser interrompido e reagendado. No entanto, se o indivíduo vomitou após 30 minutos da ingesta do líquido, alguns laboratórios seguem com o TTGO informando na observação do laudo que a(o) paciente vomitou, quantas vezes vomitou e em quantos minutos após a ingesta ocorreu a êmese.
Há de se considerar que a hiperêmese gravídica causa alterações no metabolismo materno no primeiro trimestre da gravidez devido à ingesta limitada de calorias e ao jejum. Isso pode reduzir o valor preditivo positivo do rastreamento do DMG no primeiro trimestre por meio do TTGO, com aumento de resultados falsos positivos. Nestes casos é interessante avaliar o uso de outras estratégias de rastreamento e diagnóstico.(66,67)
Interferência de medicamentos
A interpretação do TTGO pode se tornar desafiadora no caso de pessoas utilizando altas doses de medicamentos que sabidamente podem induzir hiperglicemia, como glicocorticoides, antagonistas dos canais de cálcio, contraceptivos orais, inibidores da protease, interferon, betabloqueadores, diuréticos, entre outros.(68)
Tipo de amostra
A glicemia pode ser quantificada no sangue total, soro ou plasma, mas o plasma é o tipo de amostra recomendada para o diagnóstico. Deve ser considerado que a quantidade de água no plasma é aproximadamente 11% maior quando comparada à do sangue total, o que faz com que a glicemia no plasma seja aproximadamente 11% mais elevada comparada à glicemia no sangue total de pessoas com hematócrito normal.(63)
As concentrações de glicose durante um TTGO no sangue capilar de punção digital são significativamente maiores do que aquelas no sangue venoso (média de 30mg/dL, equivalente a 20% a 25%), provavelmente em razão do consumo de glicose nos tecidos. Por outro lado, a diferença média nas amostras em jejum é de apenas 2mg/dL. Isto é, as concentrações de glicemia plasmática e capilar são comparáveis no estado de jejum, mas a glicemia capilar pós-carga é significativamente mais elevada em comparação com a amostra venosa.(69)
Embora existam estudos sobre a viabilidade de autocoleta de sangue capilar em dispositivo específico para a realização de TTGO,(70-72) a amostra de sangue venoso tem sido a recomendada.(73)
Tubo de coleta
A velocidade de consumo/redução da glicose na amostra é de 5% a 7% por hora, fazendo com que a glicólise in vitro seja uma interferência pré-analítica com potencial para alterar a interpretação do TTGO. Para minimizar o efeito da glicólise, duas estratégias podem ser utilizadas pelo laboratório: 1. Coleta de sangue em tubo sem inibidor glicolítico e centrifugação da amostra e separação do soro das células sanguíneas, imediatamente ou dentro de 30 minutos após a coleta; 2. Coleta de sangue em tubos contendo um inibidor glicolítico.(21,69,74)
Logo, em locais onde o processamento imediato da amostra não é possível, se recomenda o uso de inibidores da glicólise, como o fluoreto de sódio (NaF; 2,5mg de fluoreto/mL de sangue). No entanto, o NaF por si só não é um inibidor de ação rápida da glicólise.(21) O mecanismo de ação do fluoreto se baseia na inibição da enzima enolase, que atua tardiamente na via glicolítica. Como tal, a atividade das enzimas glicolíticas localizadas a montante da enolase não é significativamente afetada e estas enzimas permanecem ativas, metabolizando a glucose. Isto explica por que o efeito completo do fluoreto na inibição da glicólise pode demorar de 30 minutos a 4 horas, período durante o qual a concentração de glicose no tubo de coleta pode diminuir consideravelmente, sobretudo quando a amostra é armazenada em temperatura ambiente.(75) Após 4 horas, a concentração de glicose é estável no sangue total por 72 horas em temperatura ambiente na presença de fluoreto.(21,74)
Para melhorar a ação glicolítica, o NaF pode ser usado em associação com anticoagulantes como oxalato de potássio, EDTA, citrato ou heparina de lítio. Vários estudos demonstraram a eficácia de tubos contendo citrato/fluoreto/EDTA (CFE) na inibição da glicólise,(76-78) e atualmente o uso de tubos de coleta tamponados com citrato é recomendado para a determinação de glicemia, especialmente se o processamento da amostra provavelmente demorar mais de 30 minutos após a coleta.(21)
Importante considerar, também, que, em amostras com elevada contagem de leucócitos, a glicólise aumenta mesmo na presença de fluoreto.(21)
Dosagem da glicemia
A dosagem da glicemia é o fator analítico central do TTGO. Uma medição imprecisa da glicose impactará em erro diagnóstico, manejo incorreto do paciente, desfechos desfavoráveis e aumento com os custos de saúde. A glicemia dosada a partir de plasma heparinizado, por exemplo, é aproximadamente 5% menor quando comparada com a glicemia dosada em soro, possivelmente devido ao desvio de fluido dos eritrócitos para o plasma decorrente do anticoagulante.(69)
Os métodos para medir a glicose devem ser calibrados (rastreáveis) aos métodos de referência. Atualmente, existem dois métodos de referência para medição de glicemia plasmática recomendados pelo Comitê Conjunto para Rastreabilidade em Medicina Laboratorial (Joint Committee for Traceability in Laboratory Medicine): espectrometria de massa por diluição isotópica (IDMS) e enzimático Hexoquinase/Glicose-6-Fosfato Desidrogenase. O desvio máximo permitido entre o método do laboratório e o método de referência é de 4%. No ambiente laboratorial, a glicose é comumente determinada com um dos seguintes métodos enzimáticos: hexoquinase, glicose desidrogenase ou glicose oxidase em reações que são acopladas a um cromóforo, absorção no ultravioleta ou geram uma corrente elétrica.(63)
As metodologias empregando glicose oxidase/peroxidase (colorimétrica) e hexoquinase UV (ultravioleta) apresentam resultados similares e não afetam a caracterização do DM.(79)
CONSIDERAÇÕES FINAIS
O diabetes é uma síndrome multifatorial crônica e silenciosa, que acomete aproximadamente 10% da população global. Não tendo cura, é fundamental que o diagnóstico do DM seja precoce a fim de minimizar as complicações vasculares crônicas.
O laboratório de análises clínicas desempenha papel central no rastreamento, diagnóstico e monitoramento do DM, através dos exames de glicemia plasmática, HbA1c e TTGO. Recentemente foi incorporado a glicemia determinada 1 hora após a sobrecarga de glicose via oral (TTGO-1h) entre os critérios para o diagnóstico de diabetes e pré-diabetes, por ser um preditor mais sensível e precoce de DM2, doença cardiovascular, microangiopatia e mortalidade em comparação com os critérios usados até então. Valores de TTGO-1h de 155mg/dL classificam hiperglicemia intermediária (pré-diabetes) e valores ³ 209mg/dL, diabetes.
Assim, o teste de sobrecarga de glicose passa a ter novo destaque. Há de se enfatizar que todo exame realizado após ingesta oral de quantidade conhecida de glicose, com posterior determinação da glicemia plasmática, é um teste de sobrecarga de glicose. No Brasil, a glicose plasmática em jejum, seguida de determinação da glicemia 1 hora e 2 horas após a ingesta de solução de glicose, é usualmente chamada de TTGO; e o teste de sobrecarga com dosagem de glicemia de jejum, seguida de 5 ou 6 determinações de glicemia a cada 30 minutos após a ingesta da solução de glicose é conhecido como curva glicêmica.
Para a realização de testes de sobrecarga de glicose, é recomendado evitar exercícios físicos intensos nas 24 horas que antecedem o exame. Não é permitido fumar durante o exame. O exame será realizado após jejum de 8 a 10 horas, e durante os 3 dias anteriores ao exame é recomendada dieta com ingesta diária de, no mínimo, 150g de carboidratos.
A solução de glicose deve conter 75g de glicose dissolvidas em 250 a 300mL de água, ou 1,75g de glicose por kg, até o máximo de 75g. A ingesta do volume total da solução de glicose deve ocorrer, preferencialmente, dentro de 5 minutos. Em caso de êmese, o teste deve ser interrompido e reagendado. Contudo, se o paciente vomitou após 30 minutos da ingesta do líquido, pode ser considerado seguir com o exame, reportando no laudo o ocorrido.
É preferível que a amostra utilizada no TTGO seja plasma coletado em tubo contendo citrato/fluoreto/EDTA, caso a centrifugação da amostra e separação do plasma das células sanguíneas não possam ser realizadas em até 30 minutos após a coleta.
A metodologia utilizada para a medida da glicemia deve ser rastreável aos métodos de referência; podendo ser empregados os métodos enzimáticos colorimétricos com glicose oxidase/peroxidase ou os métodos enzimáticos UV utilizando hexoquinase.
Finalmente, deve ser ressaltado que o TTGO e a curva glicêmica apresentam variabilidade elevada, que pode interferir na interpretação dos resultados. Este trabalho revisa observações sobre os testes de sobrecarga de glicose, além de destacar os novos critérios para diagnóstico de diabetes.
REFERÊNCIAS
- Pleus S, Tytko A, Landgraf R, Heinemann L, Werner C, Müller-Wieland D, et al. Definition, Classification, Diagnosis and Differential Diagnosis of Diabetes Mellitus: Update 2023. Experimental and Clinical Endocrinology & Diabetes. 2024 Mar 20;132(03):112-24.
- Zhou B, Sheffer KE, Bennett JE, Gregg EW, Danaei G, Singleton RK, et al. Global variation in diabetes diagnosis and prevalence based on fasting glucose and hemoglobin A1c. Nat Med. 2023 Nov 9;29(11):2885-901.
- ElSayed NA, Aleppo G, Bannuru RR, Bruemmer D, Collins BS, Ekhlaspour L, et al. ADA. Diagnosis and Classification of Diabetes: Standards of Care in Diabetes-2024. Diabetes Care. 2024 Jan 1;47(Supplement_1):S20-42.
- Rodacki M, Cobas RA, Zajdenverg L, Silva Júnior WS da, Giacaglia L, Calliari LE, et al. Diagnóstico de diabetes mellitus. In: Diretriz da Sociedade Brasileira de Diabetes. Conectando Pessoas; 2024.
- Abdul-Ghani MA, Abdul-Ghani T, Ali N, DeFronzo RA. One-Hour Plasma Glucose Concentration and the Metabolic Syndrome Identify Subjects at High Risk for Future Type 2 Diabetes. Diabetes Care. 2008 Aug 1;31(8):1650-5.
- Ha J, Chung ST, Bogardus C, Jagannathan R, Bergman M, Sherman AS. One-hour glucose is an earlier marker of dysglycemia than two-hour glucose. Diabetes Res Clin Pract. 2023 Sep;203:110839.
- Alyass A, Almgren P, Akerlund M, Dushoff J, Isomaa B, Nilsson P, et al. Modelling of OGTT curve identifies 1 h plasma glucose level as a strong predictor of incident type 2 diabetes: results from two prospective cohorts. Diabetologia. 2015 Jan 8;58(1):87-97.
- Fiorentino TV, Marini MA, Andreozzi F, Arturi F, Succurro E, Perticone M, et al. One-Hour Postload Hyperglycemia Is a Stronger Predictor of Type 2 Diabetes Than Impaired Fasting Glucose. J Clin Endocrinol Metab. 2015 Oct 1;100(10):3744-51.
- Fiorentino TV, Marini MA, Succurro E, Andreozzi F, Perticone M, Hribal ML, et al. One-Hour Postload Hyperglycemia: Implications for Prediction and Prevention of Type 2 Diabetes. J Clin Endocrinol Metab. 2018 Sep 1;103(9):3131-43.
- Ahuja V, Aronen P, Pramodkumar TA, Looker H, Chetrit A, Bloigu AH, et al. Erratum. Accuracy of 1-Hour Plasma Glucose During the Oral Glucose Tolerance Test in Diagnosis of Type 2 Diabetes in Adults: A Meta-analysis. Diabetes Care 2021;44:1062–1069. Diabetes Care. 2021 Jun;44(6):1457-1457.
- Bergman M, Manco M, Satman I, Chan J, Schmidt MI, Sesti G, et al. International Diabetes Federation Position Statement on the 1-hour post-load plasma glucose for the diagnosis of intermediate hyperglycaemia and type 2 diabetes. Diabetes Res Clin Pract. 2024 Mar;209:111589.
- Diagnostic criteria and classification of hyperglycaemia first detected in pregnancy: A World Health Organization Guideline. Diabetes Res Clin Pract. 2014 Mar;103(3):341-63.
- Classification and Diagnosis of Diabetes Mellitus and Other Categories of Glucose Intolerance. Diabetes. 1979 Dec 1;28(12):1039-57.
- International Association of Diabetes and Pregnancy Study Groups Recommendations on the Diagnosis and Classification of Hyperglycemia in Pregnancy. Diabetes Care. 2010 Mar 1;33(3):676-82.
- González‐González NL, González‐Dávila E, Megía A, Pintado P, Vega B, Padrón E, et al. The NDDG criteria versus the IADPSG or the ADA criteria for diagnosing early‐onset gestational diabetes mellitus or abnormal glucose tolerance. International Journal of Gynecology & Obstetrics. 2023 Mar 26;160(3):906-14.
- Zajdenverg L, Façanha CFS, Dualib PM, Golbert A, Moisés ECD, Calderon I de MP, et al. Rastreamento e diagnóstico da hiperglicemia na gestação. In: Diretriz Oficial da Sociedade Brasileira de Diabetes. Conectando Pessoas; 2022.
- Mi C, Liu H, Peng H, Cheng C, Wang M, Liu H, et al. Relationships Among Pre-Pregnancy BMI, Gestational, and Postpartum Oral Glucose Tolerance Results in Women With Gestational Diabetes Mellitus. Front Nutr. 2021 Dec 1;8.
- Brown FM, Wyckoff J. Application of One-Step IADPSG Versus Two-Step Diagnostic Criteria for Gestational Diabetes in the Real World: Impact on Health Services, Clinical Care, and Outcomes. Curr Diab Rep. 2017 Oct 10;17(10):85.
- Moon JH, Jang HC. Gestational Diabetes Mellitus: Diagnostic Approaches and Maternal-Offspring Complications. Diabetes Metab J. 2022 Jan 31;46(1):3-14.
- Ramezani Tehrani F, Sheidaei A, Rahmati M, Farzadfar F, Noroozzadeh M, Hosseinpanah F, et al. Various screening and diagnosis approaches for gestational diabetes mellitus and adverse pregnancy outcomes: a secondary analysis of a randomized non-inferiority field trial. BMJ Open Diabetes Res Care. 2023 Dec 12;11(6):e003510.
- Sacks DB, Arnold M, Bakris GL, Bruns DE, Horvath AR, Lernmark Å, et al. Guidelines and Recommendations for Laboratory Analysis in the Diagnosis and Management of Diabetes Mellitus. Diabetes Care. 2023 Oct 1;46(10):e151-99.
- Garonzi C, Maguolo A, Maffeis C. Pros and Cons of Current Diagnostic Tools for Risk-Based Screening of Prediabetes and Type 2 Diabetes in Children and Adolescents with Overweight or Obesity. Horm Res Paediatr. 2023;96(4):356-65.
- Duong KNC, Tan CJ, Rattanasiri S, Thakkinstian A, Anothaisintawee T, Chaiyakunapruk N. Comparison of diagnostic accuracy for diabetes diagnosis: A systematic review and network meta-analysis. Front Med (Lausanne). 2023 Jan 24;10.
- Kaur G, Lakshmi PVM, Rastogi A, Bhansali A, Jain S, Teerawattananon Y, et al. Diagnostic accuracy of tests for type 2 diabetes and prediabetes: A systematic review and meta-analysis. PLoS One. 2020 Nov 20;15(11):e0242415.
- Selvin E, Crainiceanu CM, Brancati FL, Coresh J. Short-term Variability in Measures of Glycemia and Implications for the Classification of Diabetes. Arch Intern Med. 2007 Jul 23;167(14):1545.
- Wareham NJ, O’Rahilly S. The changing classification and diagnosis of diabetes. BMJ. 1998 Aug 8;317(7155):359-60.
- International Expert Committee Report on the Role of the A1C Assay in the Diagnosis of Diabetes. Diabetes Care. 2009 Jul 1;32(7):1327-34.
- Diagnosis and Classification of Diabetes Mellitus. Diabetes Care. 2010 Jan 1;33(Supplement_1):S62-9.
- Utzschneider KM, Younes N, Rasouli N, Barzilay JI, Banerji MA, Cohen RM, et al. Shape of the OGTT glucose response curve: relationship with β-cell function and differences by sex, race, and BMI in adults with early type 2 diabetes treated with metformin. BMJ Open Diabetes Res Care. 2021 Sep 16;9(1):e002264.
- Vejrazkova D, Vankova M, Lukasova P, Hill M, Vcelak J, Tura A, et al. The Glycemic Curve during the Oral Glucose Tolerance Test: Is It Only Indicative of Glycoregulation? Biomedicines. 2023 Apr 25;11(5):1278.
- Barr RG, Nathan DM, Meigs JB, Singer DE. Tests of Glycemia for the Diagnosis of Type 2 Diabetes Mellitus. Ann Intern Med. 2002 Aug 20;137(4):263.
- Jagannathan R, Neves JS, Dorcely B, Chung ST, Tamura K, Rhee M, et al. The Oral Glucose Tolerance Test: 100 Years Later. Diabetes Metab Syndr Obes. 2020 Oct;Volume 13:3787-805.
- Feskens E, Bowles C, Kromhout D. Intra- and interindividual variability of glucose tolerance in an elderly population. J Clin Epidemiol. 1991;44(9):947-53.
- Chai JH, Ma S, Heng D, Yoong J, Lim WY, Toh SA, et al. Impact of analytical and biological variations on classification of diabetes using fasting plasma glucose, oral glucose tolerance test and HbA1c. Sci Rep. 2017 Oct 20;7(1):13721.
- Cefalo CMA, Riccio A, Fiorentino TV, Succurro E, Mannino GC, Perticone M, et al. Pathophysiological characteristics of subjects with intermediate hyperglycemia and type 2 diabetes identified by 1-hour plasma glucose during an oral glucose tolerance test. Diabetes Res Clin Pract. 2024 Nov;217:111856.
- Song G, Wei Y, Juan J, Niu J, Yang H. The predictive ability of the triglyceride glucose index, fasting glucose and oral glucose tolerance test for postpartum hyperglycemia in women with a GDM history. The Journal of Maternal-Fetal & Neonatal Medicine. 2024 Jan 2;37(1).
- Cheng X, Yang N, Li Y, Sun Q, Qiu L, Xu L, et al. The shape of the glucose response curve during an oral glucose tolerance test heralds β–cell function in a large Chinese population. BMC Endocr Disord. 2019 Dec 5;19(1):119.
- Abdul‐Ghani MA, Lyssenko V, Tuomi T, DeFronzo RA, Groop L. The shape of plasma glucose concentration curve during OGTT predicts future risk of type 2 diabetes. Diabetes Metab Res Rev. 2010 May 20;26(4):280-6.
- Ismail HM, Xu P, Libman IM, Becker DJ, Marks JB, Skyler JS, et al. The shape of the glucose concentration curve during an oral glucose tolerance test predicts risk for type 1 diabetes. Diabetologia. 2018 Jan 27;61(1):84-92.
- Tschritter O, Fritsche A, Shirkavand F, Machicao F, Häring H, Stumvoll M. Assessing the Shape of the Glucose Curve During an Oral Glucose Tolerance Test. Diabetes Care. 2003 Apr 1;26(4):1026-33.
- Kim JY, Michaliszyn SF, Nasr A, Lee S, Tfayli H, Hannon T, et al. The Shape of the Glucose Response Curve During an Oral Glucose Tolerance Test Heralds Biomarkers of Type 2 Diabetes Risk in Obese Youth. Diabetes Care. 2016 Aug 1;39(8):1431-9.
- de Andrade Mesquita L, Pavan Antoniolli L, Cittolin-Santos GF, Gerchman F. Distinct metabolic profile according to the shape of the oral glucose tolerance test curve is related to whole glucose excursion: a cross-sectional study. BMC Endocr Disord. 2018 Dec 16;18(1):56.
- Arslanian S, El ghormli L, Young Kim J, Bacha F, Chan C, Ismail HM, et al. The Shape of the Glucose Response Curve During an Oral Glucose Tolerance Test: Forerunner of Heightened Glycemic Failure Rates and Accelerated Decline in β-Cell Function in TODAY. Diabetes Care. 2019 Jan 1;42(1):164-72.
- Lages M, Barros R, Moreira P, Guarino MP. Metabolic Effects of an Oral Glucose Tolerance Test Compared to the Mixed Meal Tolerance Tests: A Narrative Review. Nutrients. 2022 May 12;14(10):2032.
- Kirke AB, Spry E, Atkinson D, Sinclair C, Marley J V. Oral glucose tolerance test—The imperfect gold standard for gestational diabetes screening: A qualitative study involving clinicians in regional, rural and remote areas of Western Australia. Health Promotion Journal of Australia. 2024 Jul 7.
- Gomez P, Sanchez J. Type 1 Diabetes Screening and Diagnosis. Endocrinol Metab Clin North Am. 2024 Mar;53(1):17-26.
- Testa R, Lo Cascio C, Fabbietti P, Bonfigli AR. OGTT reproducibility in adults with impaired fasting glucose is nearly 65% with adoption of Italian SIBioC-SIPMeL recommendations. Clinical Chemistry and Laboratory Medicine (CCLM). 2021 Jul 27;59(8):e341-3.
- Heinemann L. Are all glucose solutions used for oGTT equal? Diabetic Medicine. 2022 May 7;39(5).
- Jagannathan R, DuBose CW, Mabundo LS, Chung ST, Ha J, Sherman A, et al. The OGTT is highly reproducible in Africans for the diagnosis of diabetes: Implications for treatment and protocol design. Diabetes Res Clin Pract. 2020 Dec;170:108523.
- Klein KR, Walker CP, McFerren AL, Huffman H, Frohlich F, Buse JB. Carbohydrate Intake Prior to Oral Glucose Tolerance Testing. J Endocr Soc. 2021 May 1;5(5).
- Secen EI, Desdicioglu R, Ergun GT, Usta E, Ozgu-Erdinc AS. The Relationship between a High Carbohydrate Diet and Oral Glucose Tolerance Test in Pregnancy. Z Geburtshilfe Neonatol. 2024 Jun 17;228(03):255-9.
- Buhling KJ, Elsner E, Wolf C, Harder T, Engel B, Wascher C, et al. No influence of high- and low-carbohydrate diet on the oral glucose tolerance test in pregnancy. Clin Biochem. 2004 Apr;37(4):323-7.
- Rosenberg EA, Seely EW, James K, Arenas J, Callahan MJ, Cayford M, et al. Relationship between carbohydrate intake and oral glucose tolerance test results among pregnant women. Diabetes Res Clin Pract. 2021 Jun;176:108869.
- Romagnoli M, Alis R, Aloe R, Salvagno GL, Basterra J, Pareja-Galeano H, et al. Influence of training and a maximal exercise test in analytical variability of muscular, hepatic, and cardiovascular biochemical variables. Scand J Clin Lab Invest. 2014 Apr 31;74(3):192-8.
- Sanchis-Gomar F, Lippi G. Physical activity – an important preanalytical variable. Biochem Med (Zagreb). 2014;68-79.
- Fragala MarenS, Bi C, Chaump M, Kaufman HW, Kroll MH. Associations of aerobic and strength exercise with clinical laboratory test values. PLoS One. 2017 Oct 23;12(10):e0180840.
- Foran SE, Lewandrowski KB, Kratz A. Effects Of Exercise On Laboratory Test Results. Lab Med. 2003 Oct 1;34(10):736-42.
- Hughes DC, Ellefsen S, Baar K. Adaptations to Endurance and Strength Training. Cold Spring Harb Perspect Med. 2018 Jun;8(6):a029769.
- Frati AC, Iniestra F, Ariza CR. Acute Effect of Cigarette Smoking on Glucose Tolerance and Other Cardiovascular Risk Factors. Diabetes Care. 1996 Feb 1;19(2):112-8.
- Harris KK, Zopey M, Friedman TC. Metabolic effects of smoking cessation. Nat Rev Endocrinol. 2016 May 4;12(5):299-308.
- Grøndahl MF, Bagger JI, Lund A, Faurschou A, Rehfeld JF, Holst JJ, et al. Effects of Smoking Versus Nonsmoking on Postprandial Glucose Metabolism in Heavy Smokers Compared With Nonsmokers. Diabetes Care. 2018 Jun 1;41(6):1260-7.
- Wang P, Chang PC, Wang CY, Wang LC, Shih CL. Comparing the effects of water temperature and additives in glucose solution on pregnant women’s taste, side effects, and glycemic levels during an oral glucose tolerance test: a randomized controlled trial. Am J Obstet Gynecol MFM. 2023 Apr;5(4):100870.
- Bogdanet D, O’Shea P, Lyons C, Shafat A, Dunne F. The Oral Glucose Tolerance Test—Is It Time for a Change?—A Literature Review with an Emphasis on Pregnancy. J Clin Med. 2020 Oct 27;9(11):3451.
- Navarro-Martinez H, Flores-Le Roux JA, Llauradó G, Gortazar L, Payà A, Mañé L, et al. One abnormal value or vomiting after oral glucose tolerance test in pregnancy: incidence and impact on maternal-fetal outcomes. Gynecological Endocrinology. 2023 Dec 14;39(1).
- Agarwal MM, Punnose J, Dhatt GS. Gestational diabetes: problems associated with the oral glucose tolerance test. Diabetes Res Clin Pract. 2004 Jan;63(1):73-4.
- Madendag Y, Sahin E, Madendag Col I, Eraslan SM, Tayyar AT, Ozdemir F, et al. The effect of hyperemesis gravidarum on the 75 g oral glucose tolerance test screening and gestational diabetes mellitus. The Journal of Maternal-Fetal & Neonatal Medicine. 2018 Aug 3;31(15):1989-92.
- Bayraktar B, Balıkoğlu M, Bayraktar MG, Kanmaz AG. The Effects of Hyperemesis Gravidarum on the Oral Glucose Tolerance Test Values and Gestational Diabetes. Prague Med Rep. 2021;122(4):285-93.
- Fathallah N, Slim R, Larif S, Hmouda H, Ben Salem C. Drug-Induced Hyperglycaemia and Diabetes. Drug Saf. 2015 Dec 14;38(12):1153-68.
- Kuwa K, Nakayama T, Hoshino T, Tominaga M. Relationships of glucose concentrations in capillary whole blood, venous whole blood and venous plasma. Clinica Chimica Acta. 2001 May;307(1-2):187-92.
- Bethel MA, Price HC, Sourij H, White S, Coleman RL, Ring A, et al. Evaluation of a Self-Administered Oral Glucose Tolerance Test. Diabetes Care. 2013 Jun 1;36(6):1483-8.
- Dunseath GJ, Bright D, Jones C, Dowrick S, Cheung W ‐Y., Luzio SD. Performance evaluation of a self‐administered home oral glucose tolerance test kit in a controlled clinical research setting. Diabetic Medicine. 2019 Jul 26;36(7):862-7.
- Tan AYS, Tan MS, Wu A, Seah AC, Chong C, Koh E, et al. Self-administered oral glucose tolerance test with capillary glucose measurements for the screening of diabetes mellitus in high-risk adults: a feasibility study. BMJ Open Diabetes Res Care. 2021 Dec 24;9(2):e002556.
- Larsson-Cohn U. Differences between capillary and venous blood glucose during oral glucose tolerance tests. Scand J Clin Lab Invest. 1976 Dec;36(8):805-8.
- Jung J, Garnett E, Rector K, Jariwala P, Devaraj S. Effect of Collection Tube Type on Glucose Stability in Whole Blood. Ann Clin Lab Sci. 2020 Jul;50(4):557-9.
- Lippi G, Nybo M, Cadamuro J, Guimaraes JT, van Dongen-Lases E, Simundic AM. Blood Glucose Determination: Effect of Tube Additives. In 2018. p. 101-23.
- Daly N, Flynn I, Carroll C, Stapleton M, O’Kelly R, Turner MJ. Comparison of Citrate-Fluoride-EDTA with Fluoride-EDTA Additives to Stabilize Plasma Glucose Measurements in Women Being Screened during Pregnancy with an Oral Glucose Tolerance Test: A Prospective Observational Study. Clin Chem. 2016 Jun 1;62(6):886-7.
- Fobker M. Stability of glucose in plasma with different anticoagulants. Clinical Chemistry and Laboratory Medicine (CCLM). 2014 Jan 1;52(7).
- Pleus S, Beil A, Baumstark A, Haug C, Freckmann G. Plasma Glucose Concentrations in Different Sampling Tubes Measured on Different Glucose Analysers. Experimental and Clinical Endocrinology & Diabetes. 2024 May 2;132(05):260-6.
- Miller WG, Myers GL, Ashwood ER, Killeen AA, Wang E, Ehlers GW, et al. State of the Art in Trueness and Interlaboratory Harmonization for 10 Analytes in General Clinical Chemistry. Arch Pathol Lab Med. 2008 May 1;132(5):838-46.
Correspondência
Mauren Isfer Anghebem
E-mail: [email protected]
