Exame coprológico funcional
Functional coprological examination
Lenilza Mattos Lima1, Vera Lucia Pagliusi Castilho2
1 Universidade Federal de Santa Catarina. Florianópolis, SC, Brasil.
2 Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo – HCFMUSP, Divisão de Laboratório Central – Parasitologia Clínica. São Paulo, SP, Brasil.
Recebido em 09/10/2024
Aprovado em 23/10/2024
DOI: 10.21877/2448-3877.202400215.pt
INTRODUÇÃO
O sistema digestivo é um dos mais importantes do corpo humano. Ele é responsável por todo o processamento e absorção dos nutrientes provenientes dos alimentos ingeridos, permitindo o bom funcionamento do organismo. Para o intestino funcionar adequadamente é preciso um conjunto de hábitos que incluem uma boa ingesta de fibras (frutas, verduras, legumes e cereais) e de água.(1,2)
A presença de fibras nas fezes ajuda a promover o bom funcionamento do intestino, prevenindo a constipação e promovendo a regularidade intestinal. Além disso, as bactérias intestinais presentes no bolo fecal desempenham um papel importante na manutenção do equilíbrio da microbiota intestinal. O aspecto e a consistência do bolo fecal podem variar de acordo com a dieta, a hidratação e a saúde do indivíduo.(1,2)
A consistência das fezes está diretamente relacionada à quantidade de água que contém. Normalmente, as fezes apresentam a seguinte composição:(1)
Água……………………………….75%
Matéria sólida…………………..25%
Bactérias mortas……………….30%
Gordura……………………………10% a 20%
Matéria inorgânica…………….10% a 20%
Proteínas…………………………..2% a 3%
Resto não digerido……………..30%
O objetivo da coprologia funcional é o estudo das funções motoras, digestivas e de absorção do tubo digestivo por meio do exame das fezes. O estudo abrange as provas de digestibilidade macroscópica e microscópica, e exames químicos. A dosagem de gordura fecal é solicitada separadamente, devido a dieta preconizada ser diferente. O parasitológico de fezes e a coprocultura são exames complementares e solicitados de forma isolada.(1-3)
Os resultados do exame coprológico funcional podem levar o clínico ao diagnóstico de eventuais distúrbios funcionais gastroentéricos, estabelecendo síndromes coprológicas como as descritas a seguir: insuficiência gástrica, insuficiência pancreática, insuficiência biliar, putrefação, fermentação hidrogenada, síndrome fecal e do íleo, constipação, colites e deficiência de dissacaridase intestinal.(1,2)
O papel do laboratório de análises clínicas é de grande relevância na análise das fezes, interpretando e liberando resultados que irão auxiliar o médico nas síndromes coprológicas.
Na literatura temos poucas publicações sobre o exame coprológico funcional, a maioria delas é antiga, mas de grande valor no estudo das funções digestivas. Neste sentido, o presente artigo objetiva oferecer aos profissionais das análises clínicas e áreas afins uma revisão, com informações compiladas e atualizadas, para uma consulta mais prática do exame coprológico funcional.
EXAME COPROLÓGICO FUNCIONAL
Fase pré-analítica
Preparo do paciente
Para a realização do coprológico funcional, recomenda-se uma alimentação rica em substâncias que irão facilitar a observação diagnóstica. A alimentação deve conter hidratos de carbono, gorduras e proteínas. A padronização de um regime de prova com a inclusão de todos os alimentos digeríveis facilitará a leitura do exame e permitirá a comparação dos resultados obtidos, ampliando a possibilidade de investigação das funções do aparelho gastrointestinal.(2)
Os clássicos regimes preconizados por Schmidt-Strasburger para o exame das funções digestivas nem sempre correspondem aos costumes e necessidades calóricas dos habitantes de cada país, como no Brasil. No entanto, o regime de prova criado por outros gastroenterologistas usou a mesma linha de alimentos fundamentais proposto por Schmidt-Strasburger.(1,4) Recomenda-se ao paciente durante três dias (72 horas) um regime alimentar normal contendo carne, leite, batata, feijão e manteiga. O paciente conserva seus hábitos alimentares, acrescentando os alimentos necessários e fundamentais ao exame. Deve-se ainda recomendar uma boa mastigação e advertência para não usar qualquer medicamento como antiácidos, enzimas digestivas, antiespasmódicos, laxantes e antidiarreicos. Evitar o uso de bebidas gasosas e alcoólicas.(1,2,4)
Em lactentes e crianças até 12 anos não se aplica os critérios de regime de prova para avaliação digestiva.(1)
É relevante que o paciente receba, de forma verbal e por escrito, as informações claras e detalhadas do regime de prova, e recomendação sobre a importância de cumprir a dieta com exatidão.
Coleta das fezes
Realizar a coleta das fezes no quarto dia após o regime de prova. Caso haja prisão de ventre, prolongar o regime por um ou dois dias, mas nunca usar laxante que irá interferir nos resultados e interpretação do exame.(1,2)
Colher todo o material fecal ou cerca de 50g da parte média da evacuação, em frasco de boca larga, de plástico com tampa rosqueável, limpo e seco. Evitar a contaminação com urina, água e terra. Não colher as fezes do vaso sanitário. Para a coleta de amostras de fezes de crianças que ainda usam fraldas, colocar o saquinho coletor de urina na região anal. As fezes devem ser frescas, sem conservante. Enviar o material fecal imediatamente ao laboratório (em, no máximo, 2 horas), para que se proceda o exame o mais rápido possível, tendo em vista a possibilidade de desenvolvimento de fermentação e putrefação e degeneração dos elementos observados.
As instruções para a coleta da amostra de fezes devem ser fornecidas ao paciente verbalmente e por escrito ou de forma digital.(1,2)
Fase analítica
Exame macroscópico e características físicas das fezes
As amostras fecais devem ser examinadas macroscopicamente para determinar as características físicas das fezes como consistência, aspecto, forma, odor, cor, viscosidade, elementos anormais e resíduos alimentares.(3) O exame macroscópico permite ainda verificar a presença de vermes adultos e proglotes.
Peso: o peso das fezes eliminadas em 24 horas varia em função direta da quantidade e qualidade dos alimentos ingeridos. O volume normal das fezes varia de 100g/dia a 150g/dia, podendo chegar a 250g/dia na dieta mais abundante e dependendo da quantidade de fibras ingeridas.(1,4)
Interpretação e correlação clínica: algumas condições patológicas podem interferir no volume da massa fecal. Assim, o aumento do peso pode ser observado na insuficiência pancreática, nos processos inflamatórios no intestino e na fermentação intestinal intensa. Já nos casos de constipação e na pouca ingestão de água o volume está diminuído.(1,4)
Consistência, aspecto e forma: as fezes normais e consideradas sólidas contêm aproximadamente 75% de água; fezes moles ou pastosas contêm cerca de 80% de água; e as diarreicas ou líquidas, aproximadamente 90% de água. As fezes normais são cilíndricas, moldadas pelo esfíncter anal.(1,4) É recomendado avaliar as fezes observando a escala de Bristol de consistência das fezes (Figura 1). Trata-se de uma escala médica desenvolvida na Universidade de Bristol, Inglaterra, para classificar as fezes humanas em sete tipos de formatos e consistências das fezes.(3,5)
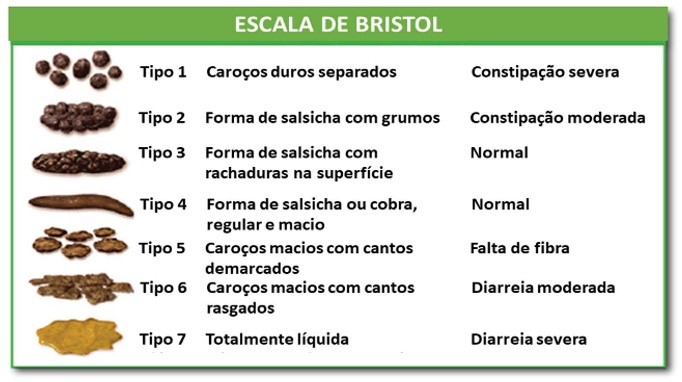
Figura 1
Escala de Bristol para consistência das fezes.
Fonte: https://pt.wikipedia.org/wiki/Escala_de_Bristol
Cor: as fezes normais apresentam a cor castanho-parda, e esta coloração decorre da presença de estercobilina, um dos pigmentos derivados da bilirrubina. Em outras condições podem ser: esverdeadas ou verdes, amareladas, pretas (melenas), vermelhas e descoradas. A coloração pode variar com a ingestão de alimentos como verduras, medicamentos e até patologias.(1,4)
Interpretação e correlação clínica: as fezes de cor verde geralmente indicam o consumo excessivo de vegetais verde-escuros, como couve, brócolis, agrião, rúcula e espinafre.(1) As fezes pretas ou melenas podem indicar sangue digerido, proveniente das partes altas do trato digestivo, ou ingestão de alimentos ou uso de suplemento de ferro; as fezes vermelhas podem indicar a presença de sangue não digerido, ou pode ser após a ingestão de grande quantidade de beterraba. As fezes podem estar descoradas pela ausência de estercobilina e condições patológicas.(1,4)
Odor: as fezes normais apresentam odor fecal característico, sui generis ou fétido.
Interpretação e correlação clínica: odor butírico ou rançoso nas fezes é associado à fermentação intestinal; odor pútrido indica putrefação intestinal. Nos carcinomas de cólon e reto o odor das fezes é pútrido.(1,4)
Viscosidade: a viscosidade é pequena nas fezes normais. Na putrefação intestinal e na colite, as fezes são muito viscosas.(1,4)
Elementos anormais: presença ou ausência de muco, pus e sangue.
A presença de uma pequena quantidade de muco nas fezes é normal. No entanto, a presença de muco abundante ou muco sanguinolento é sinal de irritação ou inflamação do trato intestinal, e deve ser investigado.(3,4) A presença de sangue visível também pode indicar problemas no trato gastrointestinal inferior, como hemorroidas ou fissuras anais.
Restos alimentares: para dispersar os detritos macroscópicos é recomendado fazer esta análise após diluição de uma parte da amostra fecal com água (10mL), vertendo a diluição em placa de Petri, espalhando em camada fina e observando em fundo negro. Nas fezes podem-se encontrar sementes, grãos de feijão e de milho. Em casos de insuficiência pancreática ou trânsito intestinal acelerado observam-se fragmentos de cenoura, maçã, carne ou de batata.(1,2,4)
Exame químico
Reação e determinação do pH
As fezes têm reação neutra, fracamente ácida ou fracamente alcalina, ou seja, o pH das fezes normalmente oscila entre 6,8 e 7,2. Na criança, principalmente o lactente, o pH poderá estar entre 5,0 e 6,0.(1,4)
A determinação da reação e do pH é um procedimento importante, mas que não exige o uso de equipamento pHmetro. É um método colorimétrico, e o papel indicador de pH ou fitas indicadoras de pH são comumente utilizados para esta determinação em laboratórios.(1,4)
Procedimento: homogeneizar as fezes com a ponta de um bastão de vidro ou palito de madeira, coletar de pontos diferentes da massa fecal, e aplicar uma pequena porção na tira do papel indicador de pH. O papel mudará a cor, a qual deve ser comparada com a cor correspondente da escala que vai representar o pH das fezes.(1,4)
Diluição das fezes
Em um frasco plástico ou Becker, fazer uma diluição de fezes a 10% (10g para 100mL de água), coleta de várias partes do bolo fecal, misturando gradualmente a água destilada ou deionizada, e dissolvendo as fezes com bastão de vidro até a obtenção de uma suspensão bem homogênea.(1,4)
Pesquisa de substâncias redutoras
A presença de substâncias redutoras nas fezes pode indicar uma deficiência congênita de dissacaridases intestinais (lactase, maltase, sacarase) ou uma lesão não específica da mucosa. A má absorção dos diferentes açúcares, ocasionada por essas deficiências enzimáticas, determina o aparecimento das substâncias redutoras e uma queda no pH das fezes.(1,4) A intolerância aos dissacarídeos, especialmente a lactose, é a mais predominante intolerância aos carboidratos na infância.(6)
O método colorimétrico utilizando reativo de Benedict geralmente é usado para detectar a presença de açúcares redutores. O teste é essencialmente qualitativo.(7)
Procedimento: para a realização do exame é necessário que as fezes sejam recentes (estar no laboratório para análise, no máximo, dentro de 1 hora).
Em um tubo de ensaio colocar:
Reativo de Benedict ………………………………….2mL
Fezes diluídas …………………………………………. 5 gotas.
Misturar e levar ao bico de Bunsen até ebulição.
Resultado e interpretação: a mudança da cor azul do reativo para vermelho-tijolo significa reação positiva. Podem ocorrer variações colorimétricas de acordo com os intervalos de concentração de açúcares, variando de um azul intenso, passando por tons de verde, amarelo e posteriormente para vermelho-tijolo.
Leitura de (+), (++), (+++), (++++), conforme a intensidade de cor indicando a quantidade de açúcares redutores na amostra fecal.
É possível encontrar resultados falsos em material fecal não recente devido à fermentação dos açúcares pelas bactérias intestinais.
Valor de referência: Não reagente.
Pesquisa de pigmentos biliares
As fezes apresentam a cor castanho-parda resultante da presença de estercobilina, que é o pigmento biliar normal. Verifica-se a presença de pigmentos biliares pela reação do sublimado.(1,2)
Procedimento: Em um tubo de ensaio colocar:
Fezes diluídas ……………………………………………………. 5mL
Solução aquosa saturada de bicloreto de mercúrio……5mL
(33g de bicloreto de mercúrio/500ml de água)(2)
Agitar e deixar em repouso entre 5 minutos e 24 horas para a leitura.
Resultado e interpretação: cor vermelho-tijolo do líquido e do sedimento indica presença de estercobilina ou estercobilinogênio; cor verde indica presença de bilirrubina; sem coloração: ausência de pigmentos biliares.
Correlação clínica: a ausência de estercobilina pode ser indicativo de obstrução biliar.(1,4)
Pesquisa de albumina nas fezes
A reação do sublimado também é utilizada para a pesquisa de albumina nas fezes, empregando-se o mesmo reativo e o mesmo procedimento para pigmentos biliares descrito anteriormente.(1,2)
Procedimento: Em um tubo de ensaio colocar:
Fezes diluídas ……………………………………………………. 5mL
Solução aquosa saturada de bicloreto de mercúrio……5mL
(33g de bicloreto de mercúrio/500mL de água)(2)
Agitar e deixar em repouso entre 5 minutos e 24 horas para a leitura.
Resultado: reação negativa: sedimentação dos resíduos fecais com sobrenadante turvo e sem grumos; reação positiva: colagem das proteínas (floculação) com o líquido sobrenadante límpido.
Valor de referência: Ausência
Correlação clínica: diagnóstico de lesão da mucosa intestinal e colite ulcerosa.(1)
Exame microscópico
Pesquisa de leucócitos nas fezes
Este exame deve ser realizado em fezes frescas e recentes, e enviadas imediatamente ao laboratório ou em até 2 horas após a coleta.(2,4)
O exame microscópico direto a fresco ou após coloração pelo Lugol é empregado para a pesquisa de leucócitos (Figura 2). A utilização do corante azul de metileno facilita visualizar mais facilmente os leucócitos polimorfonucleares.(2,4)
Procedimento:
Exame direto a fresco e após coloração: em uma lâmina limpa e seca colocar uma gota de fezes diluídas ou uma porção de fezes de vários pontos da amostra fecal, dando preferência se tiver muco misturado nas fezes; cobrir com uma lamínula 22mm x 22mm e observar ao microscópio com aumento de 400x.
Na preparação com Lugol, coloca-se uma gota de Lugol e mistura-se na porção de fezes na lâmina, e procede-se como anteriormente.
Na preparação com azul de metileno deve-se misturar a porção de fezes com o corante e proceder como anteriormente descrito.
Resultado: positivo, na presença de leucócitos ou piócitos (quando degenerados) que devem ser quantificados em raros, poucos, muitos ou numerosos; negativo, na ausência de leucócitos na amostra fecal.
Observação: Para a pesquisa de neutrófilos e eosinófilos fazer um esfregaço fino das fezes diluídas em lâmina, corar com corantes hematológicos e examinar ao microscópio com aumento de 1000x.
Interpretação: o exame de pesquisa de leucócitos nas fezes visa verificar a presença e a quantidade de leucócitos no trato intestinal, o que pode indicar um processo inflamatório ou infeccioso. Nos processos inflamatórios infecciosos intensos os leucócitos se encontram em grande quantidade e aglutinados.(2,4)
Valor de referência: Ausentes.
Correlação clínica: a grande quantidade de leucócitos pode ser causa de retocolite ulcerativa, infecção bacteriana, câncer, tuberculose ou amebíase.(2,4)
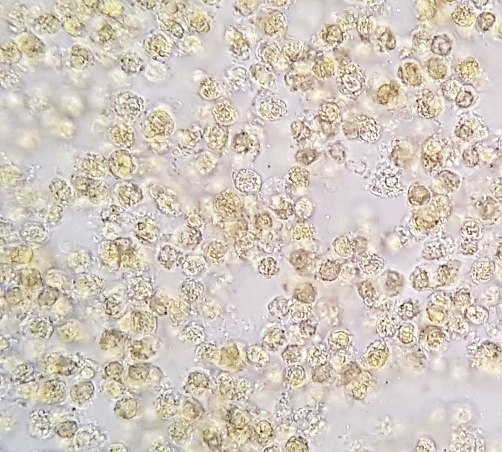
Figura 2
Leucócitos no sedimento fecal corado pelo Lugol. Aumento de 400x.
Fonte: Cortesia de Lenilza Mattos Lima.
Resíduos alimentares e elementos de origem intestinal
Vários elementos podem ser encontrados nas fezes, sendo resíduos alimentares de origem animal e vegetal, e elementos de origem intestinal. Assim, as fezes podem conter resíduos de alimentos digeridos e não digeridos, em sua maioria de origem vegetal como o amido e a celulose; podem conter células epiteliais e microrganismos como leveduras e bactérias.(1,2,8)
Após a diluição das fezes, faz-se uma preparação em lâmina a fresco e outra com Lugol, cobre-se com lamínula 22mm x 22mm, examinando ao microscópio com aumento de 100x e 400x.(1,2) Interessante analisar o sedimento fecal da diluição em repouso por cerca de 30 minutos.
Resultado: para reporte qualitativo, deve ser mencionado no laudo como ausência e presença do elemento; para reportes quantitativos, as estruturas visualizadas ao microscópio devem ser quantificadas como raras, poucas, muitas ou numerosas.
Resíduos alimentares de origem animal
Fibras musculares
Ao exame microscópico do sedimento fecal é possível encontrar fibras musculares bem digeridas e maldigeridas, geralmente coradas de amarelo ou alaranjado pela bile. As fibras musculares bem digeridas aparecem ovaladas, circulares, em forma de arestas arredondadas, sem estrias e sem ângulos (Figura 3). As fibras maldigeridas são retangulares ou como cilindros alongados, com estrias longitudinais ou transversais nítidas (Figura 3).
Interpretação: na digestão normal podem ser encontradas fibras musculares bem digeridas, enquanto a presença de fibras musculares maldigeridas em grande quantidade indicam trânsito intestinal acelerado ou insuficiência pancreática.(1,2)
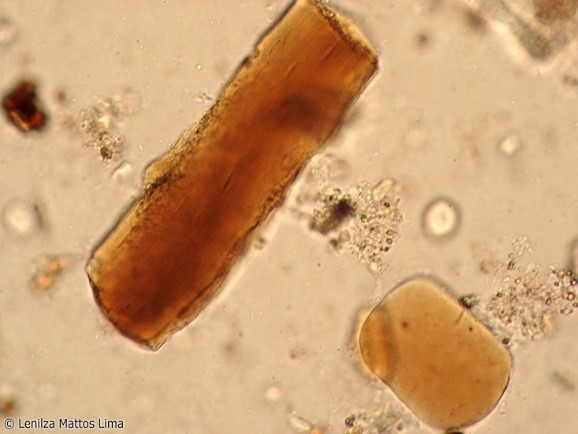
Figura 3
Fibras musculares no sedimento fecal corado pelo Lugol: bem digerida (ângulo arredondado) e maldigerida (retangular e estriada).
Fonte: https://parasitologiaclinica.ufsc.br/
Resíduos alimentares de origem vegetal
Celulose digestível
A celulose digestível constitui o arcabouço das células de feculentos. Ao exame microscópico aparecem isoladas ou em grupos, ovais, arredondadas ou poliédricas, com contorno nítido e septadas no seu interior. Tem coloração castanha, e pode conter grânulos de amido (amido incluso). Esta celulose tem valor semiológico (Figura 4 A-B).
Interpretação: em fezes normais o aparecimento é em quantidade insignificante, enquanto a presença em grande quantidade pode indicar trânsito intestinal acelerado.(2,4)
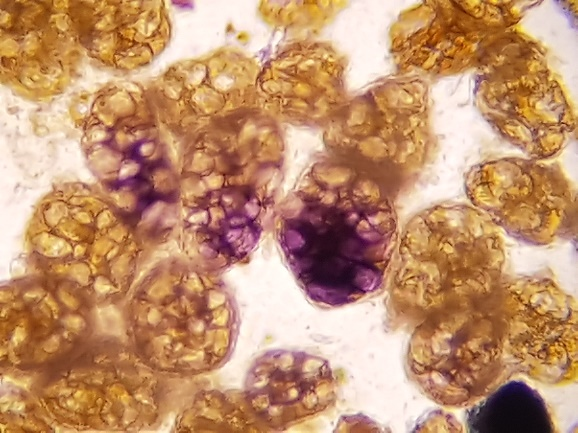
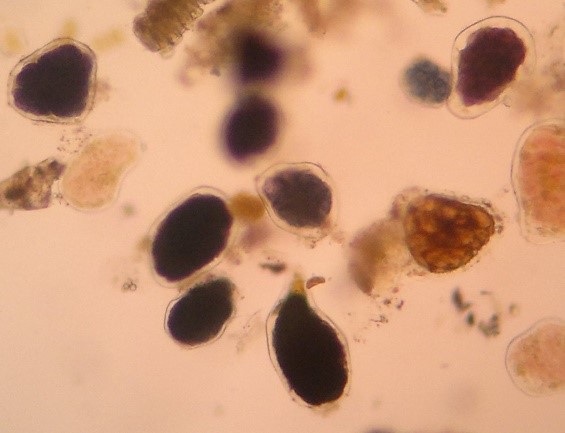
Figura 4 A e B
Celulose digestível sem amido e com amido incluso, no sedimento fecal corado pelo Lugol. Aumento de 400x.
Fonte: Cortesia de Lenilza Mattos Lima.
Celulose não digestível
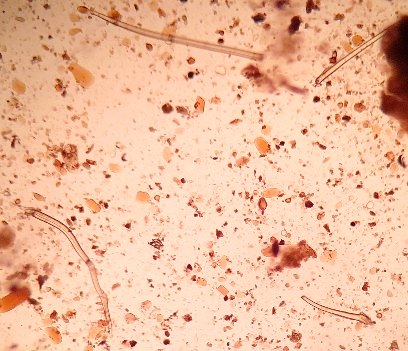
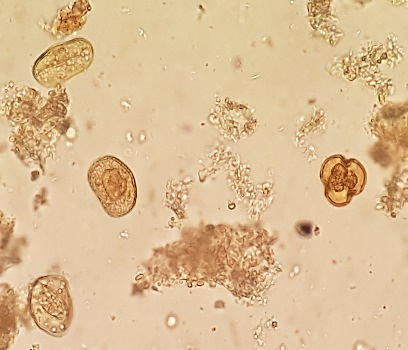
A celulose não digestível é constituída pelas fibras vegetais, cutícula dos cereais, vasos e pelos vegetais, anel de celulose, células em paliçadas, grãos de pólen com variações na sua forma e tamanho, esporos, estômato e outras estruturas vegetais, sem valor semiológico.(2.8) A Figura 5 (A,B,C,D,E) mostra celulose não digestível no material fecal.
 |
 |
 |
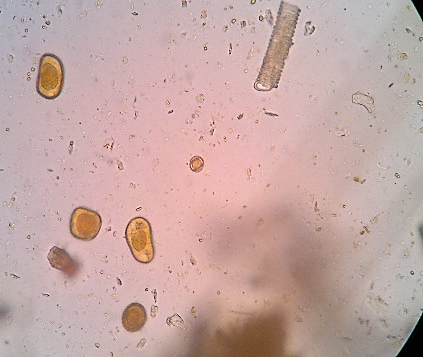 |
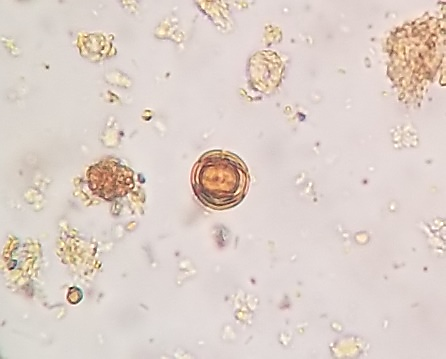
Figura 5A, B, C, D e E
Celulose não digestível no sedimento fecal corado pelo Lugol.
Em A e B: pelos vegetais (400x,100x); em C e D: grãos de pólen (400x,100x); em D observa-se ao alto um vaso vegetal espiralado; em E: grão de pólen (400x). Fonte: Cortesia de Lenilza Mattos Lima.
Amido
O amido é encontrado em alimentos como batatas, arroz, trigo, mandioca, milho, aveia e frutas, que fazem parte da alimentação humana. Ao exame microscópico de preparações fecais em lâmina observa-se o amido em formas diferentes: amido intracelular ou incluso, amido cru e amido amorfo. O amido intracelular apresenta-se dentro das células dos feculentos, com formato de pequenos grãos esbranquiçados, ovais ou redondos (Figura 4 A-B). O amido cru ou sem digerir está sob forma de grãos ovalados ou arredondados, organizados por camadas concêntricas na sua maioria (Figura 6). O amido amorfo apresenta-se em geral em faixas isoladas ou irregulares, podendo estar tapetadas com bactérias iodófilas, e a identificação se faz com Lugol. Nas preparações coradas com Lugol, o amido se cora em negro ou rósea ou azul intenso.(1,2,4)
Interpretação: a grande quantidade de amido nas fezes, principalmente amido não digerido, pode indicar trânsito intestinal acelerado, excesso de ingesta de feculentos, mastigação deficiente e fermentação intestinal hidrocarbonada.(1,2)

Figura 6
Grãos de amido no sedimento fecal corado pelo Lugol. Aumento de 400x.
Fonte: Cortesia de Lenilza Mattos Lima.
Flora iodófila
Normalmente encontrada ao nível do ceco e cólon direito, constituindo-se de bactérias que contêm amido, e nas preparações fecais em lâmina coradas pelo Lugol adquirem coloração violeta, azul ou preto (Figura 7 A-B).
Interpretação: no trânsito intestinal acelerado ou na fermentação intestinal a flora iodófila aparece em grande quantidade.(1,4)
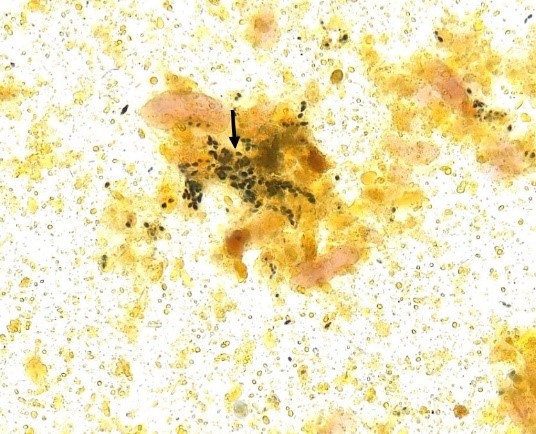
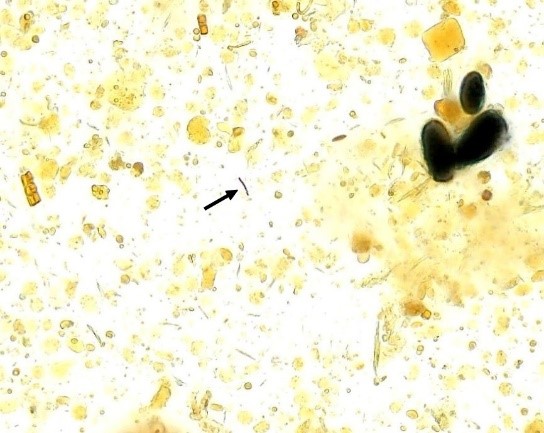
Figura 7 A e B
Flora iodófila no sedimento fecal corado pelo Lugol. Aumento de 400x.
Fonte: https://controllab.com/ensino/atlas/coprologia-funcional-ii/
Elementos de origem intestinal
As substâncias de origem intestinal mais comuns são: hemácias, leucócitos e células epiteliais. As hemácias são observadas com sua cor, forma e tamanhos conhecidos, isoladas ou aglutinadas.(2) A presença de leucócitos no trato intestinal está descrita acima em “pesquisa de leucócitos nas fezes”. As células epiteliais não são encontradas em fezes normais, apenas se o trânsito intestinal estiver acelerado.(2)
Outros elementos
Outros elementos, como fungos e cristais, descritos a seguir, também podem ser encontrados nas fezes.
Fungos nas fezes
As leveduras e outros elementos fúngicos são comuns nas fezes. Os fungos nas fezes podem ser veiculados pelos alimentos e, em geral, não determinando sintomas ou sinais de natureza digestiva. São reconhecidos pela forma oval ou esférica, pela coloração castanha e alguns pela presença de micélio gemulante. As leveduras podem produzir pseudo-hifas. A presença de leveduras do gênero Candida nas fezes pode indicar candidíase intestinal.(2) As Figuras 8 e 9 mostram presença de fungos nas fezes.
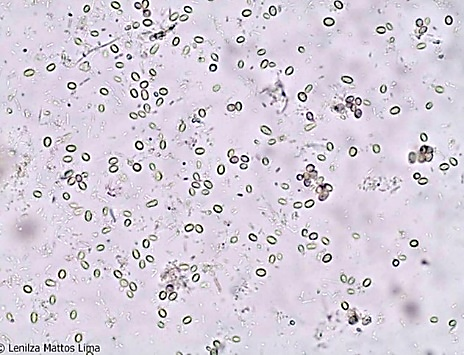
Figura 8
Fungos no sedimento fecal. Aumento de 400x.
Fonte: https://parasitologiaclinica.ufsc.br/

Figura 9
Fungos no sedimento fecal corado pelo Lugol. Aumento de 400x.
Fonte: Cortesia de Leticia Porto Coelho.
Cristais nas fezes
Vários cristais podem aparecer nas fezes,(2,4) porém os de maior interesse nas funções digestivas são:
- a) Cristais de oxalato de cálcio: aparecem sob a forma de envelope. Interpretação: eles surgem após a ingestão de tomate, feijão, vagem e outros vegetais. São dissolvidos pelo ácido clorídrico do estômago, e quando aparecem em grande quantidade nas fezes pode indicar insuficiência gástrica.
- b) Cristais de fosfato-amoníaco-magnesiano: apresentam a forma de tampa de ataúde e em diferentes tamanhos. Interpretação: surgem em fezes alcalinas com dispepsias putrefativas. Também podem surgir durante a coleta das fezes, contaminando com urina.
- c) Cristais de ácidos graxos: aparecem sob a forma de finas agulhas longas e entrecruzadas, formando feixes.
- d) Cristais de Charcot-Leyden: apresentam a forma de losangos maiores ou menores, alongados e de extremidades pontiagudas (Figura 10), e são derivados de eosinófilos.
Interpretação: têm relação com infecções parasitárias, alergias e ulcerações. Os cristais de Charcot-Leyden são observados quando há infiltrado inflamatório, com predomínio de eosinófilos.
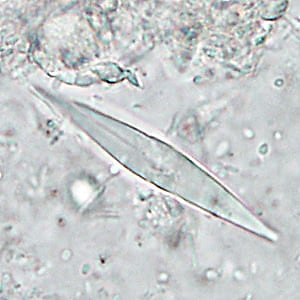
Figura 10: Cristal de Charcot-Leyden.
Fonte: https://www.cdc.gov/dpdx/artifacts/index.html
Exame bacterioscópico
Para verificar as bactérias Gram-positivas e Gram-negativas em esfregaço fecal corado pelo Gram. Pode-se observar a presença de outros elementos (células, leveduras e leucócitos).(4)
Gorduras nas fezes
A digestão da gordura ocorre normalmente no intestino delgado, realizada pela ação de enzimas pancreáticas, como a lipase. As fezes normais podem conter pequena quantidade de gorduras na forma de gorduras neutras, ácidos graxos e sabões. A presença de grandes quantidades de gorduras eliminadas nas fezes, definida como esteatorreia, pode indicar má absorção intestinal.(1,9,10)
Coloração pelo Sudan III
A pesquisa de gordura fecal é realizada pelo exame microscópico com corante Sudan III (solução a 1% em álcool a 70%). Trata-se de um teste de triagem qualitativo e de fácil execução, com boa correlação com a dosagem de gordura fecal (descrita a seguir) na investigação da esteatorreia.(1-3) O teste Sudan III foi relatado como tendo sensibilidade de 77% e especificidade de 98%.(3)
O paciente deve coletar as fezes sem uso de laxante e/ou supositório, não deve usar pomada na região anal, óleo de rícino, vaselina líquida e óleo mineral, os quais podem simular gorduras neutras.
Procedimento: em uma lâmina limpa e seca colocar uma a duas gotas de fezes diluídas, adicionar uma a duas gotas da solução de Sudan III, cobrir com uma lamínula 22mm x 22mm e observar ao microscópio com aumento de 400x.
Resultado e interpretação: as gorduras neutras aparecem como gotas ou gotículas ou glóbulos, ou sob a forma de lagos corados em vermelho. A visualização de 60 ou mais gotas de gorduras neutras, por campo, coradas em vermelho, sinaliza esteatorreia.(2)
Leitura: a observação de 10 a 20 glóbulos com um diâmetro de 10μm ou mais é considerada (+), 20 a 100 glóbulos com um diâmetro de 10 a 50μm é considerada (++), e mais de 100 glóbulos de gordura com grandes diâmetros são considerados (+++).(3)
Valor de referência: Ausência/raras
Correlação clínica: o diagnóstico de esteatorreia pode indicar insuficiência pancreática (ausência de lipase), fibrose cística, e parasitoses, como a giardíase e criptosporidíase.
Esteatócrito (Micrométodo de Phuapradit)
O esteatócrito foi desenvolvido por Phuapradit e colaboradores (1981)(11) para avaliar a concentração de gordura nas fezes de crianças. É um método semiquantitativo baseado em microcentrifugação, de fácil realização e baixo custo, e que apresenta boa correlação com o balanço de gordura na avaliação da esteatorreia.(11,12) Tem sensibilidade, especificidade e valor preditivo positivo de 100%, 95% e 90% respectivamente. (13) O procedimento descrito a seguir por Mello e Silveira(12) se baseou no método original de Phuapradit e colaboradores.(11)
O paciente deve colher as fezes sem uso de laxante.
Procedimento: a) com um bastão de vidro homogeneizar as fezes para que haja uma distribuição uniforme do bolo fecal; b) separar uma alíquota de fezes com uma medida padrão (cerca de 05g); c) misturar esta pequena quantidade de fezes com 0,06g de areia fina, com auxílio de um gral; d) adicionar água destilada (4 volumes da medida padrão) para diluir as fezes, misturando-se novamente com o auxílio do gral, e homogeneizar durante 1 minuto com um agitador vortex; e) aspirar esta mistura de fezes homogeneizada para um tubo capilar de micro-hematócrito sem heparina; f) centrifugar por 15 minutos em uma centrífuga de micro-hematócrito a 12.000 rotações por minuto. Após a centrifugação, o capilar é imediatamente colocado na posição vertical, havendo a formação de três camadas: uma camada sólida inferior (areia e resíduos sólidos); uma camada líquida intermediária (água e substâncias solúveis); uma camada superior que constitui a gordura nas fezes.
Com uma régua milimetrada com precisão de 0,025cm e com o auxílio de lupa, é feita a leitura medindo a camada sólida (S) e a camada de gordura (G).
Resultado: é expresso em porcentagem pela fórmula % esteatócrito=G/(G+S) x100
Valor de referência: criança na 1ª semana de vida: até 25%; da 1a à 4a semana: até 13%; de 1 a 3 meses: até 7%; acima de 3 meses: até 2%; adultos: até 2%.(12)
Correlação clínica: diagnóstico de má absorção de gorduras em crianças e adultos, insuficiência pancreática e fibrose cística.
Outros exames adicionais
Entre os exames adicionais citam-se: pesquisa de sangue oculto nas fezes, dosagem de gordura fecal, determinação da calprotectina fecal e dosagem de alfa-1 antitripsina nas fezes.
Pesquisa de sangue oculto nas fezes
O sangramento do trato gastrointestinal pode não ser percebido clinicamente, e o exame de sangue oculto nas fezes possibilita auxiliar o médico no diagnóstico de diferentes condições clínicas, pois consegue detectar a presença de pequenas quantidades de sangue na amostra fecal.(14,15)
Vários são os métodos descritos na literatura, os quais têm como fundamento a detecção de hemoglobina nas fezes, e baseados nos efeitos catalíticos do grupo heme, com atividade da peroxidase do sangue. Entre eles citam-se reação da benzidina, reação de Meyer-Johannessen e reação do guáiaco. (1,2) São técnicas colorimétricas que determinam que o paciente faça uma dieta de 3 a 4 dias antes da realização do método. O paciente não pode ingerir carnes, vegetais clorofilados (espinafre, alface, brócolis, rabanete, nabo, beterraba etc.), banana, melão, pera, maçã, medicamentos à base de ferro, corticoides e aspirina.(1,15)
O método imunocromatográfico é específico para a detecção de hemoglobina humana nas fezes. Este método utiliza uma combinação de anticorpo monoclonal marcado ou anticorpo policlonal anti-hemoglobina humana. Não há interferência do resultado com a presença de hemoglobina de outros animais, e não há necessidade do uso de dieta específica para a realização do exame. (14,15) A técnica é realizada de acordo com as descrições das bulas dos kits.(14)
O método imunocromatográfico para a pesquisa de sangue oculto, portanto, pode ser realizado quando da solicitação do coprológico funcional.
Correlação clínica: o exame de sangue oculto é utilizado no rastreamento do câncer colorretal e de outras lesões do trato gastrointestinal como úlceras, diverticulites e varizes esofágicas.(14,15)
Dosagem de gordura fecal
A dosagem e quantificação de gordura fecal para o diagnóstico com suspeita de má absorção intestinal tem sido uma coleta de fezes de 72 horas, e processadas pelo método de titulação de Van de Kamer.(2) A excreção fecal acima de 7g/d de gordura permite estabelecer o diagnóstico de esteatorreia. É necessário que o paciente faça uma dieta balanceada de 100g de gordura por dia, coletando-se as fezes de 3 dias.(1-3)
Correlação clínica: a dosagem ou balanço de gordura nas fezes é útil na investigação das síndromes de má absorção de origem pancreática, fibrose cística, doença celíaca e doença de Crohn.(2)
Determinação de calprotectina em amostras de fezes
A calprotectina é uma proteína encontrada no citosol de neutrófilos e macrófagos, e composta de duas subunidades, S100A8 e S100A9. É estável nas fezes por até 7 dias em temperatura ambiente e tem uma distribuição homogênea na amostra fecal. A calprotectina é classificada como uma proteína de padrão molecular associada a danos com propriedades de proteção antimicrobiana. A liberação extracelular de calprotectina durante o período de estresse/dano celular a torna um marcador preciso de inflamação intestinal.(3,16)
Em laboratórios clínicos a técnica de ensaio imunoenzimático (ELISA) é utilizada para medir a concentração de calprotectina fecal. Vários kits de ELISA estão disponíveis no mercado.(16,17) Os testes imunocromatográficos também foram desenvolvidos para o diagnóstico de calprotectina fecal.
Correlação clínica: a calprotectina fecal serve como um biomarcador de inflamação intestinal e útil no diagnóstico de doenças inflamatórias intestinais, avaliação da resposta à terapia médica e na previsão de recidiva clínica. Esta proteína fecal está elevada em pacientes com colite ulcerativa, doença de Crohn, fibrose cística e câncer colorretal.(3,16,17)
Dosagem de alfa-1 antitripsina nas fezes
A alfa-1 antitripsina é uma proteína plasmática resistente à degradação por enzimas digestivas. A dosagem de alfa-1 antitripsina nas fezes é um exame que analisa a perda de proteínas pelo trato digestivo. O método de imunodifusão radial tem sido empregado para medir a alfa-1 antitripsina fecal, assim como métodos imunoturbidimétricos.(18)
Correlação clínica: valores aumentados são encontrados nas doenças que causam perda de proteínas como a doença inflamatória intestinal, doença celíaca, intolerância ao leite de vaca, carcinoma gástrico, linfomas do tubo digestivo, doença de Whipple, gastroenteropatia alérgica, hipogamaglobulinemia congênita e síndrome de Menetrier.(18)
Fase pós-analítica
O laudo do exame coprológico funcional deve fornecer informações sobre o exame macroscópico das fezes e características físicas, exames químicos e análise microscópica. Além disso, é interessante que no laudo constem informações sobre a dieta recomendada pelo laboratório.
A seguir, um modelo proposto para o laudo.
| Coprológico Funcional | ||
| Exame Macroscópico
Caracteres físicos das fezes |
Resultado | Valor de referência |
| Consistência
Forma Cor Odor Viscosidade |
||
| Sangue
Muco Pus Restos alimentares |
||
| Exame Químico | ||
| pH
(Papel indicador universal) Substâncias redutoras (Reativo de Benedict) Estercobilina (Reação do sublimado) Bilirrubina (Reação do sublimado) Albumina (Reação do sublimado) Sangue oculto (Método imunocromatográfico) |
||
| Exame Microscópico | ||
| Leucócitos
Hemácias Células epiteliais Fibras musculares mal digeridas Fibras musculares bem digeridas Celulose digestível Celulose não digestível Amido cru Amido amorfo Amido incluso Fungos/leveduras Cristais Flora iodófila Parasitos Gorduras neutras (Coloração pelo Sudan III) Coloração pelo Gram |
||
Esteatócrito
(Micrométodo de Phuapradit)
CONSIDERAÇÕES FINAIS
Os exames coprológicos são realizados para avaliar o funcionamento do sistema gastrointestinal e o estado funcional de seus órgãos. Os resultados do exame coprológico funcional irão auxiliar o diagnóstico de síndromes de má absorção intestinal, doenças inflamatórias do intestino, distúrbios pancreáticos, doenças infeciosas e parasitárias. O exame também aponta patologias que cursam com sangramento no tubo digestivo. O diagnóstico precoce facilita o tratamento rápido e melhora o prognóstico da doença.
Alguns médicos solicitam o parasitológico de fezes e o coprológico funcional em conjunto. Ressalta-se, no entanto, que quando solicitado somente o coprológico funcional é importante ficar atento ao exame microscópico do sedimento fecal, pois a presença de parasitos pode ser observada e deve ser reportada nos resultados do exame.
REFERÊNCIAS
- Vallada EP. Manual de exames de fezes: coprologia e parasitologia. Rio de Janeiro: Atheneu;1998.
- Lima AO, Soares JB, Greco JB, Galizzi J, Cançado JR. Exame de fezes. In: Lima AO, Soares JB, Greco JB, Galizzi J, Cançado JR. Métodos de laboratório aplicados à clínica. 8ª ed. Rio de Janeiro: Guanabara Koogan; 2001. p.5.1- 5.49.
- Kasırga E. The importance of stool tests in diagnosis and follow-up of gastrointestinal disorders in children. Turk Pediatri Ars, 2019;54(3):141-8.
- Silveira Junior AO. O exame coprológico e as funções digestivas. São Paulo: Livraria Editora Santos;1988.
- Martinez AP, Azevedo GR. Tradução, adaptação cultural e validação da Bristol Stool Form Scale para a população brasileira. Rev. Latino-Am. Enfermagem, 2012; 20(3): [7 telas]. DOI:https://doi.org/10.1590/S0104-11692012000300021
- Carvalho LC, Silva SCM, Moraes JB, Pissolatto GG, Fernandes RB, Faria JP, et al. A intolerância a lactose e a alergia a proteína do leite de vaca (APLV): as principais considerações clínicas. Res Soc Dev, 2022;11(7):2-9. DOI:http://dx.doi.org/10.33448/rsd-v11i7.29651
- Universidade Federal da Paraíba. Laboratório Didático de Bioquímica. Teste de Benedict. 2017. Disponível em: http://plone.ufpb.br/ldb/contents/paginas/teste-de-benedict-1. Acesso em: 20 ago 2024.
- Carli GA. Artefatos confundíveis com os estágios de diagnóstico dos parasitos. In: Carli GA. Parasitologia Clínica: seleção de métodos e técnicas de laboratório para o diagnóstico das parasitoses humanas. 2a ed. Rio de Janeiro: Atheneu; 2011.p.139-151.
- Wikipedia. Esteatorreia. 2020. Disponível em: https://pt.wikipedia.org/wiki/Esteatorreia. Acesso em: 20 ago 2024.
- Campagnaro ED, Jáuregui, Aparicio A, Lobo D. Valores normales de la prueba sudan III en niños sanos menores de un año de edad. Arch Venez Puer Ped, 2012;75(1):16-19.
- Phuapradit P, Narang A, Mendonça P, Harris DA,Baum JD. The Steatocrit: a simple method for estimating stool fat content in newborn infants. Arch Dis Child, 1981;56:725-7. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1627297/. Acesso em: 20 ago 2024.
- Mello ED, Silveira TR. Esteatócrito: um método semiquantitativo de avaliação de gordura fecal-padronização do teste. J Pediatr, 1995;71(5):273-278.
- Kamath MG, Pai CG, Kamath A, Kurien A. Comparing acid steatocrit and faecal elastase estimations for use in M-ANNHEIM staging for pancreatitis. World J Gastroenterol, 2017;23(12):2217-2222.
- Kroth K, Caumo KS, Lima LM. Saúde dos idosos: pesquisa de sangue oculto nas fezes. RBAC, 2023;55(4):276-281
- Honório JC, Tizzot MRP. Análise dos métodos de pesquisa de sangue oculto nas fezes. Cadernos da Escola de Saúde. Curitiba, 2010;3:01-11.
- Smith LA, Gaya RD. Utility of faecal calprotectin analysis in adult inflammatory bowel disease. World J Gastroenterol, 2012;18(46):6782-6789.
- Badawy AM, Ali AAE, El Ghany AMA, El Halim EFA, Mohamed HI, Nouh MAE. Calprotectin as a fecal marker for diagnosis and follow-up in patients with ulcerative colitis. Menoufia Med J, 2014;27(1):35-43. Disponível em: https://www.menoufia-med-j.com/journal/vol27/iss1/6/. Acesso em: 27 ago 2024. DOI: https://doi.org/10.4103/1110-2098.132726
- Strygler B, Nicar MJ, Santangelo WC, Porter JL, Fordtran JS. α1-Antitrypsin excretion in stool in normal subjects and in patients with gastrointestinal disorders. Gastroenterol, 1990;99(5):1380-1387.
Correspondência
Lenilza Mattos Lima
E-mail: [email protected]
