Considerações importantes sobre o diagnóstico laboratorial da dengue
Important considerations about laboratory diagnosis of dengue fever
Dennis Armando Bertolini1, Luciana Dias Ghiraldi Lopes1, Léo Shigueki Sato2
1 Universidade Estadual de Maringá, Departamento de Análises Clínicas e Biomedicina. Maringá, PR, Brasil.
2 Universidade Estadual de Maringá, Programa de Pós-graduação em Ciências da Saúde. Maringá, PR, Brasil.
Recebido em 10/10/2024
Aprovado em 04/02/2025
DOI: 10.21877/2448-3877.202500202
INTRODUÇÃO
A dengue é uma arbovirose transmitida pela picada de mosquitos Aedes spp. A infecção é causada por um dos quatro sorotipos do vírus dengue (DENV1-4) e pode variar em sintomatologia e gravidade. O vírus da dengue pertence à família Flaviviridae, gênero Orthoflavivirus e espécie Orthoflavivirus denguei.(1) A doença é hiperendêmica em regiões tropicais e subtropicais em todo o mundo, e estima-se que cerca 60% da população mundial estará em risco até o ano de 2080 em áreas de adequação ambiental à sobrevivência do mosquito vetor.(2,3)
A incidência global da dengue aumentou acentuadamente nas últimas duas décadas, representando um desafio substancial para a saúde pública. Na região das Américas, da Semana Epidemiológica (SE) 1 a SE 50 de 2024, foram notificados 12.902.122 casos suspeitos de dengue, representando um aumento de 166% em relação ao mesmo período de 2023 e um aumento de 326% em relação à média dos últimos cinco anos.(4) Além dos números alarmantes, todos os quatro sorotipos do vírus da dengue estão circulando na região das Américas até a SE 50 de 2024.(4)
Vários fatores estão associados ao risco crescente de propagação da epidemia de dengue, incluindo a expansão do alcance dos vetores primários (principalmente Aedes aegypti e Aedes albopictus) em países nos quais não havia circulação viral do DENV; as consequências dos fenômenos El Niño em 2023 e alterações climáticas que levam ao aumento das temperaturas, aumento da pluviosidade, umidade, entre outros; além de fatores que desafiam a rápida resposta a epidemias, como sistemas de saúde frágeis no meio da pandemia de COVID-19, atrasos de notificação, dificuldades de identificação de sintomas que podem contribuir para casos graves, instabilidades políticas e financeiras em países que enfrentam crises humanitárias complexas e grandes movimentos populacionais de urbanização.(5)
A incidência exata da dengue é difícil de determinar, mas sabe-se que dos 7,6 milhões de casos de dengue foram relatados à Organização Mundial de Saúde (OMS) em 2024, mais de sete milhões foram na região das Américas. Todas as faixas etárias são igualmente suscetíveis à doença, porém idosos e pacientes com doenças crônicas, como diabetes e hipertensão arterial, têm maior risco de evoluir para casos graves e outras complicações que podem levar à morte.(6)Atualmente, a classificação da dengue é baseada na revisão realizada pela OMS que determina que os casos sejam reportados como: dengue sem sinais de alerta, dengue com sinais de alerta (dor abdominal, vômito persistente, acúmulo de fluidos, sangramento da mucosa, letargia, aumento do fígado, aumento do hematócrito com diminuição das plaquetas) e dengue grave (dengue com extravasamento grave de plasma, sangramento grave ou falência de órgãos).(7)
No contexto do atendimento primário do paciente, a maioria dos casos de dengue é diagnosticada com base apenas em sinais e sintomas, criando incerteza substancial devido às definições de casos não específicos e não uniformes.(8) O diagnóstico clínico é de extrema importância porque a suspeita adequada e precoce é determinante para a evolução favorável do paciente. No entanto, o diagnóstico laboratorial da dengue confirma o quadro clínico, colabora para orientar o tratamento de suporte especialmente em casos atípicos, exclui outras arboviroses e também a necessidade de outras investigações.(9) O diagnóstico laboratorial é essencial para identificar o sorotipo do vírus da dengue que está infectando o paciente, especialmente devido ao risco aumentado de evolução para dengue grave em casos de uma segunda exposição ao vírus por um sorotipo diferente.
Dessa forma, diante da crescente expansão da dengue, da prevalência e adaptação do mosquito vetor em locais com clima adequado, e dos sintomas iniciais inespecíficos, esse artigo tem por objetivo discutir aspectos relacionados ao diagnóstico clínico e laboratorial desta arbovirose, focando na escolha da melhor opção diagnóstica levando-se em consideração a coleta oportuna da amostra biológica, estrutura física do laboratório e situação epidemiológica da dengue na localidade de inserção laboratorial.
DESENVOLVIMENTO
Diagnóstico clínico
A dengue é uma doença febril aguda, sistêmica e dinâmica, que pode apresentar amplo espectro clínico, podendo parte dos pacientes evoluir para formas graves, e inclusive levar a óbito.
Anteriormente, a dengue era classificada como febre da dengue (DF), febre hemorrágica da dengue (FHD) e síndrome do choque da dengue (SCD).(10) Com o objetivo de aprimorar a assistência ao paciente com dengue, o Brasil adotou em 2014 a atual classificação de casos revisada pela OMS, que simplifica a abordagem inicial em: dengue com ou sem sinais de alerta e dengue grave.(7) Essa conduta, além de ser mais simples de ser aplicada, auxilia nas decisões médicas acerca de onde tratar o paciente e de como dimensionar o tratamento.
Nessa perspectiva, o olhar clínico para reconhecimento dos sinais de alarme da dengue é de extrema importância, pois no momento da triagem é possível realizar um monitoramento minucioso da evolução clínica e se antecipar nos casos em que a hospitalização se faz necessária. Sinais como o extravasamento de plasma e/ou hemorragias podem levar o paciente ao choque grave e ao óbito, portanto a identificação oportuna e precoce auxilia na prevenção de evolução grave.(6)
A infecção pelo vírus dengue (DENV) pode ser assintomática ou sintomática. Quando sintomática, causa uma doença de amplo espectro clínico, variando desde formas oligossintomáticas até quadros graves, podendo evoluir para o óbito. Pode apresentar três fases clínicas: febril, crítica e de recuperação.(6)
A primeira manifestação é a febre, que tem duração de 2 a 7 dias, geralmente alta (39ºC a 40ºC). É de início abrupto, associada à cefaleia, adinamia, mialgias, artralgias e à dor retro-orbitária. Anorexia, náuseas e vômitos podem estar presentes, assim como a diarreia que cursa de três a quatro evacuações por dia com fezes pastosas, o que facilita o diagnóstico diferencial com gastroenterites por outras causas. Após a fase febril, grande parte dos pacientes se recupera progressivamente, com melhora do estado geral e retorno do apetite.(9)
O exantema ocorre aproximadamente em 50% dos casos, é predominantemente do tipo maculopapular, atingindo face, tronco e membros de forma aditiva, incluindo plantas de pés e palmas de mãos. Pode se apresentar sob outras formas com ou sem prurido, frequentemente no desaparecimento da febre.(9)
A fase crítica tem início com a defervescência (declínio) da febre entre três e sete dias do início da doença. Essa fase pode estar presente em alguns pacientes, e pode ser um início de evolução para as formas graves. Por essa razão, medidas diferenciadas de manejo clínico e observação devem ser adotadas imediatamente. Os sinais de alarme, quando presentes, surgem nessa fase da doença e podem ser detectados pelo aumento do hematócrito.(9) Esses sinais são caracterizados como dor abdominal, vômitos persistentes, acúmulo de líquidos em cavidades (ascite, derrames pleural e pericárdico), hipotensão postural, letargia e irritabilidade, seguidos de sinais de sangramentos de mucosa e aumento progressivo do hematócrito. A maioria dos sinais de alarme resulta do aumento da permeabilidade vascular, que marca o início da deterioração clínica do paciente e sua possível evolução para o choque por extravasamento plasmático.(9)
As formas graves da doença podem se manifestar como choque ou acúmulo de líquidos com desconforto respiratório, em função do severo extravasamento plasmático.(9)
O diagnóstico clínico da dengue, muitas vezes, é considerado desafiador, especialmente em localidades com baixo número de casos ou com prevalência de outras doenças que causem sintomas iniciais inespecíficos e que possam imitar o espectro da doença decorrente da infecção por DENV. O diagnóstico correto é imprescindível, especialmente em evoluções graves devido a diferentes abordagens de tratamento para choque induzido por dengue e choque decorrente de sepse, por exemplo. Nesse contexto, o diagnóstico laboratorial é uma ferramenta que completa a percepção clínica e corrobora para decisão de conduta ao paciente.
Diagnóstico laboratorial
O diagnóstico preciso e eficiente da dengue é útil para o controle eficaz de surtos,(11) para estudos epidemiológicos e para o gerenciamento clínico e a avaliação de pacientes individuais, particularmente se novos e específicos agentes terapêuticos forem descobertos. Além disso, os testes disponíveis devem ser capazes de detectar todos os estágios da doença dengue, desde infecções assintomáticas, síndromes semelhantes à influenza e doença grave, incluindo FHD/SCD.(12) O diagnóstico precoce seguido por cuidados de suporte e tratamento sintomático por meio de reposição de fluidos são as chaves para a sobrevivência em casos de infecção grave por dengue.(13)
O diagnóstico laboratorial é o responsável por identificar o agente etiológico que está causando determinada sintomatologia. Na maioria dos países onde o DENV é endêmico, normalmente também há a cocirculação de outros arborvírus, como por exemplo, vírus da encefalite japonesa (JEV) no Sudeste Asiático, vírus da encefalite de Saint-Louis (SLEV), vírus da febre amarela (YFV), Zika vírus e Chikungunya na América Latina, ou vírus do Nilo Ocidental (WNV) no Caribe.(14,15)
Laboratorialmente, podemos identificar a infecção pelo DENV seguindo duas principais direções: testes virológicos e testes sorológicos. Para isso, podemos utilizar métodos diretos e indiretos. Os métodos diretos podem ser representados pelo isolamento viral, detecção de ácido nucleico (RT-PCR) e detecção da proteína NS1. Já os métodos indiretos consistem na detecção dos anticorpos das classes IgM e IgG. Atualmente, a maior acessibilidade para o diagnóstico caminha no sentido dos métodos indiretos, por serem testes que não requerem estrutura laboratorial complexa. Já a maior confiabilidade se dá nos métodos diretos, que são testes que detectam o próprio vírus ou antígenos virais (Figura 1).
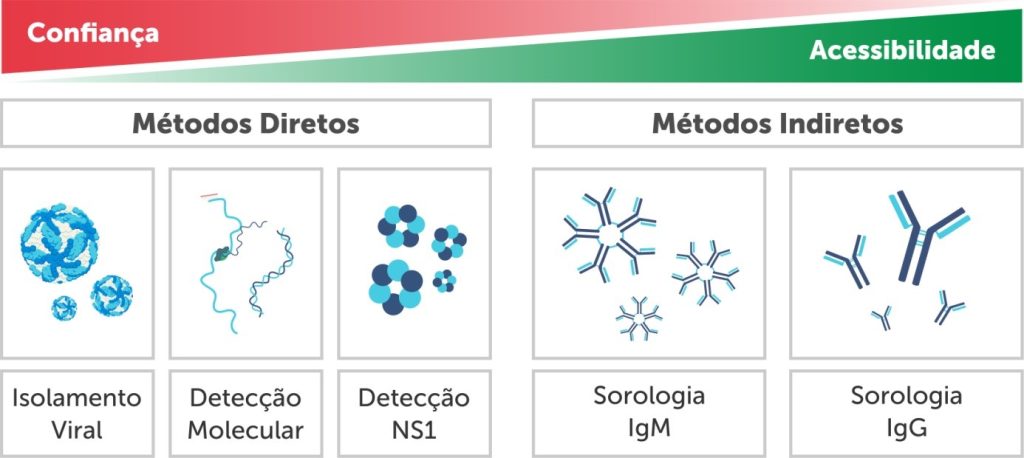
Figura 1
Comparação de testes diagnósticos para dengue de acordo com sua acessibilidade e confiança.
Fonte: Adaptado de WHO (2009)(7)
O diagnóstico virológico do DENV é feito sobretudo por meio de: isolamento do vírus por cultura de células(16) ou por técnicas moleculares como a reação em cadeia da polimerase com transcrição reversa (RT-PCR)(17,18) e a detecção de um antígeno viral, a proteína NS1 por meio de testes laboratoriais remotos ou ensaios imunoenzimáticos (ELISA).
A escolha do teste laboratorial correto para o diagnóstico da dengue está diretamente relacionada ao momento em que o paciente se encontra, ou seja, quantos dias se passaram após o início dos sintomas. A fase virêmica aguda da infecção por arbovírus é frequentemente perdida, não apenas em pacientes de regiões endêmicas onde a assistência médica é limitada ou não acessível, mas também em viajantes que retornam e migrantes que chegam, pois geralmente só visitam um médico quando os sintomas persistem ou pioram além do estágio febril. Nesse estágio da doença, apesar dos relatos de que o vírus persiste por períodos mais longos em santuários (ou seja, sistema nervoso central, articulações e trato urogenital), métodos diretos para a detecção do vírus no sangue podem apresentar resultados negativos ou inespecíficos quando o vírus da dengue já foi eliminado pelo sistema imunológico.(19,20)
Os métodos diretos (isolamento viral, RT-PCR e proteína NS1) devem ser realizados no início da doença, preferencialmente, até o quinto dia após o início dos sintomas (fase aguda), uma vez que é o período em que o vírus está presente no corpo do indivíduo (período de viremia). A presença da proteína NS1 pode ser detectada em um período de tempo um pouco maior, até o nono dia após o início dos sintomas, a depender da sensibilidade do teste utilizado. Em geral, a concentração da proteína NS1 no soro diminui ao longo da infecção e a sensibilidade de detecção é reduzida, podendo também ser menor em infecções secundárias e conforme os diferentes sorotipos do DENV. Embora a cinética temporal da proteína NS1 varie entre infecções primárias e secundárias, geralmente não é possível determinar se a infecção aguda do paciente é uma ou outra no momento da análise das amostras por esse marcador.(21-26)
Os métodos moleculares podem ser do tipo multiplex, como a PCR multiplex para dengue, Zika vírus e Chikungunya, sendo especialmente úteis em casos sem uma suspeita clínica bem definida. No entanto, quando um caso de dengue atende aos critérios diagnósticos estabelecidos e o quadro clínico é compatível, recomenda-se priorizar testes específicos (singleplex) para a detecção do vírus.(27) Esses testes demandam maior capacitação técnica e infraestrutura laboratorial adequada, o que pode limitar sua disponibilidade.
Os métodos indiretos são os testes que detectam anticorpos anti-DENV, e são feitos principalmente por meio de: ELISA, técnicas de inibição da hemaglutinação (HI)(28-30) e teste de neutralização por redução de placa (PRNT).(11,31) São testes que devem ser realizados após o sétimo dia do início dos sintomas, uma vez que é o período em que o nível de anticorpos já passa a ser seguramente detectado, sobretudo IgM (Figura 2). No entanto, diante da possibilidade de reação cruzada com outros flavivírus (Zika vírus, febre amarela etc.) e detecção inespecífica de IgM, recomenda-se o uso preferencial de técnica imunoenzimática de captura de IgM (MAC-ELISA).(4)
Os testes imunocromatográficos atualmente conseguem detectar a proteína NS1 e os anticorpos das classes IgM e IgG, utilizando plataformas duplas, os chamados testes “DUO”.(12) Na prática clínica laboratorial, os testes DUO e ELISA são os mais comumente utilizados, por serem de fácil execução, rápidos, de baixo custo e não exigirem equipamentos sofisticados e estrutura laboratorial complexa.
Numa infecção primária, o momento correto da coleta das amostras deve ser rigorosamente seguido em razão da ausência de sensibilização do sistema imune. Para RT-PCR e detecção de NS1, a amostra deve ser coletada preferencialmente até o quinto dia após o início dos sintomas. Para a detecção da IgM, a coleta de material biológico deverá ocorrer após o sétimo dia após o início dos sintomas (Figura 2).
Numa infecção secundária, como o sistema imune já tem memória imunológica contra o vírus da dengue, o período de detecção do RNA viral (RT-PCR) e NS1 será menor e a detecção da IgM e IgG será mais precoce, sendo a IgM numa concentração menor e a IgG numa concentração bem maior que na infecção primária devido a resposta anamnésica (Figura 2).
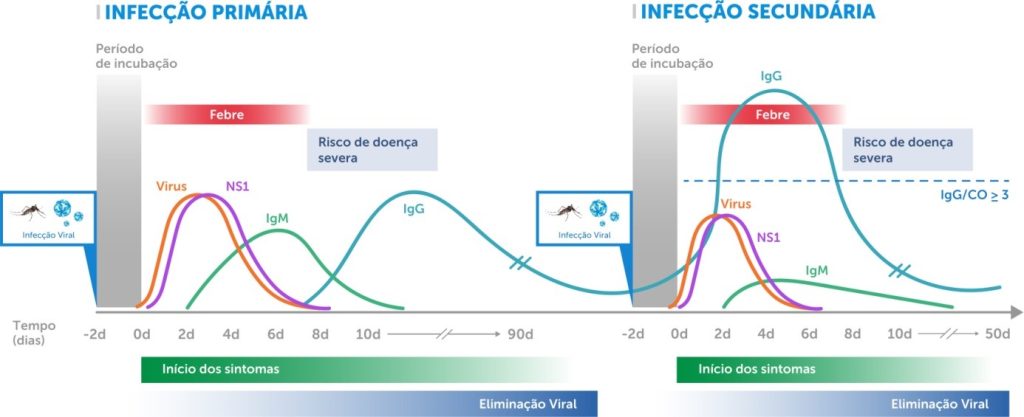
Figura 2
Cinética do vírus da dengue, proteína NS1 e anticorpos IgM e IgG em amostras de soro nas infecções primárias e secundárias.
Fonte. Adaptado de Kerkhof et al. (2020);(32) PAHO (2022)(27)
A detecção isolada de IgG em amostras únicas tem seu valor diagnóstico limitado, uma vez que os anticorpos IgG permanecem por um longo período. Quando se usa somente esse teste para confirmar a infecção, é necessário utilizar um teste quantitativo e coletar uma amostra de fase aguda e uma amostra de fase convalescente e detectar a soroconversão de IgG ou um aumento de quatro vezes ou mais nos títulos de IgG entre as duas amostras.(33) Além disso, a reatividade cruzada de anticorpos IgG entre vírus do mesmo gênero também limita a sua utilização isolada como diagnóstico. Atualmente, com a circulação crescente de outros arbovírus e de vírus com manifestações clínicas semelhantes, como o SARS-CoV-2, a interpretação de testes sorológicos pode se tornar desafiadora. Além disso, em áreas endêmicas, pacientes podem apresentar coinfecções, o que, em alguns casos, pode resultar em subdiagnóstico de dengue.
Foi previamente relatado que o teste ELISA de captura de IgG para DENV pode distinguir infecções primárias e secundárias pelo vírus com base em amostras da fase convalescente inicial.(34,35) Utilizando o ELISA de captura de IgM e IgG da Panbio em amostras coletadas até 8 dias após o início dos sintomas (PSO), Vaughn et al. (1999)(34) observaram que 100% das infecções primárias e 95% das infecções secundárias por DENV poderiam ser corretamente classificadas. A classificação foi baseada em valores de IgM/cut-off (CO) = 1 e IgG/CO < 3 para infecções primárias, e IgG/CO ≥ 3 para infecções secundárias (Figura 2). De forma semelhante, Vazquez et al.(35), ao testarem amostras coletadas até 5 a 7 dias após o início dos sintomas, relataram uma alta concordância (95,5%) entre os ELISAs de captura de IgM e IgG da Panbio e seu método de referência para a classificação entre infecções primárias e secundárias por DENV.(35) Estudos mais recentes indicam que anticorpos contra a proteína NS1 apresentam maior especificidade em comparação com aqueles direcionados à proteína do envelope, o que pode aprimorar a acurácia diagnóstica.(33,36,37) No entanto, como a detecção de NS1 ocorre principalmente por testes imunocromatográficos, a Organização Panamericana de Saúde (OPAS) recomenda seu uso restrito a estudos comunitários sob protocolos estabelecidos, uma vez que sua baixa sensibilidade pode resultar em falsos negativos. Para descartar a infecção ou direcionar condutas médicas apropriadas, é essencial a confirmação por metodologias mais sensíveis.(4)
Segundo a OPAS,(27) as limitações mais importantes dos métodos sorológicos são:
- Um resultado positivo de um teste para IgM em uma única amostra é apenas presuntivo de infecção aguda, uma vez que os anticorpos detectados podem ser provenientes de uma outra infecção recente não necessariamente pelo quadro agudo;
- No caso de doenças para as quais existe vacina (dengue e febre amarela), os anticorpos detectados também podem ser provenientes de vacinação recente;
- A persistência de anticorpos IgM ainda não foi completamente caracterizada para infecções por DENV, CHIKV, ZIKV e YFV, e alguns dados parecem indicar que estes anticorpos podem persistir por mais tempo do que se pensava inicialmente;(38-40)
- No caso dos anticorpos IgG, que persistem por mais tempo que os anticorpos IgM, a sua detecção em amostra única serve para uma interpretação provisória. Para a confirmação laboratorial da infecção aguda, é necessária a obtenção de amostras pareadas: uma da fase aguda e outra da fase de convalescença. A soroconversão de IgG (resultado negativo da amostra da fase aguda e resultado positivo da amostra de convalescença) ou um aumento nos títulos de anticorpos IgG ou neutralizantes entre as duas amostras confirmam a infecção aguda.
- A confirmação do agente etiológico é limitada pela reatividade cruzada dos testes sorológicos em infecções por vírus do mesmo gênero ou pela vacinação contra eles.
- A reatividade cruzada é mais comum em infecções secundárias do que em infecções primárias; portanto, em áreas onde vários flavivírus cocirculam – situação epidemiológica atual em grande parte das Américas – a probabilidade de reatividade cruzada é alta. A reatividade cruzada também foi observada entre diferentes alfavírus (Chikungunya vírus e Mayaro vírus), embora não tenha sido caracterizada tão amplamente como nos flavivírus.
Apesar dessas diversas limitações, a OPAS(27) também determina que os testes sorológicos devam fazer parte dos métodos diagnósticos de arboviroses por:
1) a utilização de métodos virológicos depende de amostras obtidas em tempo oportuno, pois o paciente pode se apresentar para diagnóstico quando a fase virêmica tiver passado;
2) os métodos virológicos nem sempre estão disponíveis, pois necessitam de área física e equipamentos específicos no laboratório;
3) os métodos sorológicos (particularmente os testes ELISA in house) têm menor custo e execução mais simples que os métodos virológicos e podem ser mais facilmente utilizados numa rede de laboratórios locais;
4) a combinação de métodos virológicos e sorológicos pode melhorar a sensibilidade e a especificidade do diagnóstico;(41,42) e
5) os métodos sorológicos são essenciais quando o vírus e seus componentes são encontrados com menor frequência em amostras biológicas, como no caso de recém-nascidos com síndrome congênita do Zika ou em pacientes com síndromes neurológicas associadas à infecção pelo ZIKV ou outros arbovírus.
A infecção inicial com qualquer um dos sorotipos de DENV fornece proteção incompleta contra todos os quatro sorotipos em razão de uma reatividade cruzada temporária entre eles. Após a neutralização da memória imunológica, a resposta protetora pode ser alcançada se o paciente for reinfectado com o mesmo sorotipo. É bem estabelecido que há uma forte associação entre infecções secundárias por um sorotipo diferente de DENV e dengue grave. Infecções subsequentes com diferentes sorotipos estão associadas a formas graves da doença e impõem complicações sérias, incluindo o risco de mortalidade.(43) A patogênese envolvida pode estar relacionada à intensificação dependente de anticorpos (ADE) e certos sorotipos como DENV-2, 3 e 4 parecem estar relacionados à maior gravidade em pacientes que já tiveram dengue anteriormente.(44) A identificação laboratorial do sorotipo causador da infecção promove informações que contribuem para uma melhor avaliação de risco pela equipe de saúde com manejo adequado do paciente em infeções subsequentes por sorotipos diferentes.(45)
Nesse contexto, os resultados laboratoriais de testes virológicos (detecção do RNA viral e identificação do sorotipo) e testes sorológicos (detecção de NS1, IgM e IgG) integram a vigilância e o gerenciamento de surtos de dengue. A ampliação de atividades de vigilância ativa e passiva de vetores, com gerenciamento geoespacial de casos de dengue com identificação precoce de regiões com alta transmissibilidade, pode ser realizada explorando de forma mais efetiva a infraestrutura acessória disponível em universidades e centros de referência, no formato de uma rede integrada ao Sistema Único de Saúde. Modernas técnicas de sequenciamento genômico de amostras também devem ser estimuladas, pois a comparação com sequências já existentes em bancos de dados pode ser útil para determinar mudanças epidemiológicas que levem a maior potencial de disseminação ou de gravidade.(46)
A disponibilização de vacinas contra a dengue marcou um novo contexto epidemiológico laboratorial. Em 2015, tivemos a aprovação pela Agência Nacional de Vigilância Sanitária (ANVISA) da vacina Dengvaxia (Sanofi-Aventis Farmacêutica Ltda.), que em 2017 passou por uma alteração na bula, sendo indicada somente para indivíduos que já tiveram dengue. Essa mudança ocorreu justamente pela possibilidade de agravamento quanto à memória imunológica de reatividade cruzada temporária mencionada anteriormente. Dessa forma, os profissionais de saúde foram requisitados em realizar uma avaliação mais minuciosa e, se for o caso, solicitar a realização de exames sorológicos para pacientes sem histórico confirmado de contato com os vírus da dengue. Em 2023, a ANVISA aprovou o registro de uma nova vacina para dengue, a Qdenga (Takeda), que foi disponibilizada no serviço público de saúde pelo Ministério da Saúde, em 2024, direcionada para crianças e adolescentes de 10 a 14 anos de idade. Novas vacinas estão em fase avançada de estudos, como, por exemplo, a vacina do Instituto Butantan, Brasil. O laboratório de análises clínicas, portanto, ao proceder um teste sorológico para dengue deverá estar atento às possibilidades de o paciente já ter tomado a vacina para dengue. Essa situação reforça a necessidade de acesso a metodologias que permitam diagnósticos diferenciais e complementares para distinguir infecções naturais de respostas vacinais e garantir a vigilância epidemiológica eficaz.
CONSIDERAÇÕES FINAIS
Embora a maioria das infecções por arbovírus sejam assintomáticas ou autolimitadas, o diagnóstico laboratorial da dengue desempenha papel crucial nesse contexto. Como a dengue é a arbovirose mais frequente, o diagnóstico preciso e o manejo correto são imprescindíveis diante do risco potencial de complicações como a febre hemorrágica do DENV. Portanto, a utilização de técnicas avançadas, como RT-PCR e de detecção viral da proteína NS1, como sorologia para IgM (captura de IgM) permite a agilidade e precisão no diagnóstico.
No entanto, alguns aspectos importantes precisam ser considerados para que a escolha da metodologia diagnóstica seja assertiva. O momento da coleta da amostra biológica levando-se em consideração o dia de início dos sintomas é o principal ponto crítico para a realização de um diagnóstico laboratorial seguro e preciso. Outros aspectos importantes são: situação epidemiológica da doença; se na região periodicamente ocorrem casos da dengue; a sazonalidade; a utilização de vacinas contra a dengue; a circulação de outros flavivírus na mesma região.
O desenvolvimento de conjuntos de diagnóstico mais sensíveis, específicos, rápidos e econômicos, juntamente com a fácil utilização em campo para regiões relativamente subdesenvolvidas do mundo, é de importância crescente.
A constante atualização dos profissionais com o acompanhamento das informações epidemiológicas publicadas pelos órgãos de saúde do seu país é importante para correlacionar aos resultados obtidos. A participação em eventos científicos, treinamentos e acompanhamento da literatura científica são fundamentais para a constante atualização sobre as metodologias diagnósticas que estão sendo utilizadas e outras que venham a surgir com melhor especificidade e sensibilidade diagnóstica.
REFERÊNCIAS
- Postler TS, Beer M, Blitvich BJ, Bukh J, de Lamballerie X, Drexler JF, et al. Renaming of the genus Flavivirus to Orthoflavivirus and extension of binomial species names within the family Flaviviridae. Arch Virol [Internet]. 2023 Sep 10; 168(9):224. Disponível em: https://doi.org/10.1007/s00705-023-05835-1
- Wong JM, Adams LE, Durbin AP, Muñoz-Jordán JL, Poehling KA, Sánchez-González LM, et al. Dengue: A Growing Problem With New Interventions. Pediatrics [Internet] 2022; 149(6):e2021055522. Disponível em: https://doi.org/10.1542/peds.2021-055522
- Messina JP, Brady OJ, Golding N, Kraemer MUG, Wint GRW, Ray SE, et al. The current and future global distribution and population at risk of dengue. Nat Microbiol [Internet] 2019; 4(9):1508-15. Disponível em: https://www.nature.com/articles/s41564-019-0476-8
- Pan American Health Organization. Situation Report No 50 – Dengue Epidemiological Situation in the Region of the Americas – Epidemiological Week 50, 2024 [Internet]. 2025 [Acesso 2025Jan3]; 1-3. Disponível em:https://www.paho.org/en/documents/situation-report-no-50-dengue-epidemiological-situation-region-americas-epidemiological
- WHO. Dengue – Global situation [Internet]. World Heal. Organ.2023 [Acesso 2024 Jun 17];(December 2023):1-16. Disponível em: https://www.who.int/emergencies/disease-outbreak-news/item/2023-DON498#:~:text=Since the beginning of 2023,%2C South-East Asia%2C Western
- Brasil. Dengue [Internet]. Ministério da Saúde2024 [Acesso 2024 Sep 6]; Disponível em: https://www.gov.br/saude/pt-br/assuntos/saude-de-a-a-z/d/dengue
- World Health Organization. Dengue: Guidelines for Diagnosis, Treatment, Prevention and Control [Internet]. World Heal. Organ.2009 [Acesso 2024 Oct 1]; Disponível em: https://www.who.int/publications/i/item/9789241547871
- Raafat N, Blacksell SD, Maude RJ. A review of dengue diagnostics and implications for surveillance and control. Trans R Soc Trop Med Hyg [Internet] 2019; 113(11):653-60. Disponível em: https://academic.oup.com/trstmh/article/113/11/653/5542180
- Brasil. Dengue: Diagnóstico e Manejo Clínico – Adulto e criança [Internet]. 2024. Disponível em: http://bvsms.saude.gov.br/bvs/publicacoes/dengue_
- World Health Organization. Dengue haemorrhagic fever: Diagnosis, treatment, prevention and control [Internet]. 1997 [Acesso 2024 Oct 1]; Disponível em: https://iris.who.int/handle/10665/41988
- De Paula SO, Fonseca BAL da. Dengue: a review of the laboratory tests a clinician must know to achieve a correct diagnosis. Brazilian J Infect Dis [Internet] 2004;8(6):390-8. Disponível em: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1413-86702004000600002&lng=en&nrm=iso&tlng=en
- Eltzov E, Atias D, Gheber L, Marks RS. Dengue Virus Diagnostics [Internet]. In: Viola Magni M, editor. Dordrecht: Springer Netherlands; 2010. page 275-95. Disponível em: http://link.springer.com/10.1007/978-90-481-8544-3_12
- AnandaRao R, Swaminathan S, Fernando S, Jana AM, Khanna N. A custom-designed recombinant multiepitope protein as a dengue diagnostic reagent. Protein Expr Purif [Internet] 2005; 41(1):136-47. Disponível em: https://linkinghub.elsevier.com/retrieve/pii/S1046592805000112
- Mackenzie JS, Gubler DJ, Petersen LR. Emerging flaviviruses: the spread and resurgence of Japanese encephalitis, West Nile and dengue viruses. Nat Med [Internet] 2004;10(S12):S98-109. Disponível em: https://www.nature.com/articles/nm1144
- WHO. Dengue Diagnostics: Proceedings of an International Workshop, 4-6 October 2004, WHI/TDR Geneva, Switzerland. [Internet]. Dengue Bull. 2005 [Acesso 2024 Oct 1]. Disponível em: https://iris.who.int/handle/10665/164132
- Kuberski TT, Rosen L. A Simple Technique for the Detection of Dengue Antigen in Mosquitoes by Immunofluorescence. Am J Trop Med Hyg [Internet] 1977; 26(3):533-7. Disponível em: https://www.ajtmh.org/view/journals/tpmd/26/3/article-p533.xml
- Lanciotti RS, Calisher CH, Gubler DJ, Chang GJ, Vorndam A V. Rapid detection and typing of dengue viruses from clinical samples by using reverse transcriptase-polymerase chain reaction. J Clin Microbiol [Internet] 1992; 30(3):545-51. Disponível em: https://journals.asm.org/doi/10.1128/jcm.30.3.545-551.1992
- Harris E, Roberts TG, Smith L, Selle J, Kramer LD, Valle S, et al. Typing of Dengue Viruses in Clinical Specimens and Mosquitoes by Single-Tube Multiplex Reverse Transcriptase PCR. J Clin Microbiol [Internet] 1998; 36(9):2634-9. Disponível em: https://journals.asm.org/doi/10.1128/JCM.36.9.2634-2639.1998
- Campbell GL, Marfin AA, Lanciotti RS, Gubler DJ. West Nile virus. Lancet Infect Dis [Internet] 2002; 2(9):519–29. Disponível em: https://linkinghub.elsevier.com/retrieve/pii/S1473309902003687
- Sambri V, Capobianchi M, Cavrini F, Charrel R, Donoso-Mantke O, Escadafal C, et al. Diagnosis of West Nile Virus Human Infections: Overview and Proposal of Diagnostic Protocols Considering the Results of External Quality Assessment Studies. Viruses [Internet] 2013; 5(10):2329-48. Disponível em: https://www.mdpi.com/1999-4915/5/10/2329
- Bessoff K, Delorey M, Sun W, Hunsperger E. Comparison of Two Commercially Available Dengue Virus (DENV) NS1 Capture Enzyme-Linked Immunosorbent Assays Using a Single Clinical Sample for Diagnosis of Acute DENV Infection. Clin Vaccine Immunol [Internet] 2008; 15(10):1513-8. Disponível em: https://journals.asm.org/doi/10.1128/CVI.00140-08
- Guzman MG, Jaenisch T, Gaczkowski R, Ty Hang VT, Sekaran SD, Kroeger A, et al. Multi-Country Evaluation of the Sensitivity and Specificity of Two Commercially-Available NS1 ELISA Assays for Dengue Diagnosis. PLoS Negl Trop Dis [Internet] 2010; 4(8):e811. Disponível em: https://dx.plos.org/10.1371/journal.pntd.0000811
- Hermann LL, Thaisomboonsuk B, Poolpanichupatam Y, Jarman RG, Kalayanarooj S, Nisalak A, et al. Evaluation of a Dengue NS1 Antigen Detection Assay Sensitivity and Specificity for the Diagnosis of Acute Dengue Virus Infection. PLoS Negl Trop Dis [Internet] 2014; 8(10):e3193. Disponível em: https://dx.plos.org/10.1371/journal.pntd.0003193
- Lima M da RQ, Nogueira RMR, Schatzmayr HG, Santos FB dos. Comparison of Three Commercially Available Dengue NS1 Antigen Capture Assays for Acute Diagnosis of Dengue in Brazil. PLoS Negl Trop Dis [Internet] 2010; 4(7):e738. Disponível em: https://dx.plos.org/10.1371/journal.pntd.0000738
- Osorio L, Ramirez M, Bonelo A, Villar LA, Parra B. Comparison of the diagnostic accuracy of commercial NS1-based diagnostic tests for early dengue infection. Virol J [Internet] 2010; 7(1):361. Disponível em: https://virologyj.biomedcentral.com/articles/10.1186/1743-422X-7-361
- Ramirez AH, Moros Z, Comach G, Zambrano J, Bravo L, Pinto B, et al. Evaluation of dengue NS1 antigen detection tests with acute sera from patients infected with dengue virus in Venezuela. Diagn Microbiol Infect Dis [Internet] 2009; 65(3):247-53. Disponível em: https://linkinghub.elsevier.com/retrieve/pii/S0732889309003241
- Pan American Health Organization. Recomendaciones para la detección y el diagnóstico por laboratorio de infecciones por arbovirus en la Región de las Américas [Internet]. Pan American Health Organization; 2022 [Acesso 2024 Oct 1]. Disponível em: https://iris.paho.org/handle/10665.2/56321
- Balmaseda A, Guzmán MG, Hammond S, Robleto G, Flores C, Téllez Y, et al. Diagnosis of Dengue Virus Infection by Detection of Specific Immunoglobulin M (IgM) and IgA Antibodies in Serum and Saliva. Clin Vaccine Immunol [Internet] 2003; 10(2):317-22. Disponível em: https://journals.asm.org/doi/10.1128/CDLI.10.2.317-322.2003
- Innis BL, Nisalak A, Nimmannitya S, Kusalerdchariya S, Chongswasdi V, Suntayakorn S, et al. An Enzyme-Linked Immunosorbent Assay to Characterize Dengue Infections Where Dengue and Japanese Encephalitis Co-Circulate. Am J Trop Med Hyg [Internet] 1989; 40(4):418-27. Disponível em: https://www.ajtmh.org/view/journals/tpmd/40/4/article-p418.xml
- Chow L, Hsu ST. [MAC-ELISA for the detection of IgM antibodies to dengue type I virus (rapid diagnosis of dengue type I virus infection)]. Chinese J Microbiol Immunol [Internet] 1989; 22(4):278-85. Disponível em: http://www.ncbi.nlm.nih.gov/pubmed/2700156
- WHO. Dengue Diagnostics: Proceedings of an International Workshop,4-6 October 2004, WHI/TDR Geneva, Switzerland. [Internet]. 2004 [Acesso 2024 Oct 7]. Disponível em: https://iris.who.int/handle/10665/164132
- Kerkhof K, Falconi-Agapito F, Van Esbroeck M, Talledo M, Ariën KK. Reliable Serological Diagnostic Tests for Arboviruses: Feasible or Utopia? Trends Microbiol [Internet] 2020; 28(4):276–92. Disponível em: https://linkinghub.elsevier.com/retrieve/pii/S0966842X19302914
- Basile AJ, Goodman C, Horiuchi K, Sloan A, Johnson BW, Kosoy O, et al. Multi-laboratory comparison of three commercially available Zika IgM enzyme-linked immunosorbent assays. J Virol Methods [Internet] 2018; 260:26-33. Disponível em: https://linkinghub.elsevier.com/retrieve/pii/S0166093418301216
- Vaughn DW, Nisalak A, Solomon T, Kalayanarooj S, Nguyen MD, Kneen R, et al. Rapid serologic diagnosis of dengue virus infection using a commercial capture ELISA that distinguishes primary and secondary infections. Am J Trop Med Hyg [Internet] 1999; 60(4):693-8. Disponível em: https://www.ajtmh.org/view/journals/tpmd/60/4/article-p693.xml
- Vazquez S, Hafner G, Ruiz D, Calzada N, Guzman MG. Evaluation of immunoglobulin M and G capture enzyme-linked immunosorbent assay Panbio kits for diagnostic dengue infections. J Clin Virol [Internet] 2007; 39(3):194-8. Disponível em: https://linkinghub.elsevier.com/retrieve/pii/S138665320700131X
- Balmaseda A, Stettler K, Medialdea-Carrera R, Collado D, Jin X, Zambrana JV, et al. Antibody-based assay discriminates Zika virus infection from other flaviviruses. Proc Natl Acad Sci [Internet] 2017; 114(31):8384-9. Disponível em: https://pnas.org/doi/full/10.1073/pnas.1704984114
- Stettler K, Beltramello M, Espinosa DA, Graham V, Cassotta A, Bianchi S, et al. Specificity, cross-reactivity, and function of antibodies eliAcesso by Zika virus infection. Science [Internet] 2016; 353(6301):823-6. Disponível em: https://www.science.org/doi/10.1126/science.aaf8505
- Centers for Disease Control and Prevention. Prolonged IgM Antibody Response in People Infected with Zika Virus : Implications for Interpreting Serologic Testing Results for Pregnant. 2017 [Acesso 2024 Oct 1]; 5-7. Disponível em: https://stacks.cdc.gov/view/cdc/45492
- Gibney KB, Kosoy OI, Fischer M, Edupuganti S, Lanciotti RS, Delorey MJ, et al. Detection of Anti-Yellow Fever Virus Immunoglobulin M Antibodies at 3-4 Years Following Yellow Fever Vaccination. Am J Trop Med Hyg [Internet] 2012; 87(6):1112-5. Disponível em: https://ajtmh.org/doi/10.4269/ajtmh.2012.12-0182
- Griffin I, Martin SW, Fischer M, Chambers T V, Kosoy O, Falise A, et al. Zika Virus IgM Detection and Neutralizing Antibody Profiles 12-19 Months after Illness Onset. Emerg Infect Dis [Internet] 2019; 25(2):299-303. Disponível em: http://wwwnc.cdc.gov/eid/article/25/2/18-1286_article.htm
- PAHO. Diagnóstico por laboratorio de la infección por Virus de la Fiebre Amarilla. Organ Panam la Salud , Organ Panam la Salud 2018;(Figura 1):1-8.
- Hunsperger EA, Muñoz-Jordán J, Beltran M, Colón C, Carrión J, Vazquez J, et al. Performance of Dengue Diagnostic Tests in a Single-Specimen Diagnostic Algorithm. J Infect Dis [Internet] 2016; 214(6):836-44. Disponível em: https://academic.oup.com/jid/article-lookup/doi/10.1093/infdis/jiw103
- Thomas L, Najioullah F, Besnier F, Valentino R, Césaire JRR, Cabié A, et al. Clinical Presentation of Dengue by Serotype and Year of Epidemic in Martinique. Am Soc Trop Med Hyg [Internet]. 2014 Jul 2; 91(1):138-45. Disponível em: https://www.ajtmh.org/view/journals/tpmd/91/1/article-p138.xml
- Tsheten T, Clements ACA, Gray DJ, Adhikary RK, Furuya-Kanamori L, Wangdi K. Clinical predictors of severe dengue: a systematic review and meta-analysis. Infect Dis Poverty [Internet]. 2021 Dec 9; 10(1):123. Disponível em: https://idpjournal.biomedcentral.com/articles/10.1186/s40249-021-00908-2
- Soo KM, Khalid B, Ching SM, Chee HY. Meta-Analysis of Dengue Severity during Infection by Different Dengue Virus Serotypes in Primary and Secondary Infections. Huy NT, editor. PLoS One [Internet]. 2016 May 23; 11(5):e0154760. Disponível em: https://dx.plos.org/10.1371/journal.pone.0154760
- Paradkar PN, Sahasrabudhe PR, Ghag Sawant M, Mukherjee S, Blasdell KR. Towards Integrated Management of Dengue in Mumbai. Viruses [Internet]. 2021 Dec 4; 13(12):2436. Disponível em: https://www.mdpi.com/1999-4915/13/12/2436
Correspondência
Dennis Armando Bertolini
E-mail: [email protected]
