Biomarcadores de osteoartrite no líquido sinovial
Biomarkers of osteoarthritis in synovial fluid
Giovana Filartiga Quister1, Luiza Kaesemodel1, Mauren Isfer Anghebem1,2
1 Universidade Federal do Paraná., Departamento de Análises Clínicas. Curitiba, PR, Brasil.
2 Pontifícia Universidade Católica do Paraná, Escola de Medicina e Ciências da Vida. Curitiba, PR, Brasil.
Recebido em 02/02/2024
Aprovado em 14/03/2024
DOI: 10.21877/2448-3877.202400165
INTRODUÇÃO
A osteoartrite (OA) é uma doença inflamatória articular degenerativa, sendo uma das mais comuns formas de artrite. É caracterizada pelo dano progressivo da cartilagem, resultando em alterações estruturais e funcionais da mesma.(1) Este dano pode ser entendido pela incapacidade dos condrócitos de produzir uma matriz viável de cartilagem, resultando na perda da proteção da cartilagem articular.(2)
Os principais sinais e sintomas clínicos da osteoartrite são dor, efusões e outros sintomas inflamatórios que podem resultar em rigidez e perda de mobilidade.(3,4) Desse modo, a OA é considerada a causa primordial de incapacidade física crônica, sendo elencada como doença prioritária pela Organização Mundial de Saúde – OMS (relatório WHO/EDM/PAR/2004.71).
A exata fisiopatologia da OA não é conhecida, mas sabe-se que é uma doença inflamatória relacionada com alterações bioquímicas e moleculares.(2) A idade, distúrbios metabólicos e, sobretudo, a obesidade são os principais fatores de risco para o desenvolvimento dessa doença,(1) cuja progressão é multifatorial, incluindo contribuições hereditárias, fatores mecânicos e de envelhecimento. A OA também está relacionada com a presença de doença poliarticular, deposição de cristais intra-articulares, fraqueza muscular, neuropatia periférica e instabilidade articular.(5)
O diagnóstico da OA atualmente é feito através de exame físico para determinar o grau de dor e de comprometimento da mobilidade, e de exame radiológico, que possibilita a melhor visualização de alterações da cartilagem.(2)
Nesse contexto, a classificação Kellgren-Lawrence (KL), utilizada como uma definição radiográfica da OA, classifica a articulação com uma pontuação entre 0 (ausência de OA) a 4 (OA grave).(6) Essa classificação é baseada na observação radiográfica de estreitamento do espaço articular, dos osteófitos marginais, da esclerose óssea subcondral e da alteração do formato do osso.(6) Esses métodos são utilizados em pacientes sintomáticos, os quais já apresentam alterações articulares, em sua maioria, irreversíveis(7) e, portanto, podem ser configurados como métodos diagnósticos reativos e não preditivos.(2)
A falta de diagnóstico precoce e o não conhecimento completo do processo fisiopatológico são fatores limitantes no tratamento da doença, que comumente é ineficaz. Assim, o diagnóstico precoce da OA é crucial para a terapia da doença. Para estabelecer um padrão de diagnóstico e uma nova abordagem terapêutica é urgente a descoberta de novos biomarcadores de OA.(8)
De acordo com a OMS, um biomarcador é “qualquer substância, estrutura ou processo que pode ser medido no corpo ou em seus produtos e influenciar ou prever a incidência de resultado ou doença”.(2) Esses biomarcadores podem ser obtidos através da análise de líquidos biológicos e, no caso da OA, os principais fluidos para pesquisa de biomarcadores são o líquido sinovial, a urina e o sangue.(2) O líquido sinovial é o primeiro a ser alterado na progressão da doença, portanto mesmo que seja o de mais difícil acesso e avaliação é o que merece mais atenção.(2,7)
Baseado nesta premissa, este trabalho objetiva revisar os aspectos gerais sobre as articulações, o líquido sinovial, a osteoartrite e possíveis biomarcadores preditivos desta condição patológica. O trabalho foi desenvolvido em cinco etapas: (1) elaboração da pergunta norteadora: “Quais os biomarcadores de osteoartrite no líquido sinovial?”; (2) busca de literatura na base de dados PubMED (https://pubmed.ncbi.nlm.nih.gov/) utilizando os descritores: “osteoarthritis”, “biomarker”, “synovial fluid”, “synovial effusion”, “diagnosis”; (3) análise crítica dos estudos selecionados; (4) discussão dos resultados; e (5) elaboração da revisão.
ARTICULAÇÕES
Articulações são junções presentes no corpo que permitem a conexão de ossos e cartilagens.(9) A classificação das articulações pode ser baseada em critérios histológicos, em que se considera o tipo de tecido conjuntivo dominante, ou em critérios funcionais, centrados na capacidade de movimento da articulação. Histologicamente, as articulações podem ser fibrosas, cartilaginosas e sinoviais. Do ponto de vista funcional, as articulações podem ser imóveis (sinartrose), ligeiramente móveis (anfiartrose) ou móveis (diartrose). Ambas as classificações podem ser correlacionadas: as sinartroses são articulações fibrosas; as anfiartroses, cartilaginosas; e as diartroses, sinoviais.(10)
Posto isso, a maioria dos ossos está conectada a partir de dois tipos principais de articulações: a sinartrose, conhecida como falsa articulação, e a diartrose, denominada de verdadeira articulação. A principal diferença entre elas é que na falsa articulação está presente um tecido conjuntivo de preenchimento, enquanto a verdadeira articulação possui um espaço articular. Ademais, a articulação verdadeira possui uma cápsula articular, promovendo estabilidade à articulação, e é dentro dessa cápsula que está presente a membrana sinovial.(11)
Esta membrana reveste a cápsula e produz a sinóvia ou líquido sinovial, que é um ultrafiltrado do plasma. O líquido sinovial é constituído de ácido hialurônico, lubricina, proteinases e colagenases e tem como função a lubrificação da articulação e a nutrição da cartilagem articular. Daí a diartrose receber o nome de articulação sinovial por possuir o líquido sinovial, que devido ao seu papel de lubrificação permite que o movimento seja feito sem que haja fraturas ou quaisquer danos às faces articulares.(12) A Figura 1 ilustra uma articulação verdadeira.
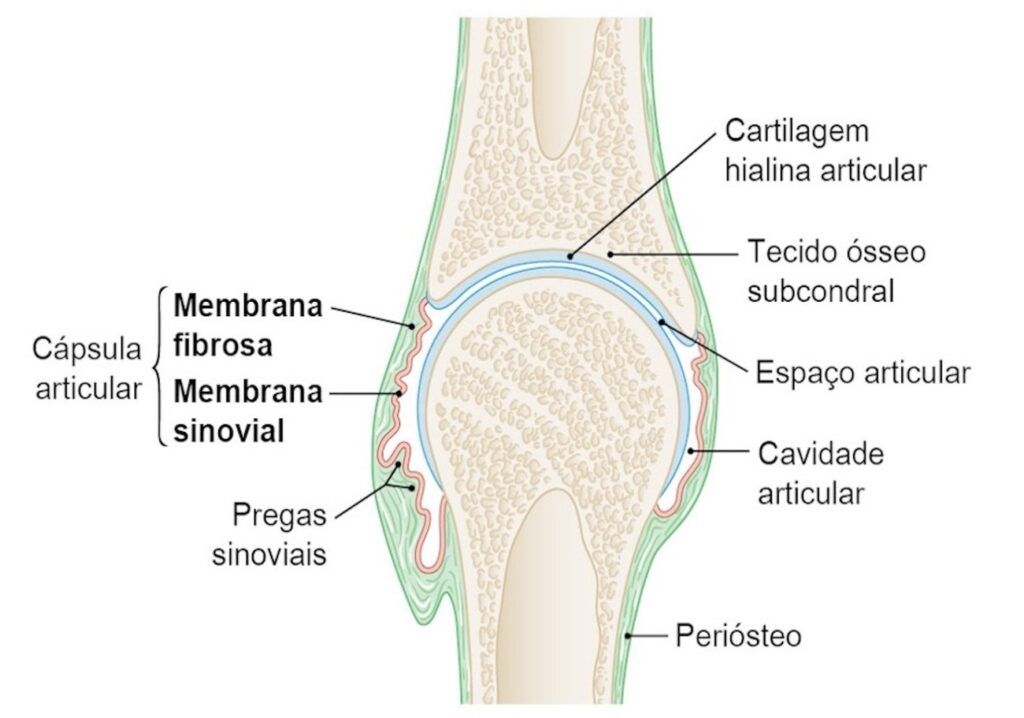
Figura 1
Diartrose: articulação sinovial.
A cavidade articular é circundada pela cápsula articular, um tecido conjuntivo fibroso ligado a cada osso participante, contendo membrana fibrosa e membrana sinovial. A membrana sinovial secreta o líquido sinovial que fica localizado na cavidade articular. A cartilagem hialina forma a cartilagem articular, cobrindo toda a superfície articular de cada osso. A cartilagem articular e a membrana sinovial são contínuas.
Fonte: Adaptado de Paulsen, F. & Waschke, J., 2019.(11)
Cartilagem articular
A cartilagem é um tecido conjuntivo avascular, composto por células – os condrócitos – e um conjunto de macromoléculas, cujas características bioquímicas refletem sorbretudo a composição da matriz extracelular (MEC).(13) Dependendo da localização no organismo e da composição da MEC, a cartilagem articular pode ser classificada em hialina, elástica e cartilaginosa, sendo a hialina a predominante nas articulações.(14)
O principal tipo celular da cartilagem articular são os condrócitos, ocupando apenas 1% do volume total do tecido. São células bastante diferenciadas, que apresentam uma limitada capacidade de proliferação e migração.(14) Os condrócitos são metabolicamente ativos e circundados pela MEC.(15) À medida que se dividem, também produzem a MEC que os circunda e se dispersam através dela. Eles sustentam a cartilagem e produzem colágeno e proteoglicanos ao mesmo tempo que também produzem metaloproteinases (MMP), que são enzimas que degradam a matriz cartilaginosa, possibilitando a expansão e reposicionamento das próprias células.(16)
Os 99% restantes do volume total da cartilagem articular são compostos de 66% a 80% de água, cujas moléculas estão fortemente ligadas aos agregados de agrecano e ácido hialurônico, e cujo volume se altera conforme peso/compressão e diminui com a idade.(12,16) O fato de parte da cartilagem articular estar ligada frouxamente possibilita a difusão de pequenos metabólitos (dos quais cerca de 20 a 34% são sólidos inorgânicos e orgânicos) para os condrócitos, e destes para o interstício.(16)
A MEC das articulações é composta de colágenos, proteínas não colagênicas, água e lipídios,(17) sendo esses compostos os responsáveis pelo reparo da MEC.(15) A presença de colágeno do tipo II proporciona resistência à tração. A cartilagem também possui colágenos dos tipos IX, XI, IV, X e moléculas de colágeno específicas da cartilagem.(16)
As proteínas não colagênicas – proteoglicanas, proteína oligomérica da matriz da cartilagem (COMP), fibulina e glicoproteínas – são sintetizadas pelos osteoblastos e oferecem às articulações elasticidade, flexibilidade e força.(17) Elas mediam interações dos condrócitos com a MEC e têm valor clínico como marcadores de renovação e degeneração da cartilagem.(16)
As proteoglicanas proporcionam resistência à compressão; suas concentrações diminuem com a idade, resultando no amolecimento da cartilagem.(12,14) Esta classe de proteínas contém três tipos de glicosaminoglicanos: o ácido hialurônico (hialurano), o sulfato de condroitina e o sulfato de queratano. Estes dois últimos se unem por meio de uma proteína central, formando o monômero mais importante da cartilagem hialina: o agrecano. Cada molécula de ácido hialurônico está associada a várias moléculas de agrecano, formando agregados de proteoglicanos ligados às fibrilas de colágeno, os quais proporcionam as propriedades biomecânicas da cartilagem hialina.(16)
A cartilagem articular é dividida em quatro camadas ou zonas, que apresentam diferentes comportamentos biomecânicos e bioquímicos. A camada superficial (zona I) ocupa de 10% a 20% da espessura da cartilagem articular e protege as camadas mais profundas contra tensões de cisalhamento. Contém poucos proteoglicanos e sua maior parte é composta de água, sendo suas células pouco ativas, gerando pouco desgaste. É a zona responsável pelo comportamento da cartilagem sob estresse, e por este motivo deforma-se mais fortemente, sendo menos rígida que as outras zonas. É por esta zona que há maior troca de fluidos da cartilagem com seu arredor devido ao aumento da permeabilidade do tecido em caso de grande estresse mecânico.(15)
A camada transicional ou zona II ocupa o maior volume, entre 40% e 60% da cartilagem, e abrange fibrilas de colágeno e proteoglicanos que são mais espessos. De uma visão funcional, esta camada é a primeira linha de resistência contra forças de compressão.(15)
A camada profunda ou zona III contém o maior número de proteoglicanos, contudo o menor volume de água. Apresenta fibrilas de colágeno com maior diâmetro e condrócitos dispostos paralelamente a elas. Proporciona a maior resistência contra as forças compressivas, pois as fibras de colágenos criam uma forma de arca de sustentação pela sua disposição, suportando carga sobrejacente. A interface separa a zona III da cartilagem calcificada. É nessa zona que as faixas de fibrilas se ligam às fibras de colágeno e impedem a separação da cartilagem do osso.(15)
Por fim, a camada calcificada ou zona IV atua na fixação da cartilagem ao osso; nela a população celular é escassa.(15) A Figura 2 esquematiza as quatro zonas da cartilagem articular.
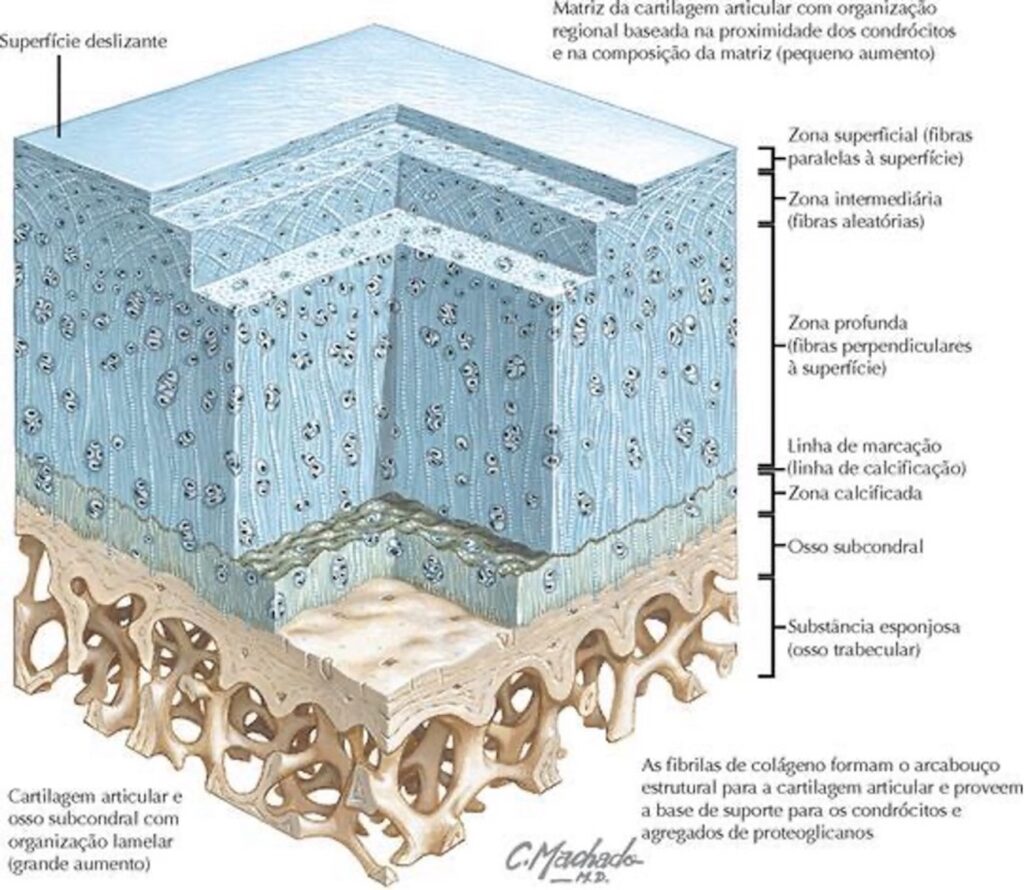
Figura 2
Cartilagem articular e osso subcondral com organização lamelar.
Fonte: Thompson JC, 2011.(12)
Líquido sinovial
O líquido articular é denominado de líquido sinovial em razão da sua semelhança com uma clara de ovo, por ser substância viscosa e mucinosa. Atua como um lubrificante das articulações, reduzindo o atrito entre as superfícies da cartilagem.(18) Seu volume varia de 0,1mL a 3,5mL, geralmente aumentando quando presentes doenças articulares.(19)
O líquido sinovial é composto por um ultrafiltrado do plasma proveniente de fenestrações nos vasos sanguíneos sinoviais e por substâncias secretadas pela membrana sinovial. Em sua composição estão proteínas e outras macromoléculas secretadas pelas células que revestem as articulações, altas concentrações de hialuronato de alto peso molecular e células e mediadores inflamatórios. O líquido sinovial está em contato direto com a cartilagem articular e o tecido sinovial, fornecendo nutrientes necessários para o metabolismo dos condrócitos e servindo como meio de transporte das proteínas liberadas pela cartilagem articular, além de permitir o aporte de citocinas.(20,21)
Os constituintes do líquido sinovial que advém do plasma atravessam uma barreira dupla de membrana, que consiste primeiramente do revestimento endotelial dos capilares, seguido da matriz que envolve as células sinoviais. Após a filtração, combina-se com um mucopolissacarídeo que é sintetizado pela membrana sinovial, o hialuronato ou ácido hialurônico.(18)
O ácido hialurônico fornece a viscosidade do líquido sinovial, sendo o componente mais importante do meio, fornecendo suavidade para as articulações e resistência da cartilagem à compressão.(17)
O segundo componente em importância no líquido sinovial é o agrecano, também conhecido como proteína de índice de proteoglicanos específicos da cartilagem ou proteoglicano de sulfato de condroitina. Desempenha importante participação nas interações entre condrócitos, e entre condrócitos e a MEC.(17)
Devido a sua relação direta com vários tecidos da articulação, a análise laboratorial do líquido sinovial é uma excelente ferramenta diagnóstica para investigar a progressão da osteoartrite e demais doenças articulares, fornecendo informações sobre prognóstico e estágio da doença, como também sobre distúrbios na articulação.(2)
Na presença de um processo inflamatório, o líquido sinovial apresentará mediadores inflamatórios e subprodutos que refletem a mudança na articulação. Uma vez que biomarcadores relacionados a processos nas articulações estão em maior concentração no líquido sinovial, a análise deste fluido pode apresentar maior sensibilidade e especificidade em relação ao estado clínico do paciente.(4,22)
OSTEOARTRITE
A osteoartrite (OA) é a doença articular mais comum no mundo, com incidência global estimada em cerca de 20%, sendo de 2% a 4% na América do Sul. É caracterizada por degeneração progressiva da cartilagem articular e dor persistente, causando incapacidade, perda de função e redução da qualidade de vida.(23)
Na OA, as alterações estruturais e funcionais presentes concomitantemente podem afetar toda a articulação, incluindo membrana sinovial, menisco (no caso do joelho), ligamentos periarticulares e osso subcondral.(4) A etiopatogenia da OA é multifatorial, e pode ser primária (idiopática) ou secundária, com influência de fatores hereditários. Contribuem para o desenvolvimento da OA a idade, traumas articulares, outras doenças articulares e sobrepeso/obesidade.(23)
Fisiopatologia da Osteoartrite
A cartilagem articular é o tecido mais importante envolvido no desenvolvimento inicial da OA.(24) Todavia, a patogênese da OA envolve não apenas o dano da cartilagem, como também alterações estruturais em toda a articulação, como no osso subcondral, nos ligamentos, na cápsula, na membrana sinovial e nos músculos periarticulares.(25,26)
Entre as alterações estruturais mais comuns associadas à OA estão a perda progressiva da cartilagem articular, o aumento da espessura da placa subcondral (estrutura presente logo abaixo da cartilagem, importante para sua regeneração natural), o crescimento de saliência óssea nas margens articulares (osteófitos) e o desenvolvimento de cistos ósseos.(5)
A OA é hoje reconhecida como um processo inflamatório que, pelo menos histologicamente, pode por vezes ser indistinguível da infiltração sinovial reumatoide.(23) A inflamação crônica mediada pela hiperplasia sinovial – aumento no volume do líquido articular devido a uma resposta inflamatória por conta da sinovite na camada produtora do líquido (a sinóvia) – foi recentemente identificada como gatilho para o início e progressão da OA. Verificou-se que a inflamação sinovial antecede as alterações estruturais das articulações e está positivamente correlacionada com a gravidade da OA. A inflamação sinovial afeta a degeneração da MEC, a remodelação subcondral e a formação de osteófitos – formações ósseas anormais em torno da articulação.(23)
A Figura 3 sumariza a fisiopatologia da OA. Durante o desenvolvimento da OA, a composição da cartilagem muda, resultando na perda da sua integridade e aumentando a suscetibilidade à ruptura por forças físicas. No início do processo as erosões ocorrem apenas na superfície; posteriormente, fissuras cartilaginosas mais profundas são seguidas pela expansão da zona de cartilagem calcificada. Em um processo adaptativo na tentativa de reparação, ocorre hipertrofia dos condrócitos, o que promove a geração de produtos de degradação da matriz e mediadores pró-inflamatórios que atuam nos próprios condrócitos, desregulando sua função, e estimulam respostas proliferativas e pró-inflamatórias no líquido sinovial adjacente. Os sinoviócitos, células do tecido sinovial, em proliferação também liberam produtos pró-inflamatórios. Esse processo é acompanhado por hipertrofia tecidual e aumento da vascularização. No osso, a renovação óssea é aumentada e ocorre invasão vascular, com a rede de vasos se estendendo do osso subcondral, passando pela interface e atingindo a cartilagem. Esta remodelação e reparação óssea também está associada ao desenvolvimento de lesões subcondrais da medula óssea. Os osteófitos que se desenvolvem nas margens articulares em razão da reativação da ossificação endocondral são fortemente afetados por fatores inflamatórios, assim como por sobrecarga e cinemática articular anormal.(26, 27)
Os principais mecanismos fisiológicos envolvidos na OA, portanto, estão relacionados à ação de mediadores pró-inflamatórios, como as interleucinas IL-1β, IL-6, IL-8, o fator de necrose tumoral α (TNF-α), o fator nuclear κB (NFκB) e a proteína quinase ativada por mitogênio (MAP) em condrócitos, comprometendo sua função e viabilidade e acelerando a diferenciação hipertrófica e o envelhecimento celular.(24) Assim, o diagnóstico precoce é crucial para a prevenção do processo fisiopatológico da OA.
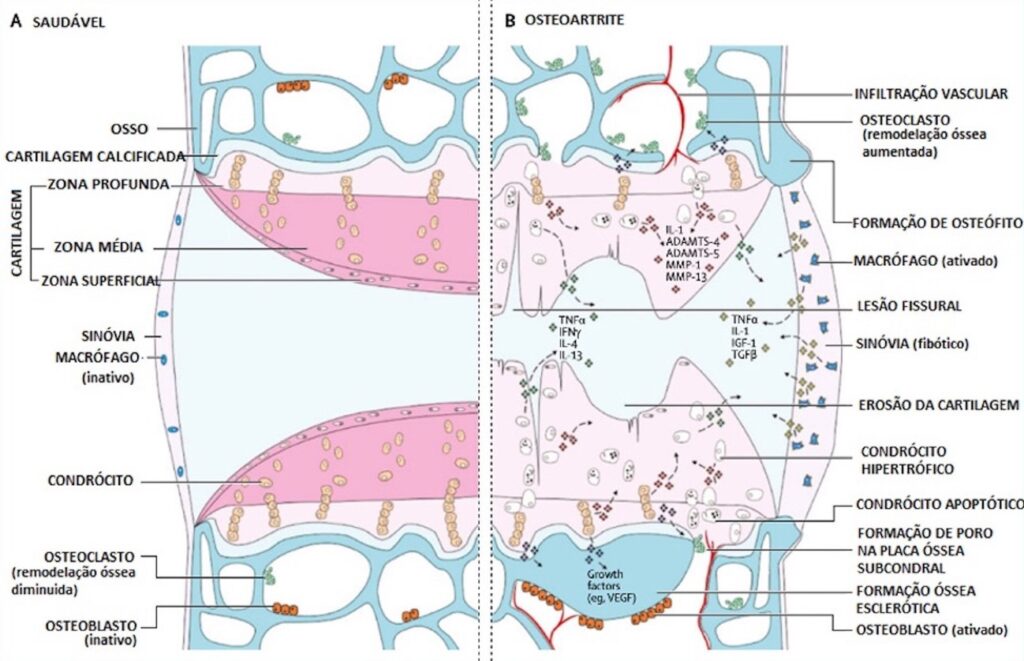
Figura 3
Vias de sinalização e alterações estruturais no desenvolvimento da osteoartrite.
ADAMTS= desintegrina A e metaloprotease com domínios trombospondina. IL= interleucina. MMP= metaloproteinase de matriz. TNF= fator de necrose tumoral. IFN= interferon. IGF= fator de crescimento insulínico. TGF= fator de crescimento transformador. VEGF= fator de crescimento do endotélio vascular.
Fonte: Adaptado de Hunter, D.J. & Bierma-Zeinstra, S., 2019.(27)
BIOMARCADORES DE OSTEOARTRITE NO LÍQUIDO SINOVIAL
A definição de biomarcadores pode ser ampla e vem mudando ao longo dos anos. Em uma proposição atual, biomarcador pode ser definido como uma observação biológica que substitui e prediz um desfecho clinicamente relevante ou resultado intermediário que é mais difícil de observar. Portanto, para a identificação de biomarcadores adequados é preciso compreender a fisiopatologia da doença e os fatores a ela associados.(28)
Dada a ligação física do líquido sinovial com os tecidos articulares, a pesquisa de diferentes biomarcadores neste líquido pode ser uma forma eficiente de tornar mais sensível e mais eficiente o diagnóstico precoce da OA. Os melhores candidatos para biomarcadores na OA são moléculas estruturais ou fragmentos ligados à cartilagem, a osso ou ao líquido sinovial e podem ser específicos de um tipo de tecido articular ou comum a todos eles. Partindo deste princípio, os biomarcadores de OA no líquido sinovial podem ser divididos em 4 classes, com base na sua origem e função: (1) biomarcadores associados ao metabolismo do colágeno na cartilagem (colágeno tipo II) ou osso subcondral (colágeno tipo I); (2) biomarcadores associados ao metabolismo do agrecano na cartilagem; (3) biomarcadores relacionados a proteínas não colagênicas que têm um papel em outras vias metabólicas na articulação, incluindo glicoproteínas, proteoglicanos, metaloproteinases, produtos finais de glicação avançada, bem como hialuronato; e, (4) biomarcadores associados a outros processos, como inflamação ou fibrose.(29)
Em 2006, Bauer e colaboradores(30) propuseram uma classificação dos biomarcadores da OA, denominada BIPED (do inglês, Burden of Disease, Investigative, Prognostic, Efficacy of Intervention and Diagnostic), que significa Carga de Doença, Investigativo, Prognóstico, Eficácia de Intervenção e Diagnóstico. Mais tarde, o Biomarkers Working Group, que representa especialistas na área de pesquisa de biomarcadores de OA, atualizou esta classificação e elaborou um consenso a pedido da OARSI-FDA (Osteoarthritis Research Society International em parceria com a Food and Drug Administration)(31) e 6 categorias de biomarcadores de OA foram propostas, a saber:
Categoria 1: Biomarcadores de carga da doença
Estes biomarcadores indicam a extensão ou gravidade da doença e podem ser considerados como ferramentas para o estadiamento da OA.(31) Dentre os biomarcadores desta categoria, podem ser citadas as interleucinas (IL), em especial a IL-6 e a IL-8, a proteína oligomérica da matriz da cartilagem – COMP (do inglês, Cartilage Oligomeric Matrix Protein), as metaloproteinases (MMP) como a MMP-1 e a MMP-13, o fator de crescimento do endotélio vascular – VEGF (do inglês Vascular Endothelial Growth Factor), entre outros.(4)
Categoria 2: Biomarcadores investigativos
São os biomarcadores que podem ainda não ter evidências acumuladas suficientes para serem atribuídos a uma categoria específica da classificação BIPED, mas ainda assim se mostram promissores para serem incorporados em futuras pesquisas pré-clínicas e clínicas.(31)
Estudos mostram que alguns biomarcadores se apresentam no líquido sinovial de pacientes com OA em concentrações similares às plasmáticas; outros tiveram suas concentrações alteradas após atividades físicas ou cirurgia artroscópica; outros tiveram suas concentrações correlacionadas a outros biomarcadores. Estes casos envolveram a COMP, as MMP-1, MMP-3, MMP-13 e o inibidor tecidual de metaloproteinase tipo 1 – TIMP-1 (do inglês, Tissue Inhibitor of Metalloprotease-1).(4)
Categoria 3: Biomarcadores prognósticos
São aqueles que indicam o risco do paciente de desenvolver a OA, assim como a probabilidade de progressão da OA, e até mesmo a eficácia terapêutica.(31)
Como exemplos de biomarcador prognóstico citam-se os telopeptídeos C-terminais – CTX I e CTX II (do inglês, C-Terminal Telopeptide), que são fragmentos de degradação do colágeno tipo I e tipo II, respectivamente. Concentrações de CTX I e CTX II aumentadas na urina foram associadas a uma rápida progressão clínica em pacientes com OA com obesidade e depressão.(32) O CTX II analisado em líquido sinovial de pacientes com OA foi associado à gravidade radiográfica.(33)
Categoria 4: Biomarcadores de eficácia da intervenção
Estes biomarcadores podem ser utilizados em ensaios clínicos randomizados para avaliar as alterações associadas aos tratamentos farmacológicos, podendo ser indicativos ou preditivos da eficácia do tratamento.
Um exemplo é a correlação positiva entre as concentrações de agrecano no líquido sinovial de pacientes com OA antes da injeção com ácido hialurônico e a melhora no escore da Associação Ortopédica Japonesa (que avalia a função motora do paciente) um mês após a injeção. Outras evidências científicas mostram que após o tratamento com ácido hialurônico, as concentrações de MMP-1 e MMP-9 reduziram; assim como as concentrações de CTX I reduziram significativamente em pacientes com OA de joelho tratados com colchicina oral.(34,35)
Categoria 5: Biomarcadores de diagnóstico
Biomarcadores de diagnóstico são aqueles capazes de indicar se o paciente tem a doença ou identificar diferentes subtipos da doença. Um biomarcador pode ser mais sensível que um exame de imagem, detectando o processo que desencadeia a OA antes que ela seja detectável por radiografia ou por outros exames. Citocinas, quimiocinas e enzimas proteolíticas estão presentes na OA, o que as torna bons biomarcadores de diagnóstico. Pacientes com OA apresentam elevadas concentrações de MMP-1, MMP-3 e ligante 5 de quimiocina CC – CCL5 (do inglês, C-C Chemokine Ligand-5) em seus líquidos sinoviais em comparação com indivíduos sem OA.(22)
Categoria 6: Biomarcadores de segurança
São biomarcadores que poderiam ser utilizados em ensaios pré-clínicos e pesquisas clínicas para detectar desfechos desfavoráveis e citotoxicidade durante o tratamento da OA, através do monitoramento da saúde dos tecidos articulares; ou definir dosagens terapêuticas seguras. Por exemplo, biomarcadores que refletem a síntese das principais proteínas da articulação podem fornecer um índice do efeito protetor das articulações de um tratamento potencial.(31) Atualmente não há estudos explorando especificamente este aspecto dos biomarcadores relacionados ao tecido articular.
Além das seis categorias de biomarcadores propostas pelo Biomarkers Working Group,(31) a avaliação de outros parâmetros biológicos tem auxiliado no diagnóstico, prognóstico e tratamento da OA, sendo elencados a seguir.
OUTROS BIOMARCADORES
Contagem de leucócitos e presença de cristais
Uma contagem total e diferencial de leucócitos no líquido sinovial abaixo de 2.000 células/µL, com baixa porcentagem de neutrófilos, define a natureza não inflamatória do líquido, que é uma característica da OA, ao contrário da artrite inflamatória. Somado a isso, a presença de cristais de cálcio é frequente em líquido sinovial de pacientes com OA.(36)
Viscosidade do líquido sinovial
Em um estudo realizado por Kohlhof e colaboradores,(37) os autores identificaram que nos pacientes saudáveis houve uma redução significativa da velocidade de difusão do glicosaminoglicano hialuronato, enquanto em pacientes com osteoartrite não houve redução. A conclusão do estudo confirma que a viscosidade do líquido sinovial de pacientes com OA se mostra reduzida. Desse modo, a análise do ácido hialurônico, componente presente no líquido sinovial e responsável por sua característica viscosa, se torna relevante quando houver suspeita da doença.
Peptídeo helicoidal de colágeno tipo II (HELIX-II)
O colágeno tipo II é a principal proteína da matriz extracelular na cartilagem articular hialina. Em condições em que há dano na cartilagem, ocorre a degradação deste colágeno com liberação de metabólitos ou fragmentos. Um dos metabólitos é o peptídeo helicoidal de colágeno tipo II, ou HELIX-II, que é formado, em parte, por diferentes vias enzimáticas – incluindo catepsinas e metaloprotease de matriz, em diferentes estágios do dano à cartilagem.(38)
Evidências mostram que a presença de HELIX-II no líquido sinovial é um indicador específico de dano na cartilagem, portanto um biomarcador precoce de OA.(39)
Fatores Induzidos por Hipóxia – HIF
A fisiopatologia da OA envolve hipóxia e estresse oxidativo. Os fatores induzidos por hipóxia – HIF (do inglês, Hypoxia-Inducible Factors) fazem parte de um complexo proteico formado pela polimerização de duas subunidades diferentes: as subunidades a e b. Os HIF-1a, HIF-2a e HIF-3a são três membros da família HIF e geralmente não são expressos em condições normais de oxigênio, mas sua expressão aumenta sob hipóxia. Os HIF atuam nas alterações patológicas da cartilagem articular, do osso subcondral e do líquido sinovial, participando da degradação da MEC da cartilagem articular, apoptose das células locais, reação inflamatória e autofagia. Dos membros da família HIF, o HIF-1a é o mais envolvido na autofagia e apoptose dos condrócitos, desempenha papel importante na regulação da resposta inflamatória e promove a adaptação dos condrócitos frente a condições de hipóxia.(40)
Evidências recentes mostram que as concentrações de HIF-1a aumentam progressivamente conforme a gravidade da OA aumenta, indicando que este fator de transcrição pode ser utilizado como biomarcador diagnóstico e prognóstico da OA.(2)
Sulfato de condroitina
O agrecano é uma das proteínas mais abundantes na matriz da cartilagem e é necessário para reter água na MEC. A medição do sulfato de condroitina indica degradação do agrecano e é, portanto, um marcador de destruição da cartilagem.(41)
Os isômeros do sulfato de condroitina têm sido apontados como bons marcadores de doença articular. As concentrações de sulfato de condroitina e o padrão de sulfatação no líquido sinovial mostraram-se intimamente relacionados à gravidade radiográfica da OA. Comparados com os valores nos controles, os valores das concentrações dos isômeros C6S e C4S e a relação C6S:C4S foram aumentados na fase inicial de OA, e a concentração de C6S e a relação C6S:C4S diminuiu no estágio avançado.(42)
Proteína ácida da cartilagem 1 – CRTAC1
A proteína ácida da cartilagem 1 – CRTAC1 (do inglês, cartilage acidic protein 1) é uma proteína da matriz extracelular da cartilagem, expressa por condrócitos. A IL-1β e o TNF-α regulam positivamente a expressão de CRTAC1 em condrócitos articulares ou fibroblastos sinoviais, o que indica que citocinas pró-inflamatórias poderiam ser a sinalização que desencadeia o aumento de CRTAC1 na OA.(43)
Recentemente a CRTAC1 foi proposta como biomarcador específico de OA, predizendo o risco de desenvolver a doença e a progressão para substituição articular. As evidências mostraram que as concentrações plasmáticas de CRTAC1 identificam melhor o risco de OA do que qualquer outra proteína, incluindo a COMP, o biomarcador mais extensivamente estudado para OA. Além disso, a CRTAC1 é específica para OA, pois não foi associada a outras doenças articulares. E, por fim, embora as concentrações de CRTAC1 aumentem ligeiramente com a idade, não se correlacionam com sexo ou índice de massa corporal, que são os fatores de risco clássicos para OA, indicando que esta proteína é um fator de risco independente para OA.(44)
Marcadores genômicos – microRNAs
O material genômico extracelular é originado de um ambiente intracelular e, portanto, ele pode trazer informações mais valiosas a respeito de alterações intracelulares previamente às alterações estruturais que afetam proteínas de matriz. Ainda, derivados de ácido ribonucleico (RNA) podem permanecer estáveis em líquidos biológicos, como o líquido sinovial, devido a transportadores extracelulares, se tornando alvos potenciais para serem biomarcadores.(6)
Os microRNAs (miRNAs ou miR) são moléculas pequenas de RNA que não codificam proteínas, mas interagem com locais alvo localizados em regiões 3′ não traduzidas (3’UTR) de RNA mensageiro (mRNA) para regular negativamente sua expressão quando o miRNA apropriado está ligado ao mRNA alvo.(45)
Já é sabido que os miRNAs são cruciais no desenvolvimento do esqueleto e na manutenção da homeostase da cartilagem ao longo da idade. Além disso, os miRNAs são desregulados na cartilagem durante a OA e têm um efeito funcional na progressão da doença. Portanto, os miRNAs também podem atuar como biomarcadores de OA.(2) De fato, diversos miRNA já foram apontados como potenciais biomarcadores de OA: miR-454, miR-885, miR-19b, miR-486, miR-33b, miR-140, miR-671, entre outros.(45)
Xie e colaboradores(8) demonstraram que concentrações de miR-210 são significativamente elevadas em pacientes com OA, independentemente do estágio da doença, o que o torna um promissor biomarcador precoce de OA. O estudo também mostrou a alta correlação de miR-210 e VEGF, que prova que o aumento da angiogênese pode ativar o miR-210 e contribuir para o desenvolvimento da OA. Porém seu papel na progressão da doença ainda não foi bem ilustrado.
A expressão de miRNA-34a-5p (miR-34a-5p) está elevada no líquido sinovial de pacientes com OA de joelho em estágio avançado.(46)
O miR-17-5p (miR-17) pertence ao cluster miR-17~92. A desregulação deste agrupamento de miRNA está associada à malformação esquelética e a defeitos de crescimento em humanos, e a redução da expressão de miR-17 desempenha um papel crítico na progressão da OA, podendo ser um promissor biomarcador de OA.(47)
A Tabela 1 resume os biomarcadores selecionados nesta revisão e suas aplicações e/ou limitações.
Tabela 1
Considerações sobre alguns biomarcadores de osteoartrite dosados em líquido sinovial.
| Biomarcador no líquido sinovial | Considerações/Achados na osteoartrite |
| Contagem total de leucócitos | Abaixo de 2.000 células/µL |
| Contagem diferencial de leucócitos | Baixa porcentagem de neutrófilos |
| Presença de cristais de cálcio | Frequente |
| Viscosidade | Diminuída |
| Ácido hialurônico | Diminuído |
| HELIX-II | Presente |
| HIF | Aumentado |
| Sulfato de condroitina | Aumentado na fase aguda |
| CRTAC1 | Aumentada. Fator de risco independente para OA. |
| miRNAs | Diversos foram associados à OA: miR-454, miR-885, miR-19b, miR-486, miR-33b, miR-140, miR-671, entre outros. |
HELIX-II = Peptídeo helicoidal de colágeno tipo II; HIF = Fatores induzidos por hipóxia; CRTAC1 = Proteína ácida da cartilagem 1; miRNAs = microRNAs.
CONSIDERAÇÕES FINAIS
A osteoartrite, caracterizada por degeneração progressiva da cartilagem articular, é a doença reumatológica mais comum no mundo e afeta profundamente a qualidade de vida dos afetados. A busca por biomarcadores de OA é justificada, em razão da elevada prevalência desta patologia, do alto custo envolvido no tratamento e, principalmente, porque o diagnóstico precoce impacta diretamente na eficácia do tratamento.
Esta revisão mostra que a pesquisa de biomarcadores da OA já ajudou a aprofundar a compreensão da fisiopatologia da OA. Sabe-se que o biomarcador ideal é aquele que pode ser coletado de forma não invasiva, é detectado antes do desenvolvimento da doença, tem valor preditivo do resultado da doença e fornece potenciais alvos terapêuticos.
Entretanto, mesmo que a coleta do líquido sinovial seja invasiva, este líquido biológico tem grande valor diagnóstico devido à sua proximidade com a cartilagem, tecido atingido pela osteoartrite. Sendo assim, através deste trabalho foi possível identificar que existem disponíveis muitos biomarcadores relacionados à OA no líquido sinovial, em diferentes estágios de aplicabilidade. A pesquisa de marcadores moleculares de OA, como os miRNAs, é um campo relativamente novo e em expansão, mas que ainda necessita de validação para o uso em larga escala.
REFERÊNCIAS
- Mobasheri A, Batt M. An update on the pathophysiology of osteoarthritis. Ann Phys Rehabil Med. 2016 Dec;59(5-6):333-339. doi:10.1016/j.rehab.2016.07.004.
- Munjal A, Bapat S, Hubbard D, Hunter M, Kolhe R, Fulzele S. Advances in Molecular biomarker for early diagnosis of Osteoarthritis. Biomol Concepts. 2019 Aug 9;10(1):111-119. doi: 10.1515/bmc-2019-0014.
- Abramoff B, Caldera FE. Osteoarthritis: Pathology, Diagnosis, and Treatment Options. Med Clin North Am. 2020 Mar;104(2):293-311. doi: 10.1016/j.mcna.2019.10.007.
- Boffa A, Merli G, Andriolo L, Lattermann C, Salzmann GM, Filardo G. Synovial Fluid Biomarkers in Knee Osteoarthritis: A Systematic Review and Quantitative Evaluation Using BIPEDs Criteria. Cartilage. 2021 Dec;13(1_suppl):82S-103S. doi: 10.1177/1947603520942941.
- Goldring SR, Goldring MB. Clinical aspects, pathology and pathophysiology of osteoarthritis. J Musculoskelet Neuronal Interact. 2006 Oct-Dec;6(4):376-8. PMID: 17185832.
- Budd E, Nalesso G, Mobasheri A. Extracellular genomic biomarkers of osteoarthritis. Expert Rev Mol Diagn. 2018 Jan;18(1):55-74. doi: 10.1080/14737159.2018.1415757.
- Moretti L, Bizzoca D, Geronimo A, Moretti FL, Monaco E, Solarino G, Moretti B. Towards Precision Medicine for Osteoarthritis: Focus on the Synovial Fluid Proteome. Int J Mol Sci. 2022 Aug 27;23(17):9731. doi: 10.3390/ijms23179731.
- Xie W, Su W, Xia H, Wang Z, Su C, Su B. Synovial Fluid MicroRNA-210 as a Potential Biomarker for Early Prediction of Osteoarthritis. Biomed Res Int. 2019 Jul 29; 2019:7165406. doi: 10.1155/2019/7165406.
- Fujii Y, Liu L, Yagasaki L, Inotsume M, Chiba T, Asahara H. Cartilage Homeostasis and Osteoarthritis. Int J Mol Sci. 2022 Jun 5;23(11):6316. doi: 10.3390/ijms23116316.
- Cope PJ, Ourradi K, Li Y, Sharif M. Models of osteoarthritis: the good, the bad and the promising. Osteoarthritis Cartilage. 2019 Feb;27(2):230-239. doi: 10.1016/j.joca.2018.09.016.
- Paulsen F, Waschke J. Sobotta Atlas Prático de Anatomia humana. 3ed. Rio de Janeiro: Guanabara Koogan, 2019. ISBN 9788535292305.
- Thompson JC. Netter Atlas de Anatomia Ortopédica. Rio de Janeiro: Grupo GEN, 2011. E-book. ISBN 9788595155268. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788595155268/. Acesso em: 01 fev 2024.
- Carballo CB, Nakagawa Y, Sekiya I, Rodeo SA. Basic Science of Articular Cartilage. Clin Sports Med. 2017 Jul;36(3):413-425. doi: 10.1016/j.csm.2017.02.001.
- Ocampo PE, Vallejo VH, Canavese Rahal S. Cartilagem articular, patogênese e tratamento da osteoartrite. RVZ [Internet]. 14º de novembro de 2019 [citado 2º de fevereiro de 2024]; 26:1-12. Disponível em: https://rvz.emnuvens.com.br/rvz/article/view/425.
- Eschweiler J, Horn N, Rath B, Betsch M, Baroncini A, Tingart M, Migliorini F. The Biomechanics of Cartilage-An Overview. Life (Basel). 2021 Apr 1;11(4):302. doi: 10.3390/life11040302.
- Pawlina W. Ross Histologia – Texto e Atlas. Rio de Janeiro: Grupo GEN, 2021. E-book. ISBN 9788527737241. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788527737241/. Acesso em: 01 fev 2024.
- Kumavat R, Kumar V, Malhotra R, Pandit H, Jones E, Ponchel F, Biswas S. Biomarkers of Joint Damage in Osteoarthritis: Current Status and Future Directions. Mediators Inflamm. 2021 Mar 9; 2021:5574582. doi: 10.1155/2021/5574582.
- Mundt LA, Shanahan K. Exame de urina e de fluidos corporais de Graff. Porto Alegre: Artmed, 2012. ISBN 9788536326344.
- Neves PA. Manual Roca Técnicas de Laboratório – Líquidos Biológicos. São Paulo: Grupo GEN, 2011. E-book. ISBN 978-85-412-0256-5. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/978-85-412-0256-5/. Acesso em: 01 fev 2024.
- Cretu D, Diamandis EP, Chandran V. Delineating the synovial fluid proteome: recent advancements and ongoing challenges in biomarker research. Crit Rev Clin Lab Sci. 2013 Feb-Apr;50(2):51-63. doi: 10.3109/10408363.2013.802408.
- Peffers MJ, Smagul A, Anderson JR. Proteomic analysis of synovial fluid: current and potential uses to improve clinical outcomes. Expert Rev Proteomics. 2019 Apr;16(4):287-302. doi: 10.1080/14789450.2019.1578214.
- Monibi F, Roller BL, Stoker A, Garner B, Bal S, Cook JL. Identification of Synovial Fluid Biomarkers for Knee Osteoarthritis and Correlation with Radiographic Assessment. J Knee Surg. 2016 Apr;29(3):242-7. doi: 10.1055/s-0035-1549022.
- Coaccioli S, Sarzi-Puttini P, Zis P, Rinonapoli G, Varrassi G. Osteoarthritis: New Insight on Its Pathophysiology. J Clin Med. 2022 Oct 12;11(20):6013. doi: 10.3390/jcm11206013.
- Mobasheri A, Batt M. An update on the pathophysiology of osteoarthritis. Ann Phys Rehabil Med. 2016 Dec;59(5-6):333-339. doi: 10.1016/j.rehab.2016.07.004.
- Geyer M, Schönfeld C. Novel Insights into the Pathogenesis of Osteoarthritis. Curr Rheumatol Rev. 2018;14(2):98-107. doi: 10.2174/1573397113666170807122312.
- Chen B, Huang W, Liao J. Osteoarthritis: The Most Common Joint Disease and Outcome of Sports Injury. J Clin Med. 2023 Aug 3;12(15):5103. doi: 10.3390/jcm12155103.
- Hunter DJ, Bierma-Zeinstra S. Osteoarthritis. Lancet. 2019 Apr 27;393(10182):1745-1759. doi: 10.1016/S0140-6736(19)30417-9.
- Aronson JK, Ferner RE. Biomarkers-A General Review. Curr Protoc Pharmacol. 2017 Mar 17; 76:9.23.1-9.23.17. doi: 10.1002/cpph.19.
- Lotz M, Martel-Pelletier J, Christiansen C, Brandi ML, Bruyère O, Chapurlat R, et al. Value of biomarkers in osteoarthritis: current status and perspectives. Ann Rheum Dis. 2013 Nov;72(11):1756-63. doi: 10.1136/annrheumdis-2013-203726. Epub 2013 Jul 29. Erratum in: Ann Rheum Dis. 2017 May 25.
- Bauer DC, Hunter DJ, Abramson SB, Attur M, Corr M, Felson D, Heinegård D, et al. Osteoarthritis Biomarkers Network. Classification of osteoarthritis biomarkers: a proposed approach. Osteoarthritis Cartilage. 2006 Aug;14(8):723-7. doi: 10.1016/j.joca.2006.04.001.
- Kraus VB, Burnett B, Coindreau J, Cottrell S, Eyre D, Gendreau M, Gardiner J, et al. OARSI FDA Osteoarthritis Biomarkers Working Group. Application of biomarkers in the development of drugs intended for the treatment of osteoarthritis. Osteoarthritis Cartilage. 2011 May;19(5):515-42. doi: 10.1016/j.joca.2010.08.019.
- Jacobs CA, Vranceanu AM, Thompson KL, Lattermann C. Rapid Progression of Knee Pain and Osteoarthritis Biomarkers Greatest for Patients with Combined Obesity and Depression: Data from the Osteoarthritis Initiative. Cartilage. 2020 Jan;11(1):38-46. doi: 10.1177/1947603518777577.
- Leung YY, Huebner JL, Haaland B, Wong SBS, Kraus VB. Synovial fluid pro-inflammatory profile differs according to the characteristics of knee pain. Osteoarthritis Cartilage. 2017 Sep;25(9):1420-1427. doi: 10.1016/j.joca.2017.04.001.
- Leung YY, Haaland B, Huebner JL, Wong SBS, Tjai M, Wang C, Chowbay B, et al. Colchicine lack of effectiveness in symptom and inflammation modification in knee osteoarthritis (COLKOA): a randomized controlled trial. Osteoarthritis Cartilage. 2018 May;26(5):631-640. doi: 10.1016/j.joca.2018.01.026.
- Herrero-Beaumont G, Guerrero R, Sánchez-Pernaute O, Acebes C, Palacios I, Mas S, Rodriguez I, et al. Cartilage and bone biological markers in the synovial fluid of osteoarthritic patients after hyaluronan injections in the knee. Clin Chim Acta. 2001 Jun;308(1-2):107-15. doi: 10.1016/s0009-8981(01)00471-5.
- Oliviero F, Scanu A, Galozzi P, Ramonda R. Synovial Fluid Analysis to Identify Osteoarthritis. J Vis Exp. 2022 Oct 20;(188). doi: 10.3791/64351.
- Kohlhof H, Gravius S, Kohl S, Ahmad SS, Randau T, Schmolders J, et al. Single Molecule Microscopy Reveals an Increased Hyaluronan Diffusion Rate in Synovial Fluid from Knees Affected by Osteoarthritis. Sci Rep. 2016 Feb 12; 6:21616. doi: 10.1038/srep21616.
- Charni-Ben Tabassi N, Desmarais S, Bay-Jensen AC, Delaissé JM, Percival MD, Garnero P. The type II collagen fragments Helix-II and CTX-II reveal different enzymatic pathways of human cartilage collagen degradation. Osteoarthritis Cartilage. 2008 Oct;16(10):1183-91. doi: 10.1016/j.joca.2008.02.008.
- Wei X, Yin K, Li P, Wang H, Ding J, Duan W, Wei L. Type II collagen fragment HELIX-II is a marker for early cartilage lesions but does not predict the progression of cartilage destruction in human knee joint synovial fluid. Rheumatol Int. 2013 Jul;33(7):1895-9. doi: 10.1007/s00296-011-2309-9.
- Zhang XA, Kong H. Mechanism of HIFs in osteoarthritis. Front Immunol. 2023 Mar 20; 14:1168799. doi: 10.3389/fimmu.2023.1168799.
- Lineham B, Altaie A, Harwood P, McGonagle D, Pandit H, Jones E. A systematic review on the potential value of synovial fluid biomarkers to predict clinical outcomes in cartilage repair treatments. Osteoarthritis Cartilage. 2022 Aug;30(8):1035-1049. doi: 10.1016/j.joca.2022.05.007.
- Uesaka S, Nakayama Y, Yoshihara K, Ito H. Significance of chondroitin sulfate isomers in the synovial fluid of osteoarthritis patients. J Orthop Sci. 2002;7(2):232-7. doi: 10.1007/s007760200038.
- Ge X, Ritter SY, Tsang K, Shi R, Takei K, Aliprantis AO. Sex-Specific Protection of Osteoarthritis by Deleting Cartilage Acid Protein 1. PLoS One. 2016 Jul 14; 11(7):e0159157. doi: 10.1371/journal.pone.0159157.
- Styrkarsdottir U, Lund SH, Thorleifsson G, Saevarsdottir S, Gudbjartsson DF, Thorsteinsdottir U, Stefansson K. Cartilage Acidic Protein 1 in Plasma Associates with Prevalent Osteoarthritis and Predicts Future Risk as Well as Progression to Joint Replacements: Results From the UK Biobank Resource. Arthritis Rheumatol. 2023 Apr;75(4):544-552. doi: 10.1002/art.42376.
- Swingler TE, Niu L, Smith P, Paddy P, Le L, Barter MJ, Young DA, et al. The function of microRNAs in cartilage and osteoarthritis. Clin Exp Rheumatol. 2019 Sep-Oct;37 Suppl 120(5):40-47.
- Endisha H, Datta P, Sharma A, Nakamura S, Rossomacha E, Younan C, Ali SA, et al. MicroRNA-34a-5p Promotes Joint Destruction During Osteoarthritis. Arthritis Rheumatol. 2021 Mar;73(3):426-439. doi: 10.1002/art.41552.
- Zhang Y, Li S, Jin P, Shang T, Sun R, Lu L, Guo K, et al. Dual functions of microRNA-17 in maintaining cartilage homeostasis and protection against osteoarthritis. Nat Commun. 2022 May 4;13(1):2447. doi: 10.1038/s41467-022-30119-8.
Correspondência
Mauren Isfer Anghebem
E-mail: [email protected]
