Biofilme e células persisters: da persistência à resistência microbiana
Biofilm and persister cells: from persistence to microbial resistance
Jaime Antonio Abrantes1, Joseli Maria da Rocha Nogueira1
1 Fundação Oswaldo Cruz, Laboratório de Microbiologia (DCB – ENSP). Rio de Janeiro, RJ, Brasil.
Recebido em 27/09/2022
Aprovado em 28/09/2022
DOI: 10.21877/2448-3877.202200074
INTRODUÇÃO
As bactérias estão presentes em nosso planeta há bilhões de anos e permanecem sobrevivendo mesmo diante de todos os eventos e ambientes inóspitos.(1) Em resposta a alterações ambientais e fisiológicas, ou às vezes espontaneamente, tais microrganismos produzem vários grupos diferentes de subpopulações específicas para atingir uma maior possibilidade de sobrevivência.(2,3)
Consideramos como biofilme uma comunidade de microrganismos que vivem aderidos a uma superfície, envolvidos numa complexa combinação de compostos, como polissacarídeos, proteínas e DNA extracelular, que dificulta a sua erradicação, já que estas estruturas podem ser consideradas estratégias dos microrganismos para se manterem em uma determinada superfície. Com base nessa possibilidade de adaptação microbiana, é extremamente relevante considerar a dificuldade de se conter infeções causadas por microrganismos organizados nestes biofilmes.(4-6) Esta situação pode ocorrer em diferentes contextos, como no ambiente e até mesmo no hospital, fazendo com que estas bactérias possam necessitar de enfoques diferentes para a sua eliminação.(7,8)
Um tipo de subpopulação importante, encontrada nos biofilmes, são as chamadas células persisters, detectadas inicialmente por Bigger em bactérias do gênero Staphylococcus sp., e mais tarde também pela equipe de pesquisa de Amato e Brynildsen em Escherichia coli e outras espécies.(9,10) Essas cepas exibiram fenótipos temporários de resistência a antimicrobianos (geralmente a múltiplos fármacos), distinguindo-se daquelas que desenvolvem resistência permanente por mutações genéticas ou transferência horizontal de genes.(11) A descoberta de persistentes em biofilmes reacendeu o interesse por essas células incomuns. De fato, a presença de células persistentes pode ser importante na etiologia de muitas doenças infecciosas recalcitrantes.(12)
Recentemente, a alta incidência de recidivas de infecção causada por persisters em pacientes imunocomprometidos enfatizou a importância desta pesquisa.(13,14) Acrescente-se, ainda, a descoberta de que muitas infecções crônicas são causadas por microrganismos persistentes, levando também ao uso excessivo de antimicrobianos e, sucessivamente, ao surgimento de outras bactérias resistentes a estas classes de fármacos.(15) Portanto, é importante entender o mecanismo preciso da formação destes biofilmes e quais seriam as estratégias para seu controle. Este artigo de revisão tem como objetivo reunir o conhecimento existente associado ao papel dos biofilmes microbianos na manutenção de bactérias, sua persistência e a associação com sua resistência aos antimicrobianos em infecções de diversos sítios anatômicos.
MATERIAL E MÉTODOS
Trata-se de uma revisão da literatura, visando buscar estudos sobre persistência e resistência bacteriana. Foram utilizadas as bases de dados: MEDLINE, LILACS e BVS, com as seguintes palavras-chave: Farmacorresistência bacteriana, Biofilmes, Infecções bacterianas e persisters. Os critérios de inclusão utilizados para a seleção da amostra foram: artigos publicados na íntegra em português, inglês e espanhol; todo artigo, independentemente do método de pesquisa utilizado, e abranger um período de 5 anos (2017 até 2022) visando à atualidade dos dados consultados. Como critérios de exclusão: artigos com duplicidade, acesso restrito ao resumo, publicações sem adesão ao objetivo da pesquisa e aqueles que não atenderam aos critérios de inclusão. Após busca bibliográfica com aplicação dos filtros, critérios de inclusão e exclusão, realizou-se a leitura criteriosa dos títulos e resumos, no intuito de verificar a consonância com o objeto de estudo.
RESULTADOS E DISCUSSÃO
Biofilme
Biofilme é uma espessa camada de microrganismos que se agregam para formar uma comunidade microbiana. A mesma se liga a uma superfície com uma camada de polissacarídeo chamada de substância polimérica extracelular (SPE).(16) O SPE consiste em polissacarídeos, DNA extracelular, proteínas, lipídios, surfactantes, flagelos e pili. Esta matriz polimérica protege os microrganismos, pois forma-se ao redor e sobre o crescimento microbiano, promovendo o desenvolvimento desta comunidade e protegendo de ameaças à sua sobrevivência. O biofilme é poroso, a fim de possibilitar a entrada eficaz de nutrientes e eliminação de produtos residuais.(6,8)
De forma geral, existem dois tipos de células provenientes de crescimento microbiano, as células individuais de vida livre e as sésseis, que quando formam agregados podem derivar em biofilmes,(17) os quais podem ser compostos de bactérias Gram-positivas, bactérias Gram-negativas, uma combinação de ambas, bactérias junto a fungos, protozoários, algas e até vírus. Porém, na maioria dos biofilmes os microrganismos representam menos de 10% da massa seca, sendo os outros 90% compostos pela matriz polimérica.(6)
As células que fazem parte de um biofilme realizam uma complexa rede de interações, em que o principal objetivo é manter a sobrevivência desta comunidade e um nível de organização. Este sistema é denominado Quorum sensing.(8)
Comunicação (Quorum sensing)
O sistema Quorum sensing (QS) é um assunto extremamente atual, e com base em seu estudo estamos gradualmente expandindo nossa compreensão sobre como as bactérias se comunicam umas com as outras e regulam suas atividades e interações.
Neste sistema, as bactérias controlam o comportamento de toda a população bacteriana sintetizando e secretando moléculas sinalizadoras, também conhecidas como moléculas autoindutoras (AIs). Esse sistema é usado pelas bactérias para se comunicar e orquestrar a estrutura e função dos biofilmes bacterianos.(18)
Para que isso ocorra, as bactérias que produzem essas moléculas sinalizam para outras próximas. Quando as bactérias detectam que as AIs atingiram uma concentração limite, elas respondem alterando a expressão e o comportamento de seus genes. Além disso, os microrganismos compartilham material genético, que também aumenta a sobrevivência desta estrutura.(6) Além de modificar coletivamente o comportamento bacteriano, as AIs relacionadas ao QS também podem ser incorporadas na diafonia entre o hospedeiro e os microrganismos.(18)
Os estímulos químicos de comunicação (QS) entre as células podem promover diversas mudanças no comportamento da comunidade microbiana como um todo.(8) Entre elas podemos citar: a resposta ao estresse promovida pela limitação de nutrientes com consequente crescimento lento; aumento da expressão de bombas de resistência a múltiplos fármacos; ativação de sistemas de detecção de quorum e mudanças no perfil das proteínas da membrana externa.
Em razão das especificidades do biofilme, como variabilidade microbiana, o SPE, a organização populacional, a presença de células persisters e até mesmo a eficácia do QS, torna-se uma tarefa árdua a detecção do biofilme em amostras clínicas.(19)
Detecção do biofilme
O diagnóstico de infecção por biofilme é feito principalmente por achados clínicos, pois devido à sua própria natureza, detectá-los é um desafio. Vários métodos têm sido sugeridos para detectar biofilmes em ambiente laboratorial, mas esse avanço não é tão grande no ambiente clínico. Ou seja, os métodos in vitro, em condições ideais e controladas, são muito mais eficazes do que o diagnóstico in vivo, diretamente no sítio de formação do biofilme.(7,19)
As infecções por biofilme geralmente estão associadas a infecções crônicas e permanecem nos locais de infecção, muitas vezes na presença de dispositivos implantados. Biofilmes podem produzir infecções ocultas ou subclínicas, que provocam uma resposta inflamatória diminuída do hospedeiro e, portanto, são mais difíceis de detectar e tratar. Quando um biofilme é formado em um dispositivo implantado, ele não pode ser detectado sem remoção do dispositivo.(7)
Apesar da evolução tecnológica em detecção laboratorial do biofilme, as técnicas microbiológicas ainda podem ter uma sensibilidade não tão satisfatória, como a cultura, por exemplo. Isto porque, ainda que as células possam ser detectadas, existem fatores limitantes, como as variantes de crescimento lento e as persisters, que como já foi mencionado podem não formar colônias no ambiente laboratorial. Entre outros fatores, as técnicas de cultura podem ser ineficazes devido à heterogeneidade dos biofilmes, a presença de espécies mistas e ao envolvimento de cepas bacterianas exigentes.(7)
Não existe uma técnica padronizada em ambiente clínico para detecção de biofilmes, embora haja extrema necessidade e carência deste segmento. No entanto, as técnicas moleculares são promissoras pelos avanços recentes na detecção de biofilme, assim como o uso de biomarcadores associados ao biofilme e a técnicas de imagem. Os métodos moleculares incluem o sequenciamento metagenômico de tecnologias baseadas em DNA. Desta forma é possível revelar mais informações em relação ao método com RNA ribossômico para detecção. Dentre essas informações, podemos citar alguns mecanismos de resistência a antibióticos e fatores de virulência.(7)
Outro método promissor é a utilização de biomarcadores, pois quando associados ao biofilme podem detectar moléculas únicas ou estimular uma resposta específica do hospedeiro ao mesmo. Os anticorpos podem não ser detectados durante uma infecção aguda, no entanto podem ser utilizados para detectar uma infecção associada ao biofilme.(8)
As proteínas são as principais substâncias utilizadas como biomarcadores para as bactérias formadoras de biofilme. Já as imagens de biofilme fornecem informações espaciais e podem auxiliar a análise dos outros métodos convencionais, otimizando-os.(6)
Por meio da microscopia eletrônica de varredura (MEV), tem sido possível observar que agregados microbianos maiores são normalmente encontrados nas feridas mais difíceis de curar, enquanto agregados menores foram encontrados nas feridas agudas.(8)
Entre os métodos não convencionais de detecção de biofilmes, podemos citar a investigação baseada em bioimpedância, em que são utilizadas correntes elétricas e ondas acústicas de superfície usando vibração.(6)
Biofilme e infecções
A infecção bacteriana em uma ferida segue uma “progressão exponencial”, iniciando com replicação bacteriana, produção de uma matriz polimérica e, por consequência formação do biofilme.(8) Diversos fatores colaboram para a mudança de colonização para infecção, abrangendo a virulência dos microrganismos, a suscetibilidade do hospedeiro, a carga biológica dos microrganismos e o compartilhamento do material genético entre os mesmos.(6,19)
As bactérias da espécie Staphylococcus aureus causam diversas infecções crônicas e se localizam no centro dos problemas em infecções adquiridas na comunidade e em instituições de saúde. Com sua capacidade de formar biofilme, sua participação e dificuldade de resolução em feridas crônicas continua a crescer.(5)
As feridas crônicas que não cicatrizam incluem úlceras venosas nas pernas, úlceras nos pés diabéticos, úlceras por pressão e queimaduras. Uma das causas da cronicidade de feridas se deve ao metabolismo das bactérias na superfície da ferida, principalmente quando começa a replicação. Os subprodutos ali formados, como endotoxinas e metaloproteinases, afetam negativamente as fases da cicatrização.(8)
Além dos casos citados, os biofilmes são encontrados na síndrome do intestino irritável, membranas timpânicas, feridas crônicas, osteomielite, placa dentária, infecções pulmonares causadas por Pseudomonas sp., na fibrose cística, amigdalite, implantes, válvulas cardíacas artificiais, lentes de contato e todos os tipos de cateteres internos.(6)
Uma bactéria muito presente em pesquisas é a Pseudomonas aeruginosa, um bacilo Gram-negativo, anaeróbio facultativo e não fermentador de glicose. A capacidade desta bactéria formar um biofilme é uma de suas principais estratégias de sobrevivência, principalmente formando canais de água, e tem como função distribuir nutrientes e oxigênio. A disponibilidade de nutrientes é um dos fatores limitantes para a colonização, como também o gradiente de oxigênio presente em sua superfície.(20)
As espécies mais comuns recuperadas de biofilme são S. aureus, Streptococcus spp., Proteus spp., Escherichia coli, Pseudomonas spp., Klebsiella spp. e Citrobacter spp,(8) Dependendo do sítio de infecção, podemos encontrar determinados tipos de bactérias, até mesmo uma espécie mais específica, como podemos observar no Quadro 1.
Quadro 1
Infecções humanas associadas à formação de biofilme.
| Infecções | Espécies bacterianas envolvidas |
| Cárie dentária | Cocos Gram-positivos (Streptococcus spp.) |
| Periodontite | Bactérias bucais anaeróbias Gram-negativas |
| Otite média | Haemophilus influenzae |
| Amigdalite crônica | Várias espécies |
| Fibrose cística | Pseudomonas aeruginosa |
| Endocardite | Streptococcus do grupo viridans e Staphylococcus spp. |
| Fasciíte necrosante | Streptococcus do grupo A |
| Infecções musculoesqueléticas | Cocos Gram-positivos |
| Osteomielite | Várias espécies |
| Infecção do trato biliar | Bactérias entéricas |
| Infecções renais | Bacilos Gram-negativos |
| Prostatite bacteriana | Escherichia coli |
| Desvio de líquido cefalorraquidiano | Staphylococcus spp. |
| Lentes de contato | Pseudomonas aeruginosa e cocos Gram-positivos |
| Suturas | Staphylococcus spp. |
| Pneumonia associada a sistema de ventilação | Bacilos Gram-negativos |
| Válvulas mecânicas cardíacas | Cocos Gram-positivos |
| Infecções em cateter endovascular | Staphylococcus spp. |
Fonte: Adaptado de Vermelho e colaboradores (2008).(21)
Biofilme x Resistência
Quando o biofilme é produzido em organismo, a infecção por diversas vezes se torna crônica e não cede ao uso de antimicrobianos nem ao sistema imunológico do hospedeiro, interferindo na atividade fagocítica do macrófago ou contribuindo para a inativação de anticorpos.(8)
A tolerância ao antimicrobiano pelo biofilme é diferente da resistência bacteriana aos antimicrobianos. Bactérias incorporadas em um biofilme são capazes de sobreviver ao tratamento com antimicrobianos por conta da tolerância e até resistência. Entretanto, no primeiro caso, quando o biofilme é rompido, as bactérias se tornam suscetíveis ao tratamento com antibióticos.(6)
A resistência do biofilme é derivada de inúmeros fatores e pode variar muito de uma infecção para outra. As bactérias dentro de um biofilme, por exemplo, podem resistir a uma concentração de antimicrobiano de até mil vezes mais que a Concentração Inibitória Mínima (CIM), quando em estado planctônico. (8)
Persisters
Persisters são variantes fenotípicas das cepas bacterianas habitualmente presentes no biofilme, cuja função é a sobrevivência. Estas células ficam num estado de aparente dormência, não se dividem, exibindo tolerância a múltiplos fármacos e podem sobreviver ao tratamento com diversos antimicrobianos conhecidos. Além disso, algumas não são cultiváveis e o mecanismo de tolerância persistente é distinto dos mecanismos bem compreendidos de resistência a antibióticos.(12)
É possível observar esse fenômeno também no ambiente, uma vez que Persisters já foram detectadas em esgoto, trazendo riscos à saúde por conta de ineficácia no seu tratamento.(22) As pressões gerais enfrentadas por bactérias no ambiente incluem uma variedade de condições, como a necessidade de nutrientes frente sua escassez, estresse oxidativo, Quorum sensing, resposta a danos e à presença de antibióticos, induzindo a formação de células persisters.(23)
Há evidências consideráveis em modelos in vivo, destacando a importância das persisters em prolongar o tempo de infecções. O papel potencial dessas células na recaída de processos infecciosos também é uma razão significativa para investigá-las.(24) As análises acerca das persisters são um grande desafio, mediante a transitoriedade e reversibilidade de tal estado fisiológico, assim como a pequena quantidade de material biológico que pode ser gerado a partir das raras células em relação ao restante das colônias.(25)
Durante muitos anos e por falta de investimentos na área, o foco dos estudos se concentrou em manipular populações bacterianas, geneticamente ou ambientalmente, aferindo as mudanças que essas manobras tinham em relação à comunidade bacteriana e na formação de persisters.(25)
Com o passar do tempo e da evolução tecnológica, tornou-se prioridade a pesquisa unicelular, uma vez que as persisters são uma parcela mínima da população microbiana. O uso de dispositivos microfluídicos associados à microscopia e citometria de fluxo tornou-se alternativa promissora. Com a utilização destes dispositivos, o isolamento unitário de bactérias foi possível, assim como acompanhar o comportamento individual usando microscopia de lapso de tempo e resultando em um mapeamento histórico das persisters.(24)
Persistência x Resistência
Existe ainda muita desinformação sobre o entendimento de persisters, principalmente no tocante à diferença entre este tipo de célula e a resistência. O fenômeno de persistência difere em alguns aspectos, tanto no nível populacional quanto no nível individual.(24) Podemos observar algumas destas diferenças na Figura 1.
No nível populacional, enquanto as colônias suscetíveis e as resistentes apresentam homogeneidade, as colônias que apresentam persistência são heterogêneas. Este fato ocorre por conta das células persisters serem minoria e estarem em latência, por consequência não se reproduzindo. Frente à exposição aos antimicrobianos, em disco-difusão, existe halo de inibição semelhante entre colônias suscetíveis e as que apresentam persistência. Em contrapartida, as resistentes exibem redução significativa do halo ou até a ausência do mesmo. Outra grande diferença é a cinética bacteriana após a exposição aos antimicrobianos.(24)
A curva de crescimento das colônias suscetíveis entra normalmente em declínio, terminando em morte de todas as colônias. Na curva de crescimento das resistentes, há crescimento contínuo e na curva das colônias contendo persisters, há um grande declínio causado pelas mortes das não-persisters, chegando depois a uma estabilização atribuída às células portadoras do fenômeno de persistência.(23-25)
No nível de célula única, as células persisters não apresentam estabilidade, pois não há transmissão de persistência para as próximas gerações. Assim como as células suscetíveis, as persisters não apresentam crescimento frente à exposição a antimicrobianos. Já as bactérias resistentes apresentam crescimento frente à exposição a antimicrobianos específicos.(23-25)
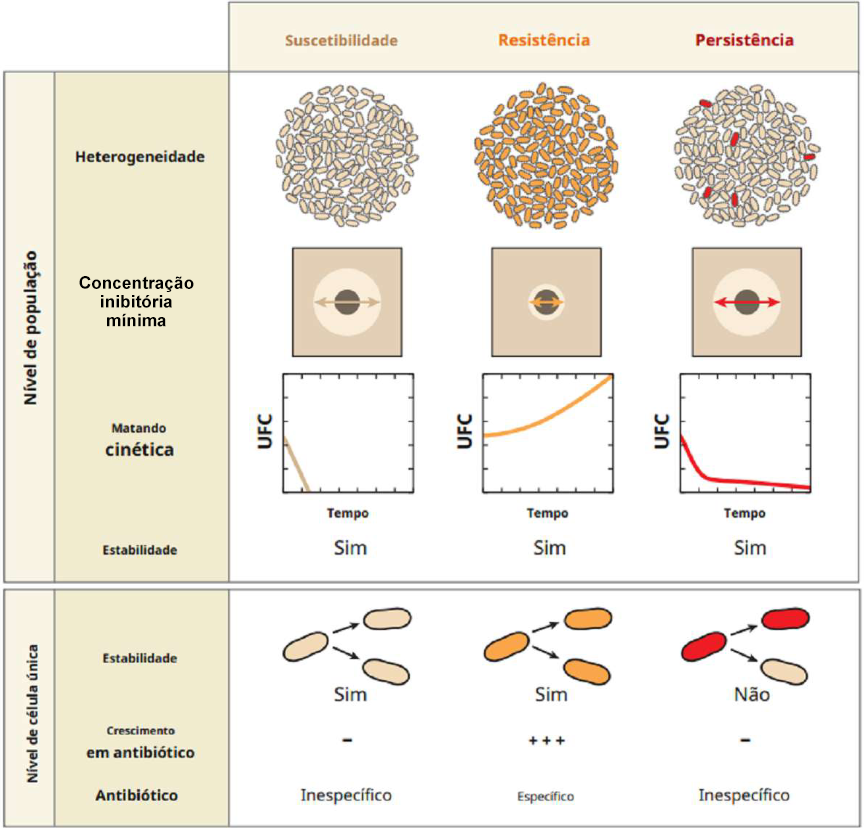
Figura 1
Diferenças populacionais e individuais entre suscetibilidade, resistência e persistência
Fonte: Adaptado de Gollan et al. (2019).(24)
CONCLUSÃO
Biofilme e persisters estão presentes no ambiente e também na clínica, sendo um desafio tanto detectá-los quanto tratar infecções associadas. Os estudos acerca dos tópicos abordados dão base para melhorar o entendimento associado à fisiopatologia e aos novos métodos diagnósticos adequados para a detecção in vitro e in vivo desta comunidade microbiana tão organizada, assim como o fenômeno de persistência e a diferença deste para a resistência aos antimicrobianos. Tais estudos são cruciais na compreensão de processos infecciosos crônicos e de difícil tratamento.
REFERÊNCIAS
- Das Sarma P, Antunes A, Simões MF, Das Sarma S. Earth’s Stratosphere and Microbial Life. Curr Issues Mol Biol. 2020; 38: 197-244.
- Gollan B, Grabe G, Michaux C, Helaine S. Bacterial Persisters and Infection: Past, Present, and Progressing. Annu Rev Microbiol. 2019; 73: 359-385.
- Castillo Pedraza MC, Novais TF, Faustoferri RC, Quivey RG, Terekhov A, Hamaker BR. Extracellular DNA and lipoteichoic acids interact with exopolysaccharides in the extracellular matrix of Streptococcus mutans biofilms. Biofouling. 2017; 33(9): 722-40.
- Lima JLC, Alves LR, Paz JNP, Rabelo MA, Maciel MAV, Morais MMC. Análise da produção de biofilme por isolados clínicos de Pseudomonas aeruginosa de pacientes com pneumonia associada à ventilação mecânica. Rev Bras Ter Intens. 2017; 29(3): 310-316.
- Rodrigues RL, Lima JLC, Sena KXFR, Maciel MAV. Phenotypic and genotypic analysis of biofilm production by Pseudomonas aeruginosa isolates from infection and colonization samples. Rev. Soc. Bras. Med Trop. 2020; 53, e20200399.
- Evelhoch SR. Biofilm and Chronic Nonhealing Wound Infections. Surg Clin North Am. 2020; 100(4): 727-732.
- Katongole P, Nalubega F, Florence NC, Asiimwe B, Andia I. Biofilm formation, antimicrobial susceptibility and virulence genes of Uropathogenic Escherichia coli isolated from clinical isolates in Uganda. BMC Infect Dis. 2020; 20(1): 453.
- Azevedo MM, Lisboa C, Cobrado L, Pina-Vaz C, Rodrigues A. Hard-to-heal wounds, biofilm and wound healing: an intricate interrelationship. Br J Nurs. 2020; 29(5): S6-S13.
- Bigger JW. Treatment of staphylococcal infections with penicillin by intermittent sterilization. Lancet. 1944; 244: 497-500.
- Amato SM, Brynildsen MP. Nutrient transitions are a source of persisters in Escherichia coli biofilms. PLoS One. 2014; 9(3):e93110.
- Tilahun M, Shimelis E, Wogayehu T, Assefa G, Wondimagegn G, Mekonnen A, Hailu T, et al. Molecular detection of multidrug resistance pattern and associated gene mutations in M. tuberculosis isolates from newly diagnosed pulmonary tuberculosis patients in Addis Ababa, Ethiopia. PLoS One. 2020; 15(8): e0236054.
- Lewis, K. Persister cells, dormancy and infectious disease. Nature Rev Microbiol. 2007; 5 (1): 48-56.
- Campoccia D, Mirzaei R, Montanaro L, Arciola CR. Hijacking of immune defences by biofilms: a multifront strategy. Biofouling. 2019; 35(10): 1055-1074.
- Stapels DAC, Hill PWS, Westermann AJ, Fisher RA; Thurston TL, Saliba AE, Blommestein I, et al. Salmonella persisters undermine host immune defenses during antibiotic treatment. Science. 2018; 362(6419): 1156-1160.
- Band VI, Crispell EK, Napier BA, Herrera CM, Tharp GK, Vavikolanu K, Pohl J, et al. Antibiotic failure mediated by a resistant subpopulation in Enterobacter cloacae. Nat Microbiol. 2016; 1(6): 16053.
- Alonso VPP, Palissari R, Cotta MA, Cesar CL, Kabuki, DY. Avaliação microscópica de superfícies de aço inoxidável usados em ensaios de biofilmes. Hig Alim. 2019; 2390-2395.
- Rowson C, Townsend R. Biofilms: prevention and treatment. Br J Hosp Med. 2016; 77(12): 699-703.
- Wu L, Luo Y. Bacterial quorum-sensing systems and their role in intestinal bacteria-host crosstalk. Front Microbiol. 2021; 12: 611413.
- Caixeta MA, Braga A, Almeida D, Pinto O, Santana E, Naves P. Estudo da formação de biofilmes por Pseudomonas aeruginosa. Encicl Biosf. 2019; 16(29).
- Da Silva SAO, Martins FS, Da Silva AS, Ghelen MH, Diaz CMG, Martins ESR. O enfermeiro no diagnóstico e tratamento de biofilme em feridas. Disc Scien | Saúde. 2018; 19(2), 281-290.
- Vermelho AB, Bastos MCF, Sá MHB. Bacteriologia geral. Rio de Janeiro: Guanabara Koogan, 2008.
- Liu X, Tang R, Li H, Wang L, Wan C. The physiological and ecological properties of bacterial persisters discovered from municipal sewage sludge and the potential risk. Environ Res. 2022; 205: 112481.
- Kim JS, Chowdhury N, Yamasaki R, Wood TK. Viable but non‐culturable and persistence describe the same bacterial stress state. Environ Microbiol. 2018; 20(6): 2038-2048.
- Gollan B, Grabe G, Michaux C, Helaine S. Bacterial persisters and infection: past, present, and progressing. Annu Rev Microbiol. 2019; 73: 359-385.
- Van den Bergh B, Fauvart M, Michiels J. Formation, physiology, ecology, evolution and clinical importance of bacterial persisters. FEMS Microbiol. Rev. 2017. 41(3):219-51.
Correspondência
Jaime Antonio Abrantes
E-mail: [email protected]
