Avaliação do desenvolvimento de anticorpos com potencial neutralizante para SARS-CoV-2 em indivíduos de uma cidade do meio-oeste catarinense
Evaluation of the development of antibodies with neutralizing potential to SARS-CoV-2 in individuals of a city in the middlewest of Santa Catarina
Flavia Debiasi Tessari1, Bruna Amanda Girardi2
1 Universidade do Oeste de Santa Catarina – UNOESC, Farmácia. Videira, SC, Brasil.
2 Doutora. Universidade do Oeste de Santa Catarina – UNOESC. Videira, SC, Brasil.
Recebido em 27/09/2022
Aprovado em 19/12/2022
DOI: 10.21877/2448-3877.202200075
INTRODUÇÃO
Em dezembro de 2019, na cidade de Wuhan, que pela primeira vez foi notificada uma pessoa com a COVID-19, doença causada pelo vírus SARS-CoV-2, nunca detectada em humanos.(1) Em janeiro de 2020, a OMS (Organização Mundial de Saúde) declarou Emergência de Saúde Pública de Importância Internacional e, em março de 2020, situação de pandemia causada pelo vírus.(2) A partir destas declarações, o mundo entrou em estado de alerta, alguns países começaram a realizar planos de contingência antes mesmo de serem afetados pelo SARS-CoV-2, visto a rápida disseminação do vírus.(3) O SARS-CoV-2 pode causar uma síndrome respiratória aguda grave e a infecção pode ter como principais sintomas: dores no corpo, na garganta, cefaleia, febre, cansaço, tosse, dispneia, congestão nasal, vômitos, náusea, diarreia, desconforto respiratório, taquipneia e hipoxemia.(4) Idosos, pessoas com comorbidades ou imunossuprimidos apresentam maior probabilidade de rápida progressão da infecção, levando a uma considerável piora no quadro clínico, fazendo-se necessário urgentemente o tratamento hospitalar.(5)
No Brasil, poucos meses após o início da pandemia, em abril de 2020, já havia mais de 21 mil casos confirmados e 1,2 mil mortes pela COVID-19.(6) Em julho de 2022, o país já contabilizava mais de 672 mil óbitos e 32 milhões de casos confirmados.(7) Com mais de 5,1 milhões de lares em condições precárias, sem saneamento básico, com aglomeração de pessoas(8) e sem uma estratégia pré-definida para a contingência da COVID-19, o Brasil teve ainda mais dificuldade para conter a disseminação.(9) Além dos impactos econômicos, sanitários, sociais e políticos, a pandemia trouxe para o dia a dia da população algumas mudanças de vida, antes pouco conhecidas, como quarentena, isolamento social, distanciamento e vários métodos que tentavam prevenir o contágio com o vírus causador da infecção.(10)
Embora ainda não se tenha conhecimento de um medicamento eficaz contra o coronavírus, em janeiro de 2021, o Brasil iniciou a distribuição de imunizantes contra o vírus, sendo que os primeiros grupos a receberem a imunização foram os profissionais da saúde que estavam na linha de frente de combate à infecção, idosos institucionalizados (acima de 60 anos), pessoas institucionalizadas acometidas por alguma deficiência e a população indígena.(11) Atualmente, quatro imunizantes contra a COVID-19 são autorizadas pela ANVISA (Agência Nacional de Vigilância Sanitária) para uso no Brasil: CoronaVac (Butantan), Oxford/Covishield (Fiocruz e AstraZeneca), Comirnaty (Pfizer/Wyeth) e Janssen Vaccine (Janssen-Cilag).(12) Neste artigo, esses imunizantes serão chamados respectivamente de: CoronaVac, AstraZeneca, Pfizer e Janssen.
Cada imunizante tem uma tecnologia diferente, mas todos têm a mesma função: instigar o sistema imune inato e a produção de anticorpos (ou imunoglobulinas) contra a SARS-CoV-2.(13) Sendo assim, o imunizante CoronaVac tem como antígeno o vírus inativado, o da AstraZeneca tem como tecnologia de antígeno o vetor adenovírus recombinante, o imunizante da Pfizer faz uso da tecnologia RNA mensageiro sintético e o da Janssen utiliza vetores de adenovírus sorotipo 26 (Ad26), um vírus que foi alterado geneticamente, com a intenção de que ele leve o gene da proteína Spike, encontrada na porção exterior do SARS-CoV-2, a qual concede o acesso do vírus nas células humanas.(14)
Apesar de alguns imunizantes não apresentarem seu principal mecanismo de indução de defesa contra o vírus através da produção de anticorpos, estes são os principais mediadores do processo de defesa pela maior parte dos imunizantes disponíveis.(13) Popularmente, a produção do anticorpo IgM indica que há uma infecção na fase aguda; IgG positivo significa que já houve contato prévio com o vírus em algum momento, mas o vírus não está mais ativo, restando apenas esta imunoglobulina que carrega a memória imunológica e é capaz de identificar o vírus se houver um novo contato.(15) Já os anticorpos com potencial neutralizante (nAB) são imunoglobulinas da classe das IgG capazes de neutralizar ou bloquear a entrada do SARS-CoV-2 na célula humana.(16) Na COVID-19, eles bloqueiam a interação entre o domínio receptor obrigatório (RBD) da proteína Spike (S) e a proteína ECA-2 (do inglês, angiotensin-converting enzyme 2), que dependendo da quantidade disponível na superfície da célula pode aumentar o risco de infecção e até mesmo colaborar para um pior prognóstico da doença.(17)
Entretanto, os testes detecção de IgG e IgM atuais (mesmo os que usam as proteínas S1, RBD e S2 como alvo) não pesquisam a eficácia da função neutralizante destes anticorpos.(18) Portanto, a presença desses anticorpos não necessariamente garante a neutralização do vírus, pois a sua existência não significa a presença da eficácia da função neutralizante.(19) Khoury e colaboradores(20) demostraram que o nível de anticorpos neutralizantes produzidos por sete imunizantes disponíveis no mercado mundial (Moderna, Novavax, Pfizer-BioNTech, Sputnik, AstraZeneca, Jonhson & Jonhson e CoronaVac) pode predizer proteção imunológica contra infecções sintomáticas pelo SARS-CoV-2, além de proteger contra o agravamento da COVID-19.
Portanto, no intuito de fornecer dados clínicos acerca dos níveis de anticorpos com potencial neutralizante induzidos por imunizantes ou pelo contato com o vírus SARS-CoV-2, o objetivo do presente estudo foi avaliar os níveis desses anticorpos em indivíduos não imunizados e sem infecção prévia, não imunizados com infecção prévia, imunizados com CoronaVac, AstraZeneca, Pfizer e Janssen sem infecção prévia e imunizados com infecção prévia em uma cidade do meio-oeste de Santa Catarina, Brasil.
MATERIAL E MÉTODOS
Foi realizado um levantamento de dados de prontuário, de caráter quantitativo, em um laboratório privado de análises clínicas em uma cidade do meio-oeste de Santa Catarina, com o objetivo de avaliar os níveis de anticorpos com potencial neutralizante para SARS-CoV-2, a fim de detectar qual imunizante apresentou o melhor desempenho em relação ao desenvolvimento destes anticorpos nos grupos pesquisados (não imunizados e sem infecção prévia; não imunizados com infecção prévia; imunizados com as vacinas CoronaVac, AstraZeneca, Pfizer e Janssen sem infecção prévia; e imunizados com infecção prévia).
O laboratório que forneceu os dados realiza o exame de imunoensaio fluorescente para determinação quantitativa de anticorpos neutralizantes circulantes contra SARS-CoV-2 em amostras de soro e registra os dados de todos os pacientes testados, com autorização dos pacientes através de um termo titulado como “Termo de autorização para realização do teste de COVID-19 – anticorpos neutralizantes”. Neste Termo eram preenchidos dados pessoais do paciente como sexo, idade, nome da vacina administrada na primeira e na segunda dose, as respectivas datas de cada dose, quantos dias após a administração da última dose da vacina o paciente estava coletando o exame, se o paciente já havia testado positivo para COVID-19 e, se sim, há quanto tempo, bem como o resultado obtido de anticorpos neutralizantes após a execução do exame. Todos esses dados foram inseridos em uma planilha de Excel e posteriormente tratados através do programa de estatística GraphPad-Prism (versão 7.0).
As tabelas 1, 2, 3, 4 e 5 demonstram os dados levantados dos prontuários dos pacientes, categorizando se o indivíduo foi vacinado ou não e, se sim, com qual vacina, se apresentou histórico anterior para SARS-CoV-2, qual o sexo, qual a faixa etária (dividida em 0-18 anos, 19-40 anos, 41-60 anos e mais de 60 anos). Também a quantidade de indivíduos e a média de anticorpos com potencial neutralizante para cada subgrupo.
Os dados referentes às datas de administração da dose de cada vacina (para os grupos vacinados) e os dados referentes à data de positivação para COVID-19 (para os grupos com histórico) foram preenchidos de forma incompleta pelos pacientes no termo disponibilizado pelo laboratório. Isso impossibilitou o levantamento desses dados para a utilização com fidedignidade no artigo.
Foram preservados nomes dos pacientes que tiveram os prontuários analisados, visto que essa pesquisa teve caráter retrospectivo por se tratar de levantamento de dados prontuários/laudos/exames ou similar, os quais foram mantidos sob sigilo, em conformidade com o que prevê os termos da Resolução 466/12 do Conselho Nacional de Saúde. O presente estudo foi autorizado pelo CEP (Comitê de Ética em Pesquisa) da Fundação Universidade do Oeste de Santa Catarina, sob o CAAE: 53144421.6.0000.5367, Parecer nº 5.134.503.
Tabela 1
Indivíduos não vacinados, com e sem histórico para SARS-CoV-2, dos sexos feminino e masculino, subdivididos em categorias de idade de 0-18, 19-40, 41-60 e mais de 60 anos, bem como a quantidade de indivíduos testados e a porcentagem (%) de anticorpos com potencial neutralizante obtido por cada grupo.
| Sem vacina | |||||
| Vacinado ou não? | Histórico de SARS-Cov-2? | Sexo | Idade | Indivíduos testados | Média de % de nAB |
| Não vacinado | Sem histórico | Feminino | 0 – 18 anos | 10 | 0% |
| Não vacinado | Sem histórico | Feminino | 19 – 40 anos | 06 | 3% |
| Não vacinado | Sem histórico | Feminino | 41 – 60 anos | 02 | 23% |
| Não vacinado | Sem histórico | Feminino | > 60 anos | 0 | x |
| Não vacinado | Sem histórico | Masculino | 0 – 18 anos | 06 | 14% |
| Não vacinado | Sem histórico | Masculino | 19 – 40 anos | 05 | 14% |
| Não vacinado | Sem histórico | Masculino | 41 – 60 anos | 05 | 35% |
| Não vacinado | Sem histórico | Masculino | > 60 anos | 02 | 24% |
| Não vacinado | Com histórico | Feminino | 0 – 18 anos | 0 | X |
| Não vacinado | Com histórico | Feminino | 19 – 40 anos | 0 | X |
| Não vacinado | Com histórico | Feminino | 41 – 60 anos | 01 | 51% |
| Não vacinado | Com histórico | Feminino | > 60 anos | 0 | X |
| Não vacinado | Com histórico | Masculino | 0 – 18 anos | 02 | 6% |
| Não vacinado | Com histórico | Masculino | 19 – 40 anos | 0 | x |
| Não vacinado | Com histórico | Masculino | 41 – 60 anos | 07 | 45% |
| Não vacinado | Com histórico | Masculino | > 60 anos | 0 | x |
Tabela 2
Indivíduos imunizados com CoronaVac, com uma a três doses, com e sem histórico para SARS-CoV-2, dos sexos feminino e masculino, subdivididos em categorias de idade de 0-18, 19-40, 41-60 e mais de 60 anos, bem como a quantidade de indivíduos testados e a porcentagem (%) de anticorpos com potencial neutralizante obtido por cada grupo.
| Coronavac | ||||||
| Vacinado ou não? | Quantas doses? | Histórico de SARS-Cov-2? | Sexo | Idade | Indivíduos testados | Média de % de nAB |
| Vacinado | 1 dose | Sem histórico | Feminino | 0 – 18 anos | 0 | x |
| Vacinado | 1 dose | Sem histórico | Feminino | 19 – 40 anos | 0 | x |
| Vacinado | 1 dose | Sem histórico | Feminino | 41 – 60 anos | 0 | x |
| Vacinado | 1 dose | Sem histórico | Feminino | > 60 anos | 0 | x |
| Vacinado | 1 dose | Sem histórico | Masculino | 0 – 18 anos | 0 | x |
| Vacinado | 1 dose | Sem histórico | Masculino | 19 – 40 anos | 0 | x |
| Vacinado | 1 dose | Sem histórico | Masculino | 41 – 60 anos | 0 | x |
| Vacinado | 1 dose | Sem histórico | Masculino | > 60 anos | 0 | x |
| Vacinado | 2 doses | Sem histórico | Feminino | 0 – 18 anos | 01 | 98,80% |
| Vacinado | 2 doses | Sem histórico | Feminino | 19 – 40 anos | 20 | 78% |
| Vacinado | 2 doses | Sem histórico | Feminino | 41 – 60 anos | 08 | 75,84% |
| Vacinado | 2 doses | Sem histórico | Feminino | > 60 anos | 33 | 50,93% |
| Vacinado | 2 doses | Sem histórico | Masculino | 0 – 18 anos | 01 | 99,90% |
| Vacinado | 2 doses | Sem histórico | Masculino | 19 – 40 anos | 05 | 33% |
| Vacinado | 2 doses | Sem histórico | Masculino | 41 – 60 anos | 08 | 44% |
| Vacinado | 2 doses | Sem histórico | Masculino | > 60 anos | 14 | 34,74% |
| Vacinado | 3 doses | Sem histórico | Feminino | 0 – 18 anos | 0 | x |
| Vacinado | 3 doses | Sem histórico | Feminino | 19 – 40 anos | 09 | 96,12% |
| Vacinado | 3 doses | Sem histórico | Feminino | 41 – 60 anos | 06 | 96,20% |
| Vacinado | 3 doses | Sem histórico | Feminino | > 60 anos | 02 | 89,10% |
| Vacinado | 3 doses | Sem histórico | Masculino | 0 – 18 anos | 01 | 99,50% |
| Vacinado | 3 doses | Sem histórico | Masculino | 19 – 40 anos | 05 | 94,10% |
| Vacinado | 3 doses | Sem histórico | Masculino | 41 – 60 anos | 02 | 99,55% |
| Vacinado | 3 doses | Sem histórico | Masculino | > 60 anos | 01 | 90,90% |
| Vacinado | 1 dose ou mais | Com histórico | Feminino | 0 – 18 anos | 0 | x |
| Vacinado | 1 dose ou mais | Com histórico | Feminino | 19 – 40 anos | 32 | 89,15% |
| Vacinado | 1 dose ou mais | Com histórico | Feminino | 41 – 60 anos | 10 | 94,07% |
| Vacinado | 1 dose ou mais | Com histórico | Feminino | > 60 anos | 08 | 91,89% |
| Vacinado | 1 dose ou mais | Com histórico | Masculino | 0 – 18 anos | 01 | 99,80% |
| Vacinado | 1 dose ou mais | Com histórico | Masculino | 19 – 40 anos | 05 | 84,78% |
| Vacinado | 1 dose ou mais | Com histórico | Masculino | 41 – 60 anos | 0 | x |
| Vacinado | 1 dose ou mais | Com histórico | Masculino | > 60 anos | 05 | 68,42% |
Tabela 3
Indivíduos imunizados com AstraZeneca, com uma a três doses, com e sem histórico para SARS-CoV-2, dos sexos feminino e masculino, subdivididos em categorias de idade de 0-18, 19-40, 41-60 e mais de 60 anos, bem como a quantidade de indivíduos testados e a porcentagem (%) de anticorpos com potencial neutralizante obtido por cada grupo.
| AstraZeneca | ||||||
| Vacinado ou não? | Quantas doses? | Histórico de SARS-Cov-2? | Sexo | Idade | Indivíduos testados | Média de % de nAB |
| Vacinado | 1 dose | Sem histórico | Feminino | 0 – 18 anos | 05 | 27,98% |
| Vacinado | 1 dose | Sem histórico | Feminino | 19 – 40 anos | 02 | 3,75% |
| Vacinado | 1 dose | Sem histórico | Feminino | 41 – 60 anos | 02 | 5,35% |
| Vacinado | 1 dose | Sem histórico | Feminino | > 60 anos | 02 | 60,85% |
| Vacinado | 1 dose | Sem histórico | Masculino | 0 – 18 anos | 0 | x |
| Vacinado | 1 dose | Sem histórico | Masculino | 19 – 40 anos | 01 | 98,90% |
| Vacinado | 1 dose | Sem histórico | Masculino | 41 – 60 anos | 01 | 0% |
| Vacinado | 1 dose | Sem histórico | Masculino | > 60 anos | 01 | 0% |
| Vacinado | 2 doses | Sem histórico | Feminino | 0 – 18 anos | 0 | x |
| Vacinado | 2 doses | Sem histórico | Feminino | 19 – 40 anos | 05 | 86,14% |
| Vacinado | 2 doses | Sem histórico | Feminino | 41 – 60 anos | 11 | 74,63% |
| Vacinado | 2 doses | Sem histórico | Feminino | > 60 anos | 04 | 45,15% |
| Vacinado | 2 doses | Sem histórico | Masculino | 0 – 18 anos | 0 | x |
| Vacinado | 2 doses | Sem histórico | Masculino | 19 – 40 anos | 06 | 53,10% |
| Vacinado | 2 doses | Sem histórico | Masculino | 41 – 60 anos | 02 | 32% |
| Vacinado | 2 doses | Sem histórico | Masculino | > 60 anos | 05 | 45,76% |
| Vacinado | 3 doses | Sem histórico | Feminino | 0 – 18 anos | 0 | x |
| Vacinado | 3 doses | Sem histórico | Feminino | 19 – 40 anos | 12 | 81% |
| Vacinado | 3 doses | Sem histórico | Feminino | 41 – 60 anos | 07 | 92,31% |
| Vacinado | 3 doses | Sem histórico | Feminino | > 60 anos | 03 | 72,23% |
| Vacinado | 3 doses | Sem histórico | Masculino | 0 – 18 anos | 0 | x |
| Vacinado | 3 doses | Sem histórico | Masculino | 19 – 40 anos | 02 | 99,30% |
| Vacinado | 3 doses | Sem histórico | Masculino | 41 – 60 anos | 05 | 66,80% |
| Vacinado | 3 doses | Sem histórico | Masculino | > 60 anos | 02 | 68,50% |
| Vacinado | 1 dose ou mais | Com histórico | Feminino | 0 – 18 anos | 0 | X |
| Vacinado | 1 dose ou mais | Com histórico | Feminino | 19 – 40 anos | 06 | 97,15% |
| Vacinado | 1 dose ou mais | Com histórico | Feminino | 41 – 60 anos | 13 | 85,08% |
| Vacinado | 1 dose ou mais | Com histórico | Feminino | > 60 anos | 05 | 95,71% |
| Vacinado | 1 dose ou mais | Com histórico | Masculino | 0 – 18 anos | 0 | X |
| Vacinado | 1 dose ou mais | Com histórico | Masculino | 19 – 40 anos | 06 | 97,15% |
| Vacinado | 1 dose ou mais | Com histórico | Masculino | 41 – 60 anos | 11 | 90,81% |
| Vacinado | 1 dose ou mais | Com histórico | Masculino | > 60 anos | 02 | 99% |
Tabela 4
Indivíduos imunizados com Pfizer, com uma a três doses, com e sem histórico para SARS-CoV-2, dos sexos feminino e masculino, subdivididos em categorias de idade de 0-18, 19-40, 41-60 e mais de 60 anos, bem como a quantidade de indivíduos testados e a porcentagem (%) de anticorpos com potencial neutralizante obtido por cada grupo.
| Pfizer | ||||||
| Vacinado ou não? | Quantas doses? | Histórico de SARS-Cov-2? | Sexo | Idade | Indivíduos testados | Média de % de nAB |
| Vacinado | 1 dose | Sem histórico | Feminino | 0 – 18 anos | 0 | x |
| Vacinado | 1 dose | Sem histórico | Feminino | 19 – 40 anos | 0 | x |
| Vacinado | 1 dose | Sem histórico | Feminino | 41 – 60 anos | 0 | x |
| Vacinado | 1 dose | Sem histórico | Feminino | > 60 anos | 0 | x |
| Vacinado | 1 dose | Sem histórico | Masculino | 0 – 18 anos | 0 | x |
| Vacinado | 1 dose | Sem histórico | Masculino | 19 – 40 anos | 01 | 0% |
| Vacinado | 1 dose | Sem histórico | Masculino | 41 – 60 anos | 0 | x |
| Vacinado | 1 dose | Sem histórico | Masculino | > 60 anos | 0 | x |
| Vacinado | 2 doses | Sem histórico | Feminino | 0 – 18 anos | 01 | 99,80% |
| Vacinado | 2 doses | Sem histórico | Feminino | 19 – 40 anos | 11 | 75,73% |
| Vacinado | 2 doses | Sem histórico | Feminino | 41 – 60 anos | 06 | 72,93% |
| Vacinado | 2 doses | Sem histórico | Feminino | > 60 anos | 05 | 98,69% |
| Vacinado | 2 doses | Sem histórico | Masculino | 0 – 18 anos | 01 | 99,80% |
| Vacinado | 2 doses | Sem histórico | Masculino | 19 – 40 anos | 10 | 76% |
| Vacinado | 2 doses | Sem histórico | Masculino | 41 – 60 anos | 03 | 82,53% |
| Vacinado | 2 doses | Sem histórico | Masculino | > 60 anos | 01 | 61,90% |
| Vacinado | 3 doses | Sem histórico | Feminino | 0 – 18 anos | 0 | x |
| Vacinado | 3 doses | Sem histórico | Feminino | 19 – 40 anos | 09 | 94,97% |
| Vacinado | 3 doses | Sem histórico | Feminino | 41 – 60 anos | 01 | 96% |
| Vacinado | 3 doses | Sem histórico | Feminino | > 60 anos | 01 | 66% |
| Vacinado | 3 doses | Sem histórico | Masculino | 0 – 18 anos | 0 | x |
| Vacinado | 3 doses | Sem histórico | Masculino | 19 – 40 anos | 02 | 99,35% |
| Vacinado | 3 doses | Sem histórico | Masculino | 41 – 60 anos | 0 | x |
| Vacinado | 3 doses | Sem histórico | Masculino | > 60 anos | 0 | x |
| Vacinado | 1 dose ou mais | Com histórico | Feminino | 0 – 18 anos | 02 | 97,80% |
| Vacinado | 1 dose ou mais | Com histórico | Feminino | 19 – 40 anos | 14 | 95,60% |
| Vacinado | 1 dose ou mais | Com histórico | Feminino | 41 – 60 anos | 03 | 99% |
| Vacinado | 1 dose ou mais | Com histórico | Feminino | > 60 anos | 01 | 99,70% |
| Vacinado | 1 dose ou mais | Com histórico | Masculino | 0 – 18 anos | 0 | x |
| Vacinado | 1 dose ou mais | Com histórico | Masculino | 19 – 40 anos | 10 | 95,37% |
| Vacinado | 1 dose ou mais | Com histórico | Masculino | 41 – 60 anos | 03 | 99,50% |
| Vacinado | 1 dose ou mais | Com histórico | Masculino | > 60 anos | 01 | 99,70% |
Tabela 5
Indivíduos imunizados com Janssen, com uma a três doses, com e sem histórico para SARS-CoV-2, dos sexos feminino e masculino, subdivididos em categorias de idade de 0-18, 19-40, 41-60 e mais de 60 anos, bem como a quantidade de indivíduos testados e a porcentagem (%) de anticorpos com potencial neutralizante obtido por cada grupo.
| Janssen | ||||||
| Vacinado ou não? | Quantas doses? | Histórico de SARS-Cov-2? | Sexo | Idade | Indivíduos testados | Média de % de nAB |
| Vacinado | 1 dose | Sem histórico | Feminino | 0 – 18 anos | 04 | 56,63% |
| Vacinado | 1 dose | Sem histórico | Feminino | 19 – 40 anos | 04 | 56,60% |
| Vacinado | 1 dose | Sem histórico | Feminino | 41 – 60 anos | 04 | 57% |
| Vacinado | 1 dose | Sem histórico | Feminino | > 60 anos | 0 | x |
| Vacinado | 1 dose | Sem histórico | Masculino | 0 – 18 anos | 0 | x |
| Vacinado | 1 dose | Sem histórico | Masculino | 19 – 40 anos | 0 | x |
| Vacinado | 1 dose | Sem histórico | Masculino | 40 – 60 anos | 04 | 53,10% |
| Vacinado | 1 dose | Sem histórico | Masculino | > 60 anos | 0 | x |
| Vacinado | 2 doses | Sem histórico | Feminino | 0 – 18 anos | 0 | x |
| Vacinado | 2 doses | Sem histórico | Feminino | 19 – 40 anos | 0 | x |
| Vacinado | 2 doses | Sem histórico | Feminino | 41 – 60 anos | 0 | x |
| Vacinado | 2 doses | Sem histórico | Feminino | > 60 anos | 0 | x |
| Vacinado | 2 doses | Sem histórico | Masculino | 0 – 18 anos | 0 | x |
| Vacinado | 2 doses | Sem histórico | Masculino | 19 – 40 anos | 02 | 64,30% |
| Vacinado | 2 doses | Sem histórico | Masculino | 41 – 60 anos | 0 | x |
| Vacinado | 2 doses | Sem histórico | Masculino | > 60 anos | 0 | x |
| Vacinado | 3 doses | Sem histórico | Feminino | 0 – 18 anos | 0 | x |
| Vacinado | 3 doses | Sem histórico | Feminino | 19 – 40 anos | 0 | x |
| Vacinado | 3 doses | Sem histórico | Feminino | 41 – 60 anos | 0 | x |
| Vacinado | 3 doses | Sem histórico | Feminino | > 60 anos | 0 | x |
| Vacinado | 3 doses | Sem histórico | Masculino | 0 – 18 anos | 0 | x |
| Vacinado | 3 doses | Sem histórico | Masculino | 19 – 40 anos | 0 | x |
| Vacinado | 3 doses | Sem histórico | Masculino | 41 – 60 anos | 0 | x |
| Vacinado | 3 doses | Sem histórico | Masculino | > 60 anos | 0 | x |
| Vacinado | 1 dose ou mais | Com histórico | Feminino | 0 – 18 anos | 0 | x |
| Vacinado | 1 dose ou mais | Com histórico | Feminino | 19 – 40 anos | 01 | 99,10% |
| Vacinado | 1 dose ou mais | Com histórico | Feminino | 41 – 60 anos | 05 | 86,28% |
| Vacinado | 1 dose ou mais | Com histórico | Feminino | > 60 anos | 0 | x |
| Vacinado | 1 dose ou mais | Com histórico | Masculino | 0 – 18 anos | 0 | x |
| Vacinado | 1 dose ou mais | Com histórico | Masculino | 19 – 40 anos | 0 | x |
| Vacinado | 1 dose ou mais | Com histórico | Masculino | 41 – 60 anos | 02 | 80,80% |
| Vacinado | 1 dose ou mais | Com histórico | Masculino | > 60 anos | 0 | x |
RESULTADOS
Os resultados obtidos foram separados por vacinas, não considerando nesse estudo a quantidade de doses, o sexo e a idade dos pacientes.
A análise estatística da Figura 1, Mann-Whitney test, mostrou um aumento na porcentagem de detecção de anticorpos neutralizantes (P=0,0008) em pacientes com histórico de infecção prévia pela COVID-19 e sem imunização (n=10) em comparação com o grupo controle sem histórico e sem imunização (n=36).
A análise estatística da Figura 2, ANOVA de uma via, demonstrou que todos os imunizantes aumentaram a expressão de anticorpos neutralizantes detectados em indivíduos vacinados e sem histórico prévio de infecção pela COVID-19 [F(5,300) = 69,08; P = 0,0001]. A análise post-hoc (Dunn’s) revelou que os grupos imunizados com CoronaVac e AstraZeneca apresentaram menor porcentagem de anticorpos neutralizantes quando comparados aos imunizados com Pfizer.
A análise estatística da Figura 3, ANOVA de uma via, demonstrou que todos os imunizantes aumentaram a expressão de anticorpos neutralizantes detectados em indivíduos vacinados e com histórico prévio de infecção pela COVID-19 [F(5,166) = 27,25; P=0,0001].
A análise estatística da Figura 4, Mann-Whitney test, mostrou que há uma potencialização da produção de anticorpos neutralizantes em pacientes com histórico de infecção prévia pela COVID-19 e vacinados com os imunizantes CoronaVac e AstraZeneca em comparação com o grupo controle sem histórico de infecção pela COVID-19 e vacinados.
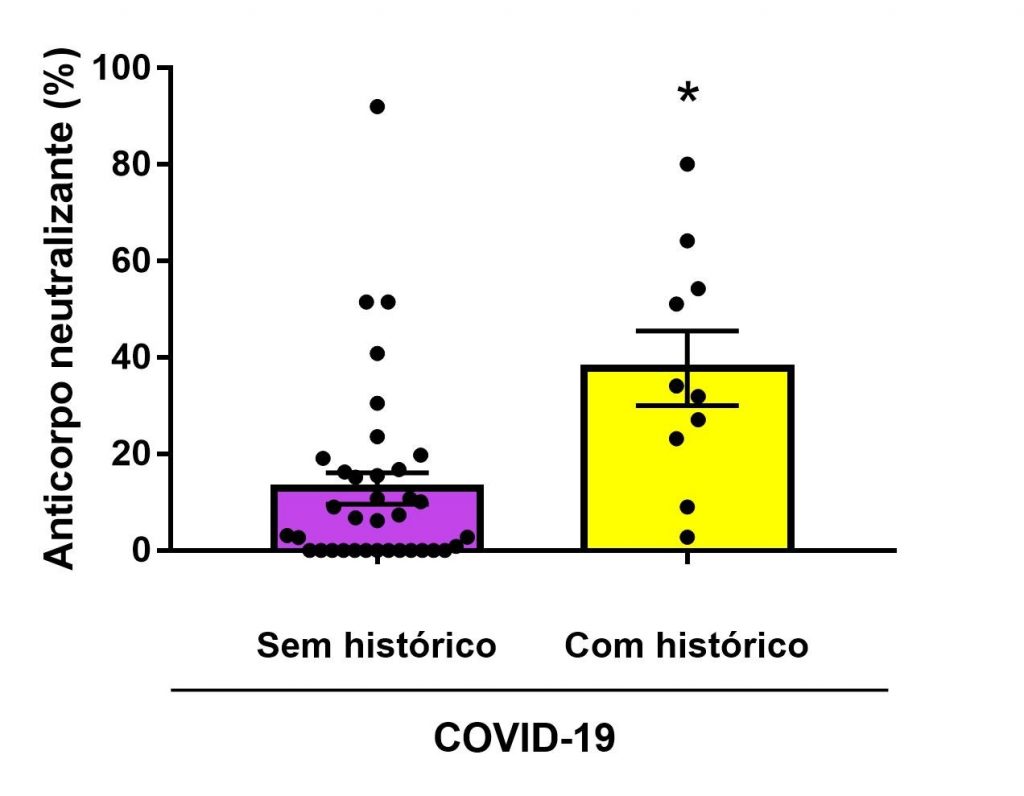
Figura 1
Níveis de anticorpos neutralizantes (%) para indivíduos não imunizados sem e com histórico de COVID-19. *p<0,05 comparado com o grupo controle (sem histórico de COVID-19).
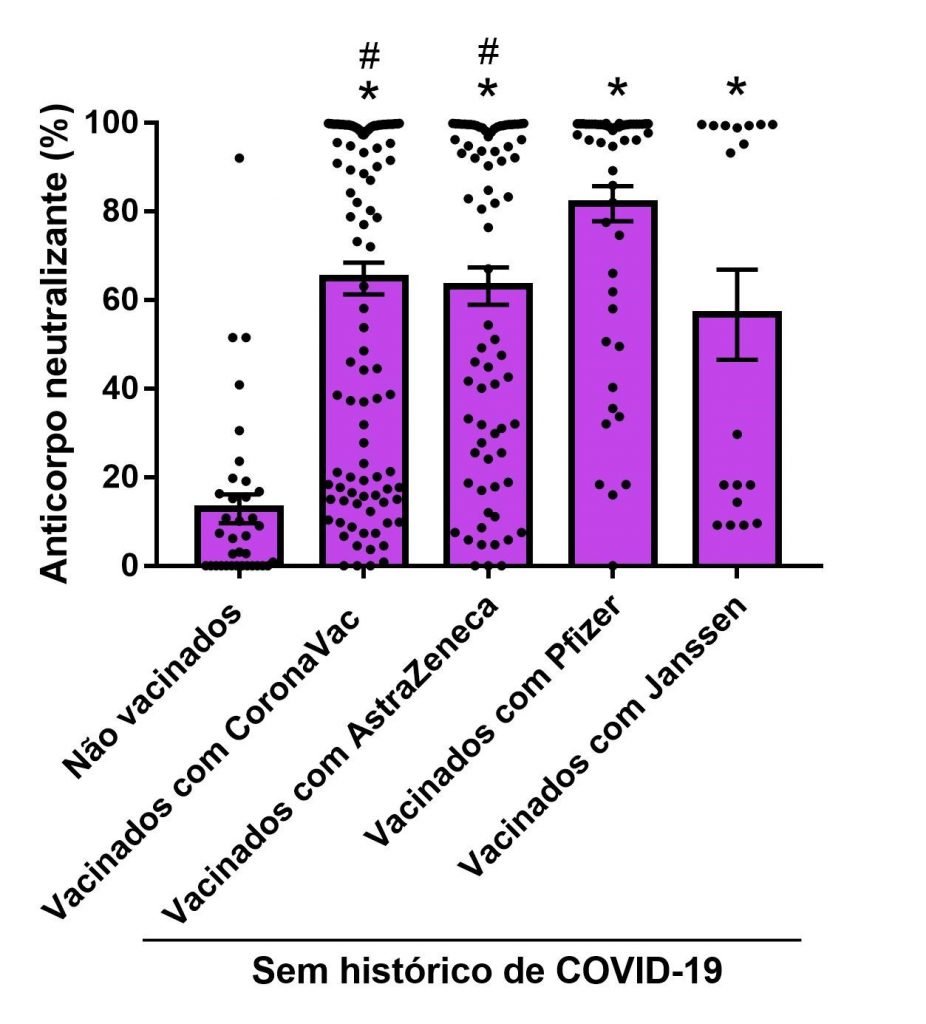
Figura 2
Níveis de anticorpos neutralizantes (%) para indivíduos vacinados e sem histórico de COVID-19. *p<0,05 comparado com grupo controle (sem histórico de COVID-19 e não vacinados); #p<0,05 comparado com o grupo sem histórico de COVID-19 e vacinados com Pfizer.
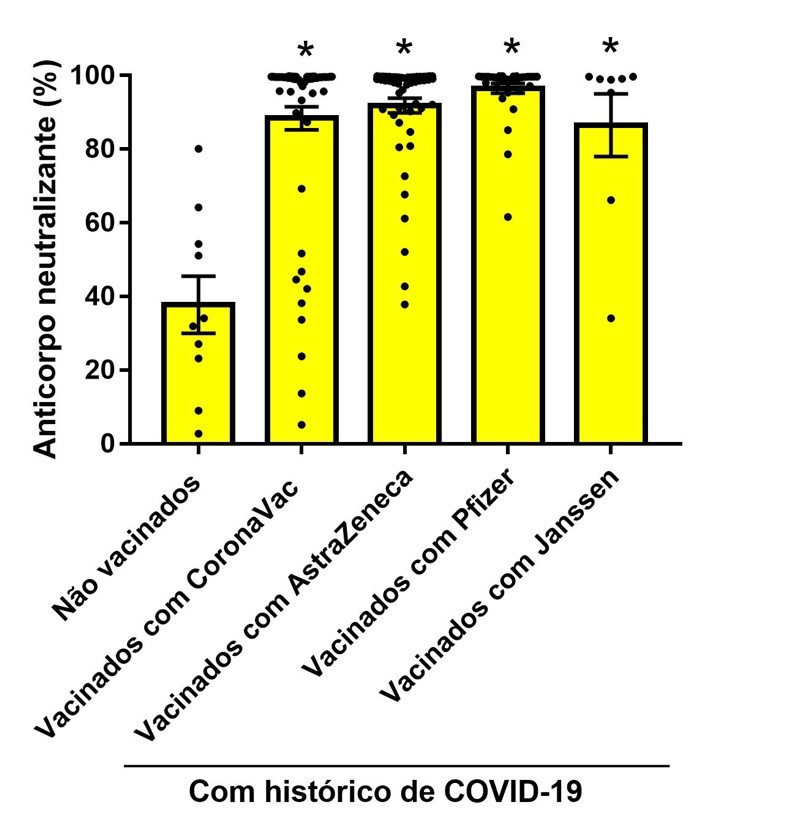
Figura 3
Níveis de anticorpos neutralizantes (%) para indivíduos com histórico de infecção prévia pela COVID-19 e que receberam imunização. *p<0,05 comparado com o grupo controle (com histórico de COVID-19 e não vacinados).
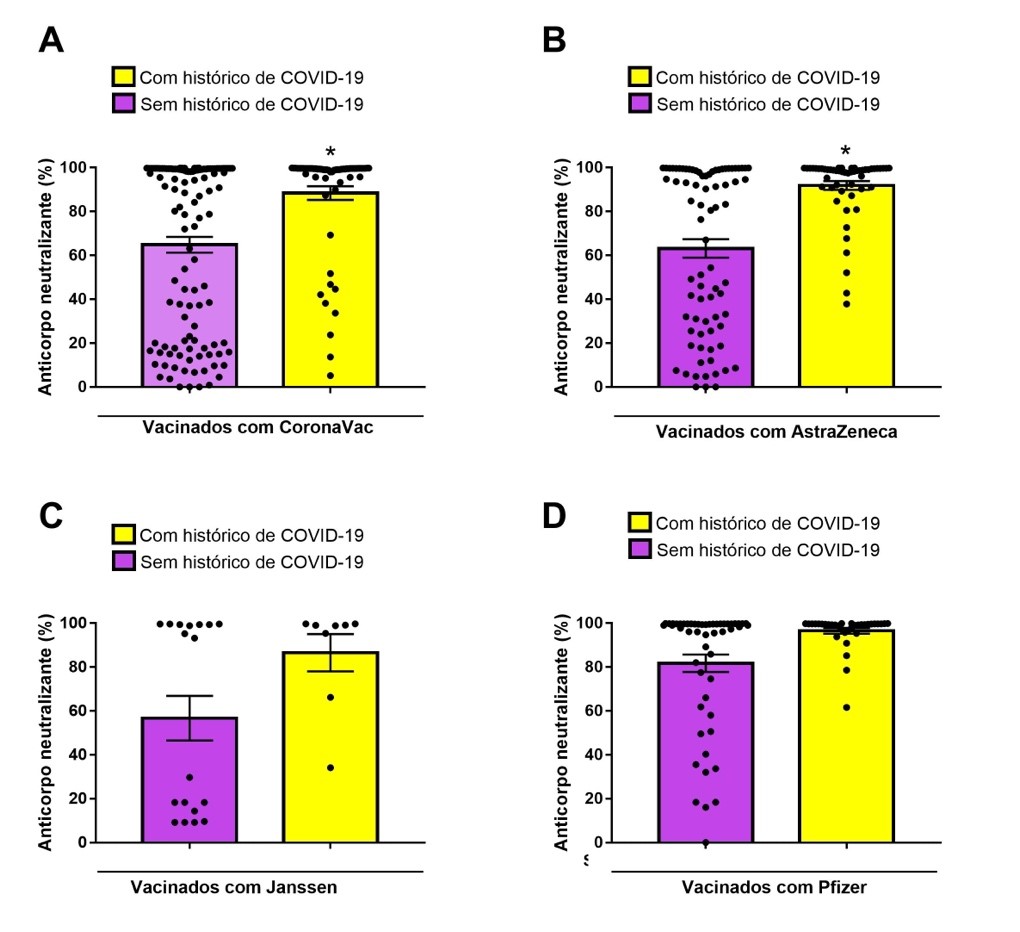
Figura 4
Níveis de anticorpos neutralizantes (%) para indivíduos sem e com histórico de COVID-19 vacinados com os imunizantes CoronaVac (A), AstraZeneca (B), Janssen (C) e Pfizer (D). *p<0,05 comparado com o grupo sem histórico de COVID-19.
DISCUSSÃO
O presente estudo avaliou a produção de nAB para o vírus SARS-CoV-2 através da análise de prontuários de 466 indivíduos que realizaram o teste para detecção em um laboratório privado de uma cidade do meio-oeste de Santa Catarina, Brasil. Sabe-se que é possível induzir a formação de anticorpos de defesa através da imunização ou pela infecção ocasionada pelo contato com o vírus, sendo que estes anticorpos têm papel importante principalmente no que diz respeito à prevenção e/ou minimização dos sintomas em uma nova infecção. (13)
A Figura 1 demonstra que indivíduos não imunizados, que se infectaram pelo SARS-CoV-2 e apresentaram a COVID-19 desenvolveram nAB, de acordo com os níveis considerados positivos (>20%) pela bula do teste de detecção (ECO Diagnóstica LTDA-F COVID nAB-FA 0057), em comparação com o grupo controle (indivíduos sem histórico de COVID-19 e não imunizados). Nesse sentido, estudos prévios corroboram nossos achados e demonstram que a COVID-19 ocasionada pela infecção prévia por SARS-CoV-2 leva ao desenvolvimento de anticorpos com potencial neutralizante na maioria dos indivíduos, visto que existem pessoas que não produzem os mesmos. (21)
Além disso, similaridades genéticas que promovem a síntese de proteínas comuns podem ser encontradas dentro da classe dos Sarbecovírus (classe a que pertence o SARS-CoV-2 e permitir que uma pessoa que entre em contato com algum vírus desta classe venha a desenvolver anticorpos com potencial neutralizante para o vírus e para outros vírus da mesma classe, caracterizando o que podemos chamar de reação cruzada.(16) Este fato pode explicar que indivíduos que não relatam infecção prévia pelo vírus apresentem algum nível de anticorpo detectado no teste conforme observamos nos resultados da Figura 1, mas não são considerados positivos pelo teste. Entretanto, também devemos considerar que a presença destes anticorpos pode ser observada pela exposição ao vírus SARS-CoV-2 que não chegou a levar ao desenvolvimento de uma infecção sintomática. (21,22)
O histórico de infecção pelo vírus SARS-CoV-2 apresenta muita relevância quanto ao total de anticorpos com potencial neutralizante produzidos.(21) Estudos demonstram que os anticorpos produzidos pela infecção natural têm uma maior vida útil no organismo, podendo ser detectados por até 1 ano e meio oferecendo proteção duradoura aos indivíduos contra uma nova infecção ou contra o agravamento dos sintomas em uma nova exposição.(23) Esse fato pode ser explicado, pois na infecção natural o sistema imune entra em contato com diferentes sítios antigênicos do patógeno vivo e na imunização, o patógeno se encontra morto ou inativado ou ainda o imunizante é desenvolvido com tecnologias que apresentam fragmentos de RNA viral (o que diminui os determinantes antigênicos) que serão reconhecidos pelas células do sistema imune inato para posterior possível soroconversão.(24)
As vacinas para o SARS-CoV-2 disponíveis atualmente podem estimular o organismo a produzir anticorpos contra o patógeno, e essas células de memória agem de forma rápida se o corpo for novamente exposto ao antígeno visando uma possível prevenção de nova infecção. Além disso, certas vacinas podem aumentar a produção de células do sistema imune inato como forma de proteção, e não necessariamente induzir a produção de anticorpos.(13) O resultado da Figura 2 demonstra que todos os imunizantes disponíveis hoje no Brasil (Pfizer, CoronaVac, Janssen e AstraZeneca) aumentaram a produção de nAB em indivíduos que foram vacinados e que alegaram não apresentar histórico de COVID-19 quando comparada à do grupo controle (não vacinados e sem histórico de COVID-19). Além disso, o imunizante Pfizer apresentou melhor desempenho quando comparado com o dos imunizantes CoronaVac e AstraZeneca. Estudos realizados nas diversas partes do mundo apontam que, apesar da rapidez com que foram produzidas, as vacinas disponíveis no Brasil são seguras e eficazes na produção de nAB, além de instigarem a produção de células do sistema imune inato. (25)
A Figura 3 demonstra que a imunização potencializa a produção de nAB em indivíduos que apresentam histórico prévio de infecção quando comparados à do grupo controle que não foi vacinado, mas apresenta histórico prévio de COVID-19. Consideramos que o grupo controle já é considerado positivo para nAB de acordo com o teste de detecção (>20%), pois já tiveram a doença e desenvolveram os anticorpos. Estudos prévios da literatura confirmam os achados encontrados e corroboram a informação de que a imunização em indivíduos que já tiveram a COVID-19 pode potencializar a produção de nAB. (26,27)
Nesse sentido, a Figura 4, A e B, demonstra que os imunizantes CoronaVac e AstraZeneca potencializam a produção de anticorpos com potencial neutralizante em indivíduos vacinados e com histórico prévio de COVID-19 quando em comparação com o grupo que recebeu o mesmo imunizante, mas não apresentava histórico prévio de COVID-19. O mesmo resultado não foi observado para os imunizantes Pfizer e Janssen, visto que não houve diferença significativa entre os grupos vacinados com histórico prévio e vacinados sem histórico prévio de COVID-19.
Apesar de nossos resultados demonstrarem que há uma produção maior desses anticorpos em indivíduos vacinados quando associada à positividade do paciente frente à infecção para alguns imunizantes, não se pode definir a quantidade de nAB produzida pela resposta imune natural e pela resposta vacinal neste estudo. Além disso, a falta de potencialização do efeito nas vacinas Pfizer e Janssen, quando comprados grupos imunizados com e sem histórico prévio, pode ser justificada de acordo com a literatura, pelo tempo transcorrido entre a imunização e o ensaio para a detecção de nAB visto que estudos demonstram que entre 3 e 6 meses após a aplicação dos imunizantes os níveis de anticorpos neutralizantes produzidos pela resposta vacinal decaem significativamente,(28,29) demonstrando a necessidade de administração de doses de reforço para manter os níveis de nAB circulantes.(30) Como estes imunizantes não eram administrados com múltiplas doses, a possibilidade de as dosagens de nAB terem sido realizadas após esse período poderia justificar os resultados encontrados.
Nesse sentido, no presente estudo não conseguimos separar os grupos por doses de imunizantes e tempo transcorrido entre a administração da última dose do imunizante, data da positivação para COVID-19 e a testagem em relação aos níveis de nAB visto que como se tratou de um estudo clínico com dados de prontuário, não tínhamos representantes de todos os grupos, conforme demonstrado nas tabelas 2, 3 e 4, como também os prontuários estavam incompletos em relação às datas das testagem e datas de aplicação de doses das vacinas e positivação para COVID-19.
CONCLUSÃO
A dosagem de nAB, apesar de não recomendada, e que foi mundialmente utilizada durante a pandemia de COVID-19, permite avaliar uma possível resposta do sistema imune adquirido gerada em cada indivíduo frente a uma infecção desenvolvida pela imunização ou pelo próprio contato com o patógeno, neste caso o SARS-CoV-2. Os resultados apresentados no presente estudo demonstraram que indivíduos com histórico prévio de COVID-19 e não imunizados possuem uma quantidade acima de 20% de nAB quando comparados a indivíduos que não foram infectados (<20%). Todas as vacinas pesquisadas mostraram uma eficiência a nível produção nAB em indivíduos sem e com histórico prévio de infecção, entretanto o imunizante Pfizer apresentou melhor desempenho, em indivíduos sem histórico de COVID-19, quando comparado ao imunizante CoronaVac e AstraZeneca. Além disso, os imunizantes CoronaVac e AstraZeneca potencializam a produção nAB em indivíduos com histórico prévio de COVID-19, quando comparada com a do grupo que recebeu imunizante, mas não apresentava histórico prévio de infecção.
Apesar de todos os imunizantes produzirem nAB, podemos concluir com os dados apresentados que há uma maior imunogenicidade, quando não há exposição prévia ao vírus, de imunizantes com tecnologia de RNA mensageiro sintético, mas isso não se reproduz quando já houve exposição e desenvolvimento de infecção natural. Quando já houve uma infecção natural, os imunizantes com vírus morto ou inativado potencializam a produção de nAB.
REFERÊNCIAS
- Gruber A. Covid-19: o que se sabe sobre a origem da doença. Jornal da USP. 2020. Disponível em: https://jornal.usp.br/artigos/covid2-o-que-se-sabe-sobre-a-origem-da-doenca/. (Acesso em: 12 dez. 2021).
- Ghebreyesus AT, Barbosa J. OMS declara emergência de saúde pública de importância internacional por surto de novo coronavírus. Organização Pan-Americana da Saúde (OPAS). 2020. Disponível em: https://www.paho.org/pt/news/30-1-2020-who-declares-public-health-emergency-novel-coronavirus. (Acesso em: 15 jan. 2022).
- Mathieu E, Ritchie H, Guirão LR, et al. Coronavirus Pandemic (Covid-19). Our World in data. 2020. Disponível em: https://ourworldindata.org/covid . (Acesso em: 18 set. 2022).
- Ministério da Saúde. Brasil. Covid-19 Painel de controle. 2020. Disponível em: https://covid.saude.gov.br/. (Acesso em: 01 de junho de 2022).
- Souza AT, Nunes AMV, Nascimento SCI, et al. Vulnerabilidade e fatores de risco associados para Covid-19 em idosos institucionalizados. Revista Eletrônica Acervo Saúde. 2021; v. 13, n. 2, p. 5947. Disponível em: https://acervomais.com.br/index.php/saude/article/view/5947. (Acesso em: 14 dez. 2021).
- Cota W. Monitorando o número de casos e óbitos por COVID-19 no brasil nos níveis municipal e das unidades federativas. Scielo. 2020; Preprint n. 362 (2020). Disponível em: https://preprints.scielo.org/index.php/scielo/preprint/view/362/444. (Acesso em: 03 jun. 2022).
- Ministério da saúde. Brasil. Covid-19 no Brasil. Disponível em: https://infoms.saude.gov.br/extensions/covid-19_html/covid-19_html.html. (Acesso em: 11 jul. 2022).
- Portal de notícias G1. Brasil tem mais de 5,1 milhões de domicílios em situação precária, aponta IBGE. 2022. Disponível em: https://g1.globo.com/bemestar/coronavirus/noticia/2020/05/19/brasil-tem-mais-de-51-milhoes-de-domicilios-em-situacao-precaria-aponta-ibge.ghtml. (Acesso em: 16 jan. 2022).
- Carvalho PD, Pochmann M, Moreira E, Bahia L, et al. Especialistas apontam as dificuldades do Brasil para enfrentar a pandemia e defendem sistema amplo e política industrial para a Saúde. COPPE UFRJ.2020. Disponível em: https://www.coppe.ufrj.br/pt-br/planeta-coppe-noticias/noticias/especialistas-apontam-dificuldades-do-brasil-para-enfrentar-a. (Acesso em: 12 ago. 2022).
- Oliveira N, Pires Y. Falta de normas claras e de ações coordenadas para distanciamento social prejudica combate à Covid. Agência do Senado. 2021. Disponível em: https://www12.senado.leg.br/noticias/infomaterias/2021/04/falta-de-normas-claras-e-de-acoes-coordenadas-para-distanciamento-social-prejudica-combate-a-covid. (Acesso em: 12 ago. 2022).
- Agência Brasil. Vacinação contra Covid-19 começa em todo país. 2021. Disponível em: https://agenciabrasil.ebc.com.br/saude/noticia/2021-01/vacinacao-contra-covid-19-come%C3%A7a-em-todo-o-pais. (Acesso em: 18 jul. 2022).
- Agência Nacional de Vigilância Sanitária ANVISA. Vacinas Covid-19. 2021. Disponível em: https://www.gov.br/anvisa/pt-br/assuntos/paf/coronavirus/vacinas. (Acesso em: 01 jul. 2022).
- Mangge H, Kneihsl M, Schnedl W, et al. Immune Responses against SARS-CoV-2-Questions and Experiences. Biomedicines. 2021; v. 9(10), n. 1342. Disponível em: https://www.mdpi.com/2227-9059/9/10/1342 (Acesso em: 15 jun. 2022).
- Lima FJE, Almeida MA, Kfouri AR. Vaccines for COVID-19 – state of the art. Revista Brasileira de Saúde Materno Infantil. 2021; v. 21, n. 1, p. 13-19. Disponível em: https://www.scielo.br/j/rbsmi/a/hF6M6SFrhX7XqLPmBTwFfVs/?lang=pt. (Acesso em: 20 ago. 2022).
- Teixeira SFC, Soares MC, Souza AE, et al. A saúde dos profissionais de saúde no enfrentamento da pandemia de Covid-19. Ciência & Saúde Coletiva. 2020; v. 25, n. 9, p. 3465-3474. Disponível em: https://www.scielosp.org/article/csc/2020.v25n9/3465-3474/. (Acesso em: 02 set. 2022).
- Song G, He WT, Callaghan S, et al. Cross-reactive serum and memory B cell responses to spike protein in SARS-CoV-2 and endemic coronavirus infection. National Library os Medice. 2020; n. 308965. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7523096/. (Acesso em: 15 abr. 2022).
- Nayak K, Gottimukkala K, Kumar S, et al. Characterization of neutralizing versus binding antibodies and memory B cells in COVID-19 recovered individuals from India. Virology. Science Direct. 2021; v. 558, p. 13-21. Disponivel em: https://pubmed.ncbi.nlm.nih.gov/33706207/. (Acesso em: 25 set. 2022).
- Brochot E, Demey B, Touzé A, et al. Anti-spike, Anti-nucleocapsid and Neutralizing Antibodies in SARS-CoV-2 Inpatients and Asymptomatic Individuals. Frontiers in Microbiology. 2020; v. 11, n. 584251. Disponível em: https://www.frontiersin.org/articles/10.3389/fmicb.2020.584251/full. (Acesso em: 04 set. 2022).
- Robbiani FD, Gaebler C, Muecksch F, et al. Convergent antibody responses to SARS-CoV-2 in convalescent individuals. Nature. 2020; v. 584, n. 7821, p. 437–442. Disponível em: http://dx.doi.org/10.1038/s41586-020-2456-9 (Acesso em: 07 set. 2022).
- Khoury DS, Cromer D, Reynaldi A, et al. Neutralizing antibodies levels are highly predictive of imune protection from symptomatic SARS-CoV-2 infection. Nat. Med. 2021; n. 27, p. 1205 – 1211. Disponível em: file:///C:/Users/flavi/Downloads/s41591-021-01377-8.pdf. (Acesso em: 22 jun. 2022).
- Amanat F, Stadlbauer D, Strohmeier S, et al. A serological assay to detect sars-cov-2 seroconversion in humans. Nat. Med. 2020; n. 26, p. 1033–1036. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32398876/. (Acesso em: 25 set. 2022).
- Oliveira PRS, Tavares NM. Resposta imune humoral na COVID – 19. In: Construção de conhecimento no curso da pandemia de COVID-19: Aspectos biomédicos, clínico-assistenciais, epidemiológicos e sociais. Salvador. Edufba. 2020; v.1. Disponível em: https://doi.org/10.9771/9786556300443.004 (Acesso em: 05 ago. 2022).
- De Las Infantas, IJMP. Cuánto nos va a durar la inmunidad frente al coronavirus? The Conversation. 2021; Disponível em: https://theconversation.com/cuanto-nos-va-a-durar-la-inmunidad-frente-al-coronavirus-162186. (Acesso em: 20 set. 2022).
- Blain H, Tuaillon E, Gamon L, et al. Spike Antibody Levels of Nursing Home Residents With or Without Prior COVID-19 3 Weeks After a Single BNT162b2 Vaccine Dose. JAMA. 2021; n. 325(18), p. 1898–1899. Disponível em:https://jamanetwork.com/journals/jama/fullarticle/2778926?utm_campaign=articlePDF&utm_medium=articlePDFlink&utm_source=articlePDF&utm_content=jama.2021.4388. (Acesso em: 20 maio de 2022).
- Brito OLL, Lima OT, Pinto RR, et al. A eficácia das vacinas anticovid-19 disponíveis no Brasil – Uma revisão integrativa / The effectiveness of anticovid-19 vaccines available in Brazil – An integrative review. Brazilian Journal Of Development. 2021; v. 7, n. 12, p. 113754-113767. Disponível em: https://brazilianjournals.com/ojs/index.php/BRJD/article/view/40922/pdf. (Acesso em: 05 set. 2022).
- Bellamkonda N, Lambe PU, Sawant S, et al. Immune Response to SARS-CoV-2 Vaccines. Biomedicines. 2022; v. 10, n. 1464. Disponível em: https://www.mdpi.com/2227-9059/10/7/1464 .(Acesso em: 25 set. 2022).
- Eroglu B, Nuwarda FR, Ranzam I, et al. A Narrative Review of COVID-19 Vaccines. National Library of Medicine. 2021; v. 10, n. 1, p. 62. Disponível em: https://pubmed.ncbi.nlm.nih.gov/35062723/. (Acesso em: 13 ago. 2022).
- Earle AK, Ambrosino MD, Gartland FA, et al. Evidence for antibody as a protective correlate for COVID-19 vaccines. Elsevier. 2021; v. 39 (32), p. 4423-4428. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8142841/pdf/main.pdf. (Acesso em 09 nov. 2022).
- Chen X, Chen X, Azman AS, et al. Neutralizing Antibodies Against Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Variants Induced by Natural Infection or Vaccination: A Systematic Review and Pooled Analysis. Oxford Academic. 2022; v. 74, n. 4, p. 734-742. Disponível em: https://academic.oup.com/cid/article/74/4/734/6327511. (Acesso em: 09 nov. 2022).
- Muecksch F, Wang Z, Cho A, et al. Increased Potency and Breadth of SARS-CoV-2 Neutralizing Antibodies After a Third mRNA Vaccine Dose. BioRxiv. 2022; v. 15. Disponível em: https://www.biorxiv.org/content/10.1101/2022.02.14.480394v1.full.pdf. (Acesso em: 09 nov. 2022).
Correspondência
Flavia Debiasi Tessari
E-mail: [email protected]
