Avaliação da função renal na doença renal crônica
Evaluation of renal function in chronic kidney disease
Janaína Rodrigues Porto1
Karina Braga Gomes2
Ana Paula Fernandes2
Caroline Pereira Domingueti2
1Farmacêutica. Faculdade de Farmácia – Universidade Federal de São João del-Rei – UFSJ – Divinópolis , MG, Brasil.
2Doutor. Faculdade de Farmácia – Universidade Federal de Minas Gerais – UFMG – Belo Horizonte, MG, Brasil.
Instituições: Departamento de Análises Clínicas e Toxicológicas, Faculdade de Farmácia, Campus Centro Oeste Dona Lindu – Universidade Federal de São João del-Rei – Divinópolis, MG, Brasil; Departamento de Análises Clínicas e Toxicológicas, Faculdade de Farmácia, Universidade Federal de Minas Gerais – Belo Horizonte, MG, Brasil.
Artigo recebido em 05/11/2014
Artigo aprovado em 07/10/2015
DOI: 10.21877/2448-3877.201500320
Resumo
O diagnóstico precoce da doença renal crônica (DRC) e a avaliação precisa do risco de progressão do declínio da função renal e do desenvolvimento de complicações cardiovasculares possuem extrema importância, já que o estabelecimento precoce de terapias reno e cardioprotetoras pode evitar ou retardar a ocorrência destes desfechos indesejáveis. Vários biomarcadores podem ser utilizados para a avaliação da função renal, como a creatinina, a proteinúria, a albuminúria, a cistatina C e o ritmo de filtração glomerular (RFG), o qual pode ser estimado através de equações baseadas na creatinina ou na cistatina C. Apesar de todos estes biomarcadores apresentarem limitações, a identificação da DRC e o monitoramento da função renal por meio da determinação da albuminúria associada à estimativa do RFG são muito importantes e úteis para a avaliação do prognóstico da doença renal e o estabelecimento de um tratamento adequado de acordo com a sua evolução.
Palavras-chave
Albuminúria; Cistatina C; Creatinina; Insuficiência renal crônica; Taxa de filtração glomerular
iNTRODUÇÃO
A doença renal crônica (DRC) consiste em uma complicação comum do diabetes mellitus e da hipertensão, os quais consistem nos principais fatores de risco para o seu desenvolvimento, e está associada com elevadas taxas de morbidade e mortalidade. Os pacientes que possuem um comprometimento da função renal representam não apenas um grupo de risco para a progressão da nefropatia e o desenvolvimento de doença renal terminal, mas também apresentam um risco aumentado de mortalidade cardiovascular.(1)
Vários biomarcadores podem ser utilizados para a avaliação da função renal, como a creatinina, a proteinúria, a albuminúria, a cistatina C e o ritmo de filtração glomerular (RFG), o qual pode ser estimado por meio de equações baseadas na creatinina e na cistatina C.(2) Contudo, todos estes biomarcadores apresentam limitações, de modo que ainda não existe um biomarcador ideal para a avaliação da função renal em diferentes grupos de pacientes em função do grau de comprometimento renal.(3)
Recentemente, a National Disease: Improving Global Outcomes (KDIGO) CKD Work Group publicou novas Diretrizes para o diagnóstico da DRC, avaliação da função renal e acompanhamento dos pacientes que possuem nefropatia. De acordo com estas Diretrizes, a função renal deve ser avaliada por meio da estimativa do RFG associada com a determinação da albuminúria, o que possibilita um melhor diagnóstico e uma avaliação mais confiável do risco de progressão da doença renal e do desenvolvimento de complicações.(4)
Este trabalho teve como objetivo fazer uma revisão da literatura sobre os novos critérios estabelecidos para o diagnóstico e estratificação da DRC e sobre as vantagens e limitações dos principais biomarcadores atualmente disponíveis para a avaliação da função renal.
Doença Renal Crônica
A DCR constitui um importante problema de saúde pública em todo o mundo. No Brasil, as taxas de prevalência e incidência de pacientes que necessitam realizar diálise têm apresentado um aumento progressivo.(5) Independente da etiologia da doença, os principais problemas em pacientes com DRC são as suas complicações (anemia, acidose metabólica, desnutrição e alteração do metabolismo de cálcio e fósforo) decorrentes da perda funcional dos rins, a doença renal terminal e o óbito (principalmente por eventos cardiovasculares).(6)
A DRC é atualmente definida como a presença de anormalidades da estrutura ou função dos rins, presentes por mais de três meses, com implicações para a saúde.(4) As novas Diretrizes do KDIGO(4) recomendam classificar a DRC baseando-se na causa, na categoria do RFG e na albuminúria, o que possibilita a identificação do risco de desfechos adversos, tais como a DRC progressiva, doença renal terminal, doença renal aguda, mortalidade por todas as causas e mortalidade cardiovascular.
Tradicionalmente, a classificação da DRC de acordo com a causa se baseia na presença ou ausência de doenças sistêmicas subjacentes, como diabetes mellitus, hipertensão arterial e doenças autoimunes; e também na localização anatomopatológica das anormalidades renais que podem acometer os glomérulos, o túbulo-interstício ou a vasculatura renal.(4) A classificação da DRC de acordo com a categoria do RFG e a albuminúria está apresentada no Quadro 1.
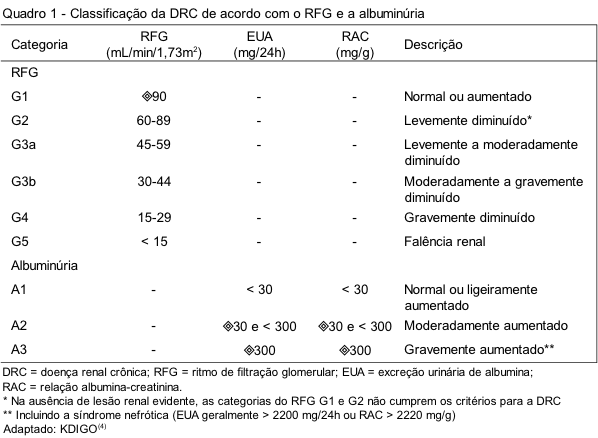
As novas Diretrizes do KDIGO(4) também definiram novos critérios para o diagnóstico da DRC, os quais consistem na presença de um ou mais marcadores de lesão do parênquima renal e/ou de um ritmo de filtração glomerular (RFG) inferior a 60 mL/min/1,73m2 durante um período maior do que três meses (Quadro 2).

Os principais grupos de risco para a DRC são: hipertensos; diabéticos; idosos (há uma diminuição fisiológica do RFG com o avanço da idade, além disso, ocorre o desenvolvimento de lesões renais secundárias a doenças crônicas, as quais são comuns em idosos); pacientes com doença cardiovascular; familiares de pacientes portadores de DRC; pacientes em uso de medicamentos nefrotóxicos.(6) Todo paciente pertencente a grupos de risco para DRC deve ser submetido a exames anuais para averiguar a presença de lesão renal e para estimar o nível de função renal glomerular por meio da determinação do RFG, para o devido controle e prevenção da DRC.(7)
Avaliação da Função Renal
Marcadores de lesão renal
Os marcadores de lesão renal possuem um papel muito importante para a detecção de anormalidades estruturais ou funcionais dos rins, as quais nem sempre resultam m declínio do RFG. Tais anormalidades podem ser detectadas por meio de exames histológicos ou de imagem; pela presença de distúrbios eletrolíticos ou outros decorrentes de lesões tubulares; pela presença de anormalidades no sedimento urinário, tais como células epiteliais tubulares, cilindros hemáticos, cilindros leucocitários, corpos graxos ovais, hemácias dismórficas, dentre outros; pela história de transplante renal, já que biópsias de rins transplantados apresentam anormalidades patológicas mesmo nos pacientes que não possuem declínio no RFG ou albuminúria; e por níveis aumentados de albuminúria e/ou proteinúria.(4)
A albuminúria e a proteinúria consistem nos principais marcadores laboratoriais de lesão do parênquima renal. A avaliação destes marcadores pode ser realizada em amostra de urina coletada durante 24 horas ou em amostra de urina isolada normalizada pela creatinina urinária. Esta normalização tem como finalidade corrigir possíveis erros decorrentes da diluição ou concentração da amostra de urina isolada. A relação albumina/creatinina (ou proteínas totais/creatinina) tem sido mais recomendada por ser um método menos sujeito a erros de coleta. A elevação da excreção urinária de albumina (EUA) deve ser confirmada em pelo menos duas de três coletas, em um período de três a seis meses.(8)
Vários fatores podem interferir na determinação da albuminúria e, portanto, devem ser considerados durante a realização do exame. Dentre os fatores que podem elevar os níveis de albuminúria destacam-se o mau controle glicêmico e a hipertensão arterial não controlada, a presença de infecção do trato urinário, a prática de exercício físico intenso antes da coleta da amostra de urina, a obesidade mórbida, a insuficiência cardíaca descompensada, a presença de doença aguda ou febre, a sobrecarga proteica ou hídrica e a gestação.(9)
Outro fator que pode interferir na avaliação da relação albumina/creatinina (ou proteínas totais/creatinina) é a massa muscular do paciente, já que esta está diretamente relacionada com os níveis séricos de creatinina. Uma baixa massa muscular pode resultar em uma elevação da relação proteínas totais/creatinina e albumina/creatinina devido à redução da creatinina urinária, enquanto que uma elevada massa muscular pode resultar em normalidade mesmo na presença de excreção urinária elevada de proteínas ou albumina, decorrente de uma maior produção de creatinina.(10)
A avaliação anual da albuminúria é recomendada nos pacientes diabéticos, os quais apresentam um risco elevado de desenvolver DRC, já que esta possibilita a detecção precoce de lesão no parênquima renal. Nos pacientes com diabetes mellitus tipo 1 (DM1), realiza-se o rastreamento a partir de cinco anos do diagnóstico do diabetes, ou antes, em pacientes persistentemente descompensados ou na adolescência. Em pacientes com diabetes mellitus tipo 2 (DM2), a presença de albuminúria deve ser pesquisada logo após o diagnóstico do diabetes, assim que obtido o melhor controle possível da hiperglicemia e da hipertensão.(9)
O aumento da EUA na nefropatia diabética ocorre principalmente devido à lesão glomerular resultante da deposição de proteínas glicadas. O aumento da pressão intraglomerular, a perda de glicosaminoglicanos carregados negativamente na membrana basal e o aumento do tamanho dos poros nesta membrana contribuem para a albuminúria. As anormalidades histológicas incluem o espessamento da membrana basal glomerular, o acúmulo de matriz mesangial e o aumento do número de células mesangiais. Alterações no interstício tubular, incluindo espessamento da membrana basal tubular, atrofia tubular, fibrose intersticial e esclerose vascular, também estão presentes. Além disso, a morfologia dos podócitos está anormal e pode haver perda de podócitos. Os podócitos fornecem um suporte estrutural para os capilares glomerulares, tamponam a pressão intraglomerular e constituem a última barreira de passagem das proteínas através do glomérulo. De modo semelhante à membrana basal, os podócitos são revestidos por moléculas carregadas negativamente, as quais auxiliam na repulsão das proteínas aniônicas, como a albumina. Assim, alterações na morfologia e no número de podócitos também podem contribuir para a albuminúria e a glomeruloesclerose na nefropatia diabética.(11,12)
Estudos prospectivos têm demonstrado que níveis ainda considerados normais de albuminúria já conferem risco de progressão de doença renal e cardiovascular.(13,14) Possivelmente, os valores de albuminúria devem oferecer risco contínuo, da mesma forma que os da pressão arterial e da glicemia. Além disso, uma quantidade significativa de albumina urinária não é detectada pelos métodos de imunoensaio, de modo que os valores da excreção urinária desse marcador são subestimados, já que estes não medem a fração não imunorreativa da albumina.(15) Tem sido observado que mesmo pacientes com níveis de albuminúria considerados normais já podem apresentar diminuição do RFG, o que aumenta o risco de progressão da nefropatia. Portanto, além de ser avaliada a EUA também é necessária a determinação do RFG para a avaliação precoce da DRC.(9)
Determinação do ritmo de filtração glomerular
É de suma importância avaliar adequadamente a função renal não apenas para fazer o diagnóstico e determinar o tratamento de doenças renais, mas também para administrar doses adequadas de medicações, definir a evolução da doença, interpretar sintomas urêmicos que possam estar presentes e tomar decisões com relação à necessidade de se iniciar terapêutica renal substitutiva. Em geral, a avaliação do RFG é considerada como o melhor marcador de função renal em indivíduos saudáveis ou doentes.(16)
O método padrão-ouro para o cálculo do RFG se baseia na determinação da depuração de substâncias radioativas, como 51Cr-EDTA, 99mTc-DTPA e 125I-iotalamato, ou de compostos não radioativos, como inulina, ioexol e iotalamato. A utilização destes marcadores exógenos é onerosa, pouco prática e invasiva, de modo que, na prática clínica, o RFG é estimado através da utilização de um marcador endógeno, a creatinina.(2)
A creatinina tem sido utilizada para avaliar a função renal há pelo menos 75 anos. A sua concentração no plasma depende do balanço entre a sua produção e a sua excreção. A creatinina plasmática é produzida pelas células musculares esqueléticas como um metabólito final do metabolismo energético e também pode ser gerada, em menor extensão, pela absorção intestinal da creatinina derivada dos alimentos. A excreção da creatinina é realizada pelos rins, sendo que ela é livremente filtrada pelos glomérulos renais e, em pequena proporção, é secretada pelos túbulos renais. Portanto, a concentração plasmática de creatinina depende não apenas da função renal, mas também da dieta e da massa muscular, a qual varia de acordo com o sexo e a idade.(10)
Além disso, a creatinina plasmática não é capaz de detectar precocemente a presença de DRC, uma vez que seus níveis só aumentam quando a função renal já está bastante debilitada.(17) Portanto, a creatinina sérica não é considerada um marcador sensível para a avaliação da função renal de pacientes que apresentam os estágios iniciais da DRC, já que muitos destes indivíduos mantêm os níveis de creatinina sérica dentro da normalidade. Os níveis séricos de creatinina também não são eficazes para avaliar a função renal de indivíduos que apresentam uma produção reduzida de creatinina devido à pequena massa muscular.(2,10)
Para superar estas limitações da creatinina plasmática, a função renal pode ser avaliada pelo cálculo da depuração da creatinina (DEC) corrigida pela superfície corporal (Quadro 3), que fornece uma estimativa do RFG e se correlaciona melhor com a função renal do que a creatinina plasmática. Contudo, o cálculo da DEC envolve a coleta de urina durante um período de 24 horas, a qual é pouco confiável, já que muitas vezes é realizada de modo inadequado pelo paciente.(6)
Assim, foram desenvolvidas equações baseadas nos níveis séricos de creatinina, as quais incluem outras variáveis, como idade, sexo, raça e superfície corporal, para estimar o RFG. Na prática clínica, as equações de Cockcroft-Gault e do estudo Modificação Dietética na Doença Renal (MDRD) são as mais utilizadas.(18-20) (Quadro 3). Estas equações possuem a vantagem de superar as limitações da creatinina plasmática e da DEC, sem aumento de custos e tempo para avaliar a função renal. Contudo, as predições fornecidas por estas equações representam uma estimativa aproximada do RFG, não fornecendo o verdadeiro RFG. Deste modo, todas elas possuem algumas desvantagens, não existindo até o momento uma equação ideal para estimar o RFG.(10)

A equação de Cockcroft-Gault estima a DEC, sendo necessário corrigir o resultado pela superfície corporal. Como a DEC é geralmente maior do que o RFG devido à secreção tubular da creatinina, a equação de Cockcroft-Gault tende a fornecer um valor maior do RFG do que a equação MDRD.(10) Geralmente, esta secreção contribui relativamente pouco para superestimar a DEC, mas com o agravamento da doença renal e a redução da creatinina filtrada, a secreção tubular da creatinina aumenta e se torna um componente mais significativo da DEC.(17) Além disso, um coeficiente para o peso corporal no numerador da equação de Cockcroft-Gault pode superestimar a função renal quando esta equação é utilizada em indivíduos obesos ou com edema.(21)
A equação MDRD estima o próprio RFG e não leva em consideração o peso corporal e o ajuste para a superfície corporal, de modo que sua estimativa apresenta menor viés relacionado à obesidade ou edema. Contudo, ela não é muito precisa para estimar este índice em indivíduos que apresentam a função renal normal, já que ela foi desenvolvida a partir de um estudo que incluiu apenas indivíduos com doença renal.(10) Esta equação tende a subestimar o RFG de pessoas com função renal normal.(22)
As equações de Cockcroft-Gault e MDRD se baseiam nos níveis de creatinina plasmática, sendo influenciadas por esse marcador, que não é sensível a diminuições leves ou moderadas no RFG uma vez que seus níveis demoram a elevar, gerando consequências sobre os resultados obtidos com as fórmulas.(2) Um ponto importante consiste no fato de que um pequeno aumento da creatinina plasmática, dentro da faixa da normalidade, pode resultar em uma grande redução do RFG, devido à relação não linear da creatinina plasmática com o RFG. Deste modo, uma estimativa elevada da creatinina plasmática em indivíduos que possuem a função renal normal irá implicar uma subestimação do verdadeiro RFG.(23)
Outra limitação importante destas equações consiste no fato de que elas foram desenvolvidas antes da padronização internacional da determinação laboratorial da creatinina sérica, de modo que elas não são adequadas para estimar o RFG quando métodos de dosagem da creatinina calibrados por padrão internacional são utilizados. As Diretrizes do KDIGO recomendam que métodos calibrados rastreáveis para medida de referência internacional com ID-MS (isotope dilution mass spectrometry) sejam utilizados para a determinação da creatinina sérica, já que a variabilidade da calibração dos métodos pode introduzir erros significativos na estimativa do RFG por meio das equações, principalmente na faixa da normalidade. Como a equação de Cockcroft-Gault não pode ser re-expressa para ser utilizada com a creatinina calibrada, esta equação não tem sido mais recomendada para avaliação do RFG. Por outro lado, uma versão modificada da equação MDRD foi desenvolvida para ser utilizada com a creatinina calibrada, de modo que esta equação modificada deve ser utilizada em detrimento da equação original para estimar o RFG.(4)
Nos últimos anos, o grupo de estudo Colaboração Epidemiológica da Doença Renal Crônica (CKD-EPI – The Chronic Kidney Disease Epidemiology Collaboration) desenvolveu uma nova equação para estimar o RFG baseada na creatinina sérica calibrada.(24) (Quadro 3). Esta equação foi elaborada a partir de um estudo que envolveu tanto pacientes com RFG reduzido quanto indivíduos com RFG dentro da faixa da normalidade, com o objetivo de superar a limitação da equação MDRD.(25) A inclusão de indivíduos com e sem doença renal no estudo possibilitou o desenvolvimento de uma equação que apresenta uma maior precisão para estimar o RFG, um melhor valor preditivo do risco de progressão da DRC e que proporciona menos diagnósticos falso-positivos.(25,26) Atualmente, as Diretrizes do KDIGO(4) recomendam que a equação CKD-EPI seja empregada para estimar o RFG, já que alguns estudos têm demonstrado que a equação CKD-EPI é mais precisa para avaliar a função renal do que a equação MDRD em diferentes populações.(27,28) Até o momento, um único estudo foi realizado com a população brasileira com o objetivo de comparar estas duas equações, o qual indicou que a equação CKD-EPI subestima menos o RFG em indivíduos com RFG > 60 do que a equação MDRD. Contudo, a equação CKD-EPI apresentou uma tendência a superestimar o RFG em indivíduos com RFG < 60. Portanto, estudos adicionais ainda precisam ser realizados na nossa população para verificar qual equação seria a mais adequada para estimar o RFG.(29)
Apesar das limitações das equações baseadas na creatinina, a identificação e o monitoramento da disfunção renal pela estimativa do RFG através destas equações são muito importantes e úteis no acompanhamento dos pacientes para avaliação do prognóstico da doença renal e tratamento adequado de acordo com a sua evolução.(17) Estas equações devem ser utilizadas para estimar o RFG na população em geral e nos grupos de risco para desenvolvimento da DRC, sendo que o cálculo da DEC deve ser empregado apenas nas seguintes situações: extremos de idade, massa muscular acentuadamente grande ou pequena, doenças da musculatura esquelética, dietas não usuais com excesso ou escassez de creatinina (suplementação com creatinina ou dieta vegetariana), redução da massa muscular devido a amputações, desnutrição ou atrofia muscular, obesidade mórbida, antes da introdução de drogas potencialmente nefrotóxicas, avaliação da necessidade de se iniciarem procedimentos de diálise e insuficiência renal aguda.(12)
As equações CKD-EPI e MDRD modificada, as quais podem ser empregadas com a creatinina calibrada, apresentam o componente etnia negra, o qual é importante para a população dos Estudos Unidos, mas não para a população brasileira, já que esta é muito miscigenada. Deste modo, estas equações devem ser empregadas sem a introdução desta variável para a estimativa do RFG na nossa população.(30) A estimativa do RFG por meio destas equações envolve cálculos mais elaborados, sendo necessário o uso de calculadoras científicas ou programas computacionais. Com o intuito de facilitar a estimativa do RFG nos centros de atenção primária à saúde no Brasil, agilizando o diagnóstico da DRC e o encaminhando nefrológico dos pacientes, foram desenvolvidos nomogramas para estimar o RFG na população brasileira a partir das equações CKD-EPI e MDRD modificadas, sem a introdução do componente etnia negra.(31,32)
Cistatina C
Determinações precisas do RFG são importantes para o acompanhamento clínico de pacientes com disfunção renal a fim de acompanhar a progressão da doença. Para tanto, um marcador sensível e específico ideal deve ser produzido endogenamente a uma taxa constante, independente da idade, sexo, peso, dieta ou estado da doença. Este marcador também deve ser livremente filtrado pelos glomérulos e excretado apenas pelos rins, sem ser secretado, reabsorvido ou modificado pelos túbulos renais. Quando presente na urina, ele deve permanecer estável até que seja determinado pelos ensaios automatizados disponíveis.(17) Atualmente, vários marcadores para avaliação da função renal têm sido propostos para superar as limitações daqueles que se encontram disponíveis, os quais não atendem a todas estas exigências. Neste contexto, a concentração plasmática da cistatina C tem sido avaliada, representando um marcador bastante promissor para avaliar o RFG.(9)
A cistatina C é uma proteína não glicosilada de baixo peso molecular (13,3 kDa) pertencente à família das cisteíno proteases. Ela é sintetizada por todas as células nucleadas a uma taxa de produção constante, podendo ser encontrada em vários fluidos biológicos, como soro, líquido seminal e líquido cefalorraquidiano.(9,33) A cistatina C é livremente filtrada pelos glomérulos renais devido ao seu pequeno tamanho e carga positiva. Ao contrário da creatinina, ela não é secretada pelos túbulos renais, embora seja reabsorvida. Uma vez reabsorvida, ela é metabolizada pelas células epiteliais dos túbulos renais e não retorna à circulação sanguínea.(18)
Até o momento, alguns interferentes foram identificados por causar um impacto na produção de cistatina C. Grandes doses de glicocorticoides podem aumentar sua produção e a disfunção da tireoide pode afetar os níveis de cistatina C, sendo estes mais baixos no hipotireoidismo e maiores no hipertiroidismo.(34) Fatores como processos inflamatórios e infecciosos não alteram os níveis plasmáticos da cistatina C. Além disso, não há uma variação significativa da faixa de referência para homens e mulheres, já que sua produção não depende da massa muscular.(35) A cistatina C também tem se mostrado melhor do que a creatinina para avaliar a função renal de populações idosas e pediátricas, pois a massa muscular reduzida presente nestes indivíduos não afeta os níveis da cistatina C, mas pode resultar em níveis plasmáticos menores de creatinina, os quais não refletem o verdadeiro RFG.(17)
Os métodos baseados na cistatina C para estimar o RFG têm se mostrado iguais ou superiores aos métodos baseados na creatinina.(9,22) Uma meta-análise de 49 estudos e um total de 4.492 indivíduos demonstraram que a cistatina C é um melhor preditor do RFG do que a creatinina.(36) Alguns estudos ainda têm sugerido que a cistatina C é superior à DEC quando uma disfunção renal subclínica está presente, possibilitando a detecção precoce do declínio da função renal, o que é especialmente importante para o diagnóstico precoce da DRC nos grupos de risco, como diabéticos, hipertensos e transplantados renais.(37-40) Além disso, a cistatina C tem se mostrado um melhor preditor da doença renal terminal e de eventos cardiovasculares nos pacientes diabéticos.(41,42)
Várias equações têm sido desenvolvidas para estimar o RFG com base nos níveis plasmáticos de cistatina C (Quadro 4). Em geral, independente da equação utilizada, a precisão é maior do que a das equações baseadas na creatinina.(22) Além disso, foi desenvolvida uma equação para avaliação do RFG que incorpora tanto a creatinina quanto a cistatina C, a qual apresenta grande potencialidade para avaliação do RFG após os métodos considerados padrão ouro.(52) Estudos recentes demonstraram que a equação CKD-EPI baseada na creatinina e na cistatina C apresentou uma melhor precisão para avaliar o RFG do que as equações CKD-EPI baseadas apenas na creatinina ou na cistatina C.(56-58) Contudo, a determinação laboratorial da cistatina C é onerosa e os métodos baseados na cistatina C ainda carecem de mais estudos e de padronização.(22)

Atualmente, o KDIGO(4) tem sugerido que os níveis plasmáticos de cistatina C sejam determinados em adultos que possuem um RFG estimado pelas equações baseadas na creatinina compreendido entre 45 mL e 59 mL/min/1,73m2 e que não apresentam outros marcadores de lesão do parênquima renal para confirmar o diagnóstico da DRC. Nestas situações, o RFG deve ser estimado utilizando-se a equação CKD-EPI para a cistatina C,(52) sendo a DRC confirmada caso o RFG baseado na cistatina C seja menor do que 60 mL/min/1,73m2. Devido ao elevado custo da determinação laboratorial da cistatina C, este exame ainda não é coberto pelo Sistema Único de Saúde do Brasil, de modo que esta recomendação do KDIGO ainda é não seguida nos centros de saúde em nosso país. Contudo, espera-se que em um futuro próximo, com a redução do preço da dosagem da cistatina C, a estimativa do RFG baseada na cistatina C seja rotineiramente utilizada na clínica médica, complementando e aprimorando o diagnóstico e o acompanhamento da DRC.
Monitoramento da Doença Renal Crônica
A avaliação da função renal de pacientes com DRC deve ser realizada pelo menos anualmente. A frequência exata de monitoramento destes pacientes irá depender da gravidade da DRC e do risco de progressão para estágios mais avançados, o que, por sua vez, pode ser avaliado por meio da determinação do RFG e da albuminúria (Quadro 5). Além de um declínio no RFG e de níveis aumentados de albuminúria, outros fatores associados à progressão da DRC incluem a causa da DRC, presença de insuficiência renal aguda, idade, sexo, raça ou etnia, pressão arterial elevada, hiperglicemia, dislipidemia, tabagismo, obesidade, história de doença cardiovascular, exposição contínua a agentes nefrotóxicos, dentre outros.(4)
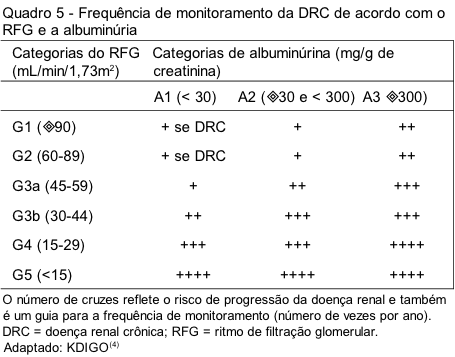
É importante levar em consideração que pequenas flutuações no RFG são comuns e não são necessariamente indicativas de que a nefropatia esteja progredindo. Portanto, o estabelecimento de progressão da DRC deve ser baseado na presença de um declínio na categoria do RFG acompanhado por um declínio maior ou igual a 25% no RFG e/ou de um declínio no RFG maior do que 5 mL/min/1,73m2 por ano, ou seja, a avaliação seriada do RFG ao longo do tempo possui um significado clínico mais importante do que medidas pontuais do RFG.(4) Portanto, estudos longitudinais que avaliem a utilidade clínica das equações baseadas na creatinina e na cistatina C para estimar o RFG são clinicamente mais relevantes do que estudos transversais. Como poucos estudos longitudinais foram realizados até momento, especialmente na população brasileira, e como ainda não há um consenso sobre qual método seria o mais adequado para avaliar o RFG, a realização destes estudos deve ser amplamente incentivada em nosso país.
Conclusão
O diagnóstico precoce da DRC e a avaliação precisa do risco de progressão do declínio da função renal e do desenvolvimento de complicações, principalmente cardiovasculares, possui extrema importância, já que este pode contribuir para o estabelecimento precoce de terapias reno e cardioprotetoras, as quais podem evitar, ou, pelo menos, retardar a ocorrência destes desfechos indesejáveis. Atualmente, vários biomarcadores estão disponíveis para a avaliação da função renal, cada qual apresentando vantagens e desvantagens. Apesar de todos os biomarcadores apresentarem limitações, a identificação e o monitoramento da disfunção renal através da determinação da albuminúria associada à estimativa do RFG por meio de equações baseadas na creatinina e na cistatina C são muito importantes e úteis no acompanhamento dos pacientes com DRC para avaliação do prognóstico da doença renal e tratamento adequado de acordo com a sua evolução.
A avaliação da DRC deve ser realizada de acordo com algumas recomendações: a albuminúria deve ser determinada por meio do cálculo da relação albumina/creatinina em amostra de urina isolada ou primeira urina da manhã em detrimento da utilização da amostra de urina de 24 horas; o RFG deve ser sempre avaliado juntamente com a albuminúria, já que alguns pacientes com albuminúria normal apresentam declínio do RFG; as equações CKD-EPI e MDRD modificada devem ser empregadas para estimar o RFG, já que estas podem ser utilizadas com a creatinina calibrada. O elevado custo da determinação sérica da cistatina C consiste na principal limitação da sua utilização nos centros de saúde primária no Brasil. Contudo, espera-se que futuramente este custo seja reduzido e que a estimativa do RFG baseada na cistatina C seja mais amplamente utilizada para complementar o diagnóstico e o monitoramento da DRC, contribuindo para a detecção precoce do declínio da função renal, especialmente nos grupos de risco.
Como ainda não existe um biomarcador ideal para a avaliação da função renal nos diferentes grupos de pacientes, o estudo de novos biomarcadores que estão associados com o declínio da função renal possui grande importância, já que pode levar a descoberta de biomarcadores renais mais eficazes ou que complementem os disponíveis. Novos biomarcadores que possibilitem o diagnóstico precoce da doença renal e do seu agravamento são muito promissores, já que podem contribuir para a adoção de medidas preventivas e terapêuticas adequadas para evitar ou retardar a evolução da doença renal e o surgimento de complicações.
Abstract
Early diagnosis of chronic kidney disease (CKD) and the accurate evaluation of the risk of progression of renal function decline and development of cardiovascular complications are extremely relevant, since the early establishment of reno- and cardioprotective therapies may prevent or delay the occurrence of these undesirable outcomes. Several biomarkers can be used to assess renal function, such as creatinine, proteinuria, albuminuria, cystatin C and glomerular filtration rate (GFR), which can be estimated using equations based on creatinine or cystatin C. Despite all of these biomarkers present limitations, the identification of CKD and the monitoring of the renal function through determination of albuminuria associated with GFR estimative are very important and useful for assessing the prognosis of renal disease and establish the appropriate treatment according to its evolution.
Keywords
Albuminuria; Renal insufficiency, Chronic; Cystatin C; Creatinine; Glomerular filtration rate
REFERÊNCIAS
- Bosan IB. Recommendations for early diagnosis of chronic kidney disease. Ann Afr Med. 2007 Sep;6(3):130-6.
- Kirsztajn GM. Avaliação do ritmo de filtração glomerular. J Bras Patol Med Lab 2007;43:257-64.
- Levey AS, Inker LA, Coresh J. GFR estimation: from physiology to public health. Am J Kidney Dis. 2014 May;63(5):820-34.
- National Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO clinical practive guideline for the evaluation and management of chronic kidney disease. Kidney Int Suppl. 2013;3:1-150.
- Sesso RC, Lopes AA, Thomé FS, Lugon JR, Watanabe Y, dos Santos DR. Report of the Brazilian Chronic Dialysis Census 2012. J Bras Nefrol. 2014 Jan-Mar;36(1):48-53. [Article in Portuguese].
- Bastos MG, Bregman R, Kirsztajn GM. Doença renal crônica: frequente e grave, mas também prevenível e tratável. Rev Assoc Med Bras. 2010;56:248-53.
- Romão Júnior JE. Doença renal crônica: definição, epidemiologia e classificação. J Bras Nefrol. 2004;26:1-3.
- Alves MAR. Diagnóstico de Doença Renal Crônica: Avaliação de Proteinúria e Sedimento Urinário. J Bras Nefrol. 2004;26:1-3.
- Murussi M, Murussi N, Campagnolo N, Silveiro SP. Early detection of diabetic nephropathy. Arq Bras Endocrinol Metabol. 2008 Apr;52(3):442-51. [Article in Portuguese].
- Cirillo M. Evaluation of glomerular filtration rate and of albuminuria/proteinuria. J Nephrol. 2010 Mar-Apr;23(2):125-32.
- Marshall SM. Recent advances in diabetic nephropathy. Postgrad Med J. 2004 Nov;80(949):624-33.
- Strasinger SK, Lorenzo MS. Doença Renal. In: Strasinger SK, Lorenzo MS. Urinálise e Fluidos Corporais. São Paulo: Livraria Médica Paulista Editora; 2009. p. 157-73.
- Murussi M, Campagnolo N, Beck MO, Gross JL, Silveiro SP. High-normal levels of albuminuria predict the development of micro- and macroalbuminuria and increased mortality in Brazilian Type 2 diabetic patients: an 8-year follow-up study. Diabet Med. 2007 Oct;24(10): 1136-42.
- Leitão CB, Canani LH, Polson PB, Molon MP, Pinotti AF, Gross JL. Urinary albumin excretion rate is associated with increased ambulatory blood pressure in normoalbuminuric type 2 diabetic patients. Diabetes Care. 2005 Jul;28(7):1724-9.
- Comper WD, Osicka TM, Jerums G. High prevalence of immuno-unreactive intact albumin in urine of diabetic patients. Am J Kidney Dis. 2003 Feb;41(2):336-42.
- Bostom AG, Kronenberg F, Ritz E. Predictive performance of renal function equations for patients with chronic disease and normal serum creatinine levels. J Am Soc Nephrol. 2002 Aug;13(8): 2140-4.
- Massey D. Commentary: clinical diagnostic use of cystatin C. J Clin Lab Anal. 2004;18:55-60.
- Cockcroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron. 1976;16:31-41.
- Levey AS, Bosch JP, Lewis JB, Greene T, Rogers N, Roth D. A more accurate method to estimate glomerular filtration rate from serum creatinine: a new prediction equation. Modification of Diet in Renal Disease Study Group.Ann Intern Med. 1999 Mar 16; 130(6):461-70.
- Levey AS, Greene T, Kusek JW, Beck GJ, GROUP MS. A simplified equation to predict glomerular filtration rate from serum creatinine [Abstract]. J Am Soc Nephrol. 2000;11: A0828.
- Cirillo M, Anastasio P, De Santo NG. Relationship of gender, age, and body mass index to errors in predicted kidney function. Nephrol Dial Transplant. 2005 Sep;20(9):1791-8.
- MacIsaac RJ, Premaratne E, Jerums G. Estimating glomerular filtration rate in diabetes using serum cystatin C. Clin Biochem Rev. 2011 May;32(2):61-7.
- Coresh J, Astor BC, McQuillan G, Kusek J, Greene T, Van Lente F, et al. Calibration and random variation of the serum creatinine assay as critical elements of using equations to estimate glomerular filtration rate. Am J Kidney Dis. 2002 May;39(5):920-9.
- Levey AS, Stevens LA, Schmid CH, Zhang YL, Castro AF 3rd, Feldman HI, et al; CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). A new equation to estimate glomerular filtration rate. Ann Intern Med. 2009 May 5;150(9):604-12.
- Stevens LA, Padala S, Levey AS. Advances in glomerular filtration rate-estimating equations. Curr Opin Nephrol Hypertens. 2010 May;19(3):298-307.
- Levey AS, Stevens LA. Estimating GFR using the CKD Epidemiology Collaboration (CKD-EPI) creatinine equation: more accurate GFR estimates, lower CKD prevalence estimates, and better risk predictions. Am J Kidney Dis. 2010 Apr;55(4):622-7.
- Murata K, Baumann NA, Saenger AK, Larson TS, Rule AD, Lieske JC. Relative performance of the MDRD and CKD-EPI equations for estimating glomerular filtration rate among patients with varied clinical presentations. Clin J Am Soc Nephrol. 2011 Aug;6(8): 1963-72.
- Cirillo M, Lombardi C, Luciano MG, Bilancio G, Anastasio P, De Santo NG. Estimation of GFR: a comparison of new and established equations. Am J Kidney Dis. 2010;56:802-4.
- Veronese FV, Gomes EC, Chanan J, Carraro MA, Camargo EG, Soares AA, et al. Performance of CKD-EPI equation to estimate glomerular filtration rate as compared to MDRD equation in SouthBrazilian individuals in each stage of renal function. Clin Chem Lab Med. 2014 Dec;52(12):1747-54. doi: 10.1515/cclm-2014-0052.
- Zanocco JA, Nishida SK, Passos MT, Pereira AR, Silva MS, Pereira AB, Kirsztajn GM. Race adjustment for estimating glomerular filtration rate is not always necessary. Nephron Extra. 2012 Jan;2 (1):293-302.
- Bastos MG, Kirsztajn GM. Chronic kidney disease: importance of early diagnosis, immediate referral and structured interdisciplinary approach to improve outcomes in patients not yet on dialysis. J Bras Nefrol. 2011;33:93-108.
- Magacho EJ, Pereira AC, Mansur HN, Bastos MG. Nomogram for estimation of glomerular filtration rate based on the CKD-EPI formula. J Bras Nefrol. 2012;34:313-5.
- Hawkins R. New biomarkers of acute kidney injury and the cardio-renal syndrome. Korean J Lab Med. 2011 Apr;31(2):72-80.
- Filler G, Lepage N. Should the Chwartz formula for estimation of GFR be replaced by cystatin C formula? Pediatr Nephrol. 2003; 18:981-5.
- Martins TR, Fadel-Picheth CT, Alcântara VM, Scartezini M, Picheth G. Cistatina C: um novo marcador para filtração glomerular comparada ao clearance de creatinina e a creatinina sérica. Rev Bras Anal Clin. 2003;35:207-13.
- Dharnidharka VR, Kwon C, Stevens G. Serum cystatin C is superior to serum creatinine as a marker of kidney function: a meta-analysis. Am J Kidney Dis. 2002;40:221-6.
- Perkins BA, Krolewski AS. Early nephropathy in type 1 diabetes: the importance of early renal function decline. Curr Opin Nephrol Hypertens. 2009;18:233-40.
- Premaratne E, MacIsaac RJ, Finch S, Panagiotopoulos S, Ekinci E, Jerums G. erial measurements of cystatin C are more accurate than creatinine-based methods in detecting declining renal function in type 1 diabetes. Diabetes Care. 2008 May;31(5):971-3.
- Pucci L, Triscornia S, Lucchesi D, Fotino C, Pellegrini G, Pardini E, et al. Cystatin C and estimates of renal function: searching for a better measure of kidney function in diabetic patients. Clin Chem. 2007 Mar;53(3):480-8.
- Tan GD, Lewis AV, James TJ, Altmann P, Taylor RP, Levy JC. Clinical usefulness of cistatin C for the estimation of glomerular filtration rate in type 1 diabetes: reproducibility and accuracy compared with standard measures and iohexol clearance. Diabetes Care. 2002; 25:2004-9.
- Krolewski AS, Warram JH, Forsblom C, Smiles AM, Thorn L, Skupien J, et al. Serum concentration of cystatin C and risk of end-stage renal disease in diabetes. Diabetes Care. 2012 Nov;35(11):2311-6.
- Schottker B, Herder C, Muller H, Brenner H, Rothenbacher D. Clinical utility of creatinine- and cystatin C- based definition of renal function for risk prediction of primary cardiovascular events in patients with diabetes. Diabetes Care 2012; 35: 879-86.
- Le Bricon T, Thervet E, Froissart M, Benlakehal M, Bousquet B, Legendre C, Erlich D. Plasma cystatin C is superior to 24-h creatinine clearance and plasma creatinine for estimation of glomerular filtration rate 3 months after kidney transplantation. Clin Chem. 2000 Aug;46(8 Pt 1):1206-7.
- Larsson A, Malm J, Grubb A, Hansson LO. Calculation of glomerular filtration rate expressed in mL/min from plasma cystatin C values in mg/L. Scand J Clin Lab Invest. 2004;64:25-30.
- Hoek FJ, Kemperman FA, Krediet RT. A comparison between cystatin C, plasma creatinine and the Cockcroft and Gault formula for the estimation of glomerular filtration rate. Nephrol Dial Transplant. 2003; 18: 2024-31.
- Grubb A, Nyman U, Björk J, Lindström V, Rippe B, Sterner G, Christensson A. Simple cystatin C-based prediction equations for glomerular filtration rate compared with the modification of diet in renal disease prediction equation for adults and the Schwartz and the Counahan-Barratt prediction equations for children. Clin Chem. 2005 Aug;51(8):1420-31.
- Perkins BA, Nelson RG, Ostrander BE, Blouch KL, Krolewski AS, Myers BD, Warram JH. Detection of renal function decline in patients with diabetes and normal or elevated GFR by serial measurements of serum cystatin C concentration: results of a 4-year follow-up study. J Am Soc Nephrol. 2005 May;16(5):1404-12.
- Rule AD, Bergstralh EJ, Slezak JM, Larson TS. Glomerular filtration rate estimated by cystatin C among different clinical presentations. Kidney Int. 2006;69:399-405.
- MacIsaac RJ, Tsalamandris C, Thomas MC, Premaratne E, Panagiotopoulos S, Smith TJ, et al. Estimatins glomerular filtration rate in diabetes: a comparison of cystatin-C- and creatinine-based methods. Diabetologia. 2006;49:1686-9.
- Flodin M, Jonsson AS, Hansson LO, Danielsson LA, Larsson A. Evaluation of Gentian cystatin C reagent on Abbot Ci8200 and calculation of glomerular filtration rate expressed in mL/min/1.73m(2) from the cystatin C values in mg/L. Scand J Clin Lab Invest. 2007; 67:560-7.
- Beauvieux MC1, Le Moigne F, Lasseur C, Raffaitin C, Perlemoine C, Barthe N, et al. New predictive equations improve monitoring of kidney function in patients with diabetes. Diabetes Care. 2007 Aug;30 (8):1988-94
- Stevens LA, Coresh J, Schmid CH, Feldman HI, Froissart M, Kusek J, et al. Estimating GFR using serum cystatin C alone and in combination with serum creatinine: a pooled analysis of 3,418 individuals with CKD. Am J Kidney Dis. 2008 Mar;51(3):395-406.
- Tidman M, Sjostrom P, Jones I. A comparison of GFR estimating formulae based upon s-cystatin C and s-creatinine and a combinations of the two. Nephrol Dial Transplant. 2008;23:154-60.
- Iliadis F, Didangelos T, Ntemka A, Makedou A, Moralidis E, Gotzamani-Psarakou A, et al. Glomerular filtration rate estimation in patients with type 2 diabetes: creatinine- or cystatin C-based equations? Diabetologia. 2011 Dec;54(12):2987-94.
- White C, Akbari A, Hussain N, Dinh L, Filler G, Lepage N, Knoll GA. Estimating glomerular filtration rate in kidney transplantation: a comparison between serum creatinine and cystatin C-based methods. J Am Soc Nephrol. 2005 Dec;16(12):3763-70.
- Fan L, Levey AS, Gudnason V, Eiriksdottir G, Andresdottir MB, Gudmundsdottir H, et al. Comparing GFR estimating equations using cystatin C and creatinine in elderly individuals. J Am Soc Nephrol. 2015 Aug;26(8):1982-9. Erratum in [J Am Soc Nephrol. 2016].
- Teo BW, Koh YY, Toh QC, Li J, Sinha AK, Shuter B, et al. Performance of the CKD-EPI creatinine-cystatin C glomerular filtration rate estimation equations in a multiethnic Asian population. Singapore Med J. 2014 Dec;55(12):656-9.
- Björk J, Grubb A, Larsson A, Hansson LO, Flodin M, Sterner G, et al. Accuracy of GFR estimating equations combining standardized cystatin C and creatinine assays: a cross-sectional study in Sweden. Clin Chem Lab Med. 2015 Feb;53(3):403-14. Erratum in: Corrigendum to: Accuracy of GFR estimating equations combining standardized cystatin C and creatinine assays: a cross-sectional study in Sweden. [Clin Chem Lab Med. 2016]
Correspondência
Caroline Pereira Domingueti
Departamento de Análises Clínicas e Toxicológicas,
Faculdade de Farmácia, Campus Centro Oeste Dona Lindu
Universidade Federal de São João Del Rei
Rua Sebastião Gonçalves Coelho, 400 _ Chanadour
35501-296 – Divinópolis, MG
Telefone: (+55) (37) 9957-2442
