Análise dos valores de referência do líquido cefalorraquidiano
Analysis of reference values of cerebrospinal fluid
Laísa Vieira Gnutzmann1
Jacqueline Plewka2
Mônica Tereza Suldofski2
Mariano Felisberto3
Vanessa Nesi3
1Farmacêutica bioquímica . Residente em Análises Clínicas. Hospital Universitário do Oeste do Paraná – HUOP – Unioeste – Universidade do Oeste do Paraná – Cascavel, PR, Brasil.
2Mestre/ Docente. Unioeste – Universidade do Oeste do Paraná – Cascavel, PR, Brasil.
3Residente em Análises Clínicas. Hospital Universitário do Oeste do Paraná – HUOP – Unioeste – Universidade do Oeste do Paraná – Cascavel, PR, Brasil.
Instituição: Hospital Universitário do Oeste do Paraná – Cascavel, PR, Brasil.
Artigo recebido em 16/05/2013
Artigo aprovado em 29/01/2016
Resumo
O líquido cefalorraquidiano (LCR) é um líquido incolor que circula o cérebro e a medula espinhal através do espaço subaracnoideo, ventrículos cerebrais e o canal central da medula. O exame do LCR fornece informações importantes em relação ao diagnóstico etiológico e acompanhamento de processos inflamatórios, infecciosos ou neoplásicos dos órgãos que são envolvidos por esse líquido. Esse exame compreende a análise dos aspectos físicos, bioquímicos e citológicos do LCR. A definição dos intervalos de valores de referência é uma tarefa desafiadora para todos os laboratórios clínicos, sendo fundamental para que os laboratórios forneçam informações fidedignas e que os clínicos possam interpretar corretamente os resultados e optar pelas melhores condutas diante da população assistida. Foram realizadas buscas nas bases de dados Medline/Pubmed, Lilacs/SciELO e Web of Science, à procura de artigos que apresentassem uma fundamentação teórica de LCR com informações de valores de referência dos exames pesquisados. Foram tabulados os valores dos exames bioquímicos de glicose, proteína, lactato, LDH, ADA, e citológico de leucócitos e hemácias. Os estudos abordados nesta revisão mostraram que ainda não existe uma padronização dos valores de referência para o exame de LCR. Apesar disso, os trabalhos não apresentaram uma ampla variância nesses valores.
Palavras-chave
Líquido cefalorraquidiano; Valores de Referência; Análise de Dados
INTRODUÇÃO
O líquido cefalorraquidiano (LCR) é um líquido incolor, que circula o cérebro e a medula espinhal através do espaço subaracnoideo, ventrículos cerebrais e o canal central da medula.(1) Apresenta peso molecular baixo e está em equilíbrio osmótico com o sangue,(2) sendo constituído de pequenas concentrações de proteína, glicose, lactato, enzimas, potássio, magnésio e concentrações relativamente elevadas de cloreto de sódio.(3) É produzido nos plexos coroides dos ventrículos cerebrais e no epitélio ependimário,(1) sendo que 70% do LCR é derivado de filtração passiva do sangue e secreção através do plexo coroide.(4,5)
Em adultos, cerca de 500 mL de LCR são produzidos por dia. O tempo médio para renovação total do LCR é de quatro em quatro horas.(6) O volume total em adultos varia de 90 mL a 150 mL e, em recém-nascidos (RN), varia de 10 mL a 60 mL.(5)
As duas principais funções do LCR são relacionadas à homeostase: proteção e circulação. Ele constitui um eficiente amortecedor de choques para proteger o encéfalo e a medula espinhal de impactos,(2) fornecendo um suporte físico em que o cérebro de 1.500 g passa a pesar 50 g suspenso no LCR.(5) Em sua função circulatória, o líquido distribui substâncias nutritivas filtradas do sangue e remove as impurezas e substâncias tóxicas produzidas pela célula do encéfalo e da medula espinal.(2)
A coleta da amostra de LCR pode ser realizada por três vias clássicas, sendo a lombar a mais utilizada na rotina, seguida pela suboccipital e a via ventricular.(4) As indicações para a punção podem ser divididas em quatro categorias das principais doenças: Infecção das meninges, hemorragia subaracnoide, malignidade primária ou metastática, e doenças desmielinizantes.(5)
O exame do LCR fornece informações importantes em relação ao diagnóstico etiológico e ao acompanhamento de processos inflamatórios, infecciosos ou neoplásicos dos órgãos que são envolvidos por esse líquido. Esse exame compreende a análise dos aspectos físicos, bioquímicos e citológicos do LCR.(7)
A definição dos intervalos de valores de referência é uma tarefa desafiadora para todos os laboratórios clínicos, sendo fundamental para que os laboratórios forneçam informações fidedignas e que os clínicos possam interpretar corretamente os resultados e optar pelas melhores condutas diante da população assistida. As decisões clínicas no ambiente hospitalar, por exemplo, a conduta de admissão ou não, alta e modificação no esquema terapêutico, são altamente dependentes dos resultados dos testes laboratoriais e, consequentemente, da interpretação dos intervalos de significância.
ANÁLISE BIOQUÍMICA
Glicose
A glicose entra no LCR após saturação cinética através de um mecanismo de transporte facilitado. Esse mecanismo não é totalmente funcional até quatro a oito semanas após o nascimento, por isso que, juntamente com a barreira hematoencefálica imatura nesse momento, a concentração de glicose no LCR é dependente da idade.(8)
Os níveis de glicose no LCR são utilizados para diferenciar meningite bacteriana de viral.(9) A hipoglicorraquia no LCR é causada principalmente por alterações nos mecanismos de transporte de glicose através da barreira hematoencefálica e por sua grande utilização por parte das células encefálicas.(10)
Os níveis de glicose no LCR são interpretados em relação à glicose no soro.(9) A glicose no soro e no LCR equilibram-se após um período de aproximadamente quatro horas, de modo que a concentração de glicose no LCR em um dado momento reflete os níveis de glicose no soro durante essas últimas quatro horas.(11) O sangue para exame de glicemia deve ser colhido pelo menos duas horas antes da punção do LCR, a fim de que haja tempo para esse equilíbrio,(10) ou os resultados devem ser comparados com os níveis plasmáticos após um jejum de quatro horas para uma adequada interpretação clínica.(5)
Os níveis de glicose no LCR são utilizados para diferenciar meningite bacteriana de viral.(9) A hipoglicorraquia no LCR é causada principalmente por alterações nos mecanismos de transporte de glicose através da barreira hematoencefálica e por sua grande utilização por parte das células encefálicas.(10)
Os níveis de glicose no LCR são interpretados em relação à glicose no soro.(9) A glicose no soro e no LCR equilibram-se após um período de aproximadamente quatro horas, de modo que a concentração de glicose no LCR em um dado momento reflete os níveis de glicose no soro durante essas últimas quatro horas.(11) O sangue para exame de glicemia deve ser colhido pelo menos duas horas antes da punção do LCR, a fim de que haja tempo para esse equilíbrio,(10) ou os resultados devem ser comparados com os níveis plasmáticos após um jejum de quatro horas para uma adequada interpretação clínica.(5)
Os níveis de glicose se normalizam antes dos níveis de proteínas e da contagem de células durante a recuperação da meningite, tornando-se um parâmetro útil na avaliação de resposta ao tratamento.(5)
Proteína
As proteínas do LCR são constituídas em grande parte de albumina e em muito menor quantidade de globulinas.(12)
A análise da quantidade total de proteínas no LCR é utilizada principalmente para detectar doenças do Sistema Nervoso Central (SNC), associadas com o aumento da permeabilidade da barreira hematoencefálica ou à produção intratecal de imunoglobulinas.(13) Valores anormalmente baixos estão presentes quando há perda de fluido no SNC.(10) O aumento de proteínas no LCR é observado em infecções, hemorragias intracranianas, esclerose múltipla, Guillain-Barré, malignidades, algumas anormalidades endócrinas, uso de alguns medicamentos e uma variedade de condições inflamatórias.(14)
A Síndrome de Guillain-Barré é a maior causa de paralisia flácida generalizada no mundo.(15) É descrita como uma tríade composta por: fraqueza muscular progressiva, arreflexia e aumento das proteínas (>45 mg/dL) no LCR, sem pleocitose (£10 células mononucleares/mm3).(16) Esses achados laboratoriais são característicos e evidentes em 80% dos pacientes após a segunda semana da doença.(15)
Outra patologia em que se observa uma proteinorraquia é a esclerose múltipla (EM), que é uma doença crônica do sistema nervoso central (SNC), de etiologia desconhecida, cujas manifestações iniciais ocorrem na adolescência e no adulto jovem, secundárias à desmielinização multifocal, por mecanismo autoimune.(17) Como consequência deste processo surgem as alterações no líquido cefalorraquidiano (LCR), características da doença, tais como a presença de bandas Imunoglobulina G (IgG) oligoclonais e aumento do índice de IgG, indicando a síntese intratecal de imunoglobulinas.(18)
O aumento de proteínas é a mais comum anormalidade encontrada no exame de LCR,(5) porém é um achado inespecífico e deve ser interpretado em correlação à apresentação clínica e outros achados laboratoriais.(8)
Uma punção traumática pode introduzir células sanguíneas no LCR, assim como o mesmo pode ocorrer com as proteínas plasmáticas. Por isso, para se avaliar o nível de proteínas, utiliza-se um cálculo de correção. Quando o hematócrito sanguíneo e os níveis séricos de proteínas forem normais, é aceitável subtrair 1 mg/dL de proteínas para cada 1.200 hemácias contadas.(10)
Em RN, o LCR geralmente é xantocrômico devido à elevação frequente dos níveis de bilirrubina e proteína nessa faixa etária,(14) em razão da imaturidade da barreira hematoencefálica nos RN.(19)
Lactato
Os níveis de lactato no LCR, diferentes dos níveis de glicose, não estão vinculados à concentração sanguínea, e sim à sua produção intratecal.(3)
Com exceção da doença mitocondrial, o lactato no LCR se correlaciona inversamente com o valor da relação de glicose no LCR/soro. Um aumento do nível de lactato pode ser detectado mais cedo do que uma concentração reduzida de glicose.(20) Por isso, para a diferenciação de meningite bacteriana de uma meningite asséptica, a concentração de lactato é um melhor indicador comparado a outros marcadores convencionais.(21)
Os níveis de lactato é particularmente importante quando a coloração de Gram é negativa e há um predomínio de polimorfonucleares, com glicose baixa.(6)
A produção de níveis aumentados de lactato no LCR ocorre devido a uma destruição do tecido dentro do SNC, causado pela privação de oxigênio. Por isso, a elevação de lactato no LCR não se limita à meningite e pode ser resultante de qualquer quadro clínico que reduza o fluxo de oxigênio para os tecidos,(10) apesar de ser utilizada principalmente no diagnóstico diferencial entre as meningites bacterianas e virais.(3) Os níveis de lactato são frequentemente utilizados para monitoramento de graves lesões na cabeça,(10) considerado um marcador estabelecido de traumatismo crânio-encefálico (TCE).(22)
Lactato Desidrogenase (LD)
A LD é uma enzima citoplasmática presente em praticamente todos os principais sistemas de órgãos.(23) Estudos têm demonstrado que pacientes com patologia intracraniana, como malignidade ou infecção bacteriana, apresentam níveis de LD no LCR maiores comparados a pacientes saudáveis.(24)
Em condições normais, a atividade da LD no LCR é bem menor do que a encontrada no soro sanguíneo. Em RN, elevações da LD são observadas em hemorragias intracranianas e estão de forma significativa associadas com distúrbios neurológicos, com convulsões e hidroencefalia.(25)
A LD é útil na diferenciação de uma punção traumática de uma hemorragia intracraniana, já que, em uma punção traumática com hemácias não hemolisadas, não há um aumento significante da LD.(5)
Adenosina Deaminase (ADA)
ADA é uma enzima que está amplamente distribuída em quase todos os tecidos(26) e que participa no metabolismo das purinas, onde ela degrada a adenosina produzindo inosina.(27) O seu papel crítico e ação fisiológica básica é a proliferação, maturação e funcionamento de células linfoides. Sua atividade aumenta em pacientes com deficiência na imunidade celular.(28)
Numerosos estudos têm demonstrado que a dosagem de ADA no LCR é útil no diagnóstico de meningite tuberculosa,(29) embora não seja patognomônico desta doença,(27) podendo ocorrer também aumento da atividade de ADA em pacientes com linfomas e leucemias (especialmente de células T), em neurosarcoidose, em meningites bacterianas graves ou complicadas, em neurobrucelose, em neurocriptococose e no soro de pacientes infectados com o vírus HIV (human immunodeficiency virus).(30)
Nos últimos anos têm sido realizadas várias pesquisas com o objetivo de investigar o aumento dos níveis de ADA em pacientes infectados com HIV. Foi verificado que nesses pacientes há um aumento progressivo da atividade de ADA, acompanhando a evolução natural da doença. O mecanismo fisiopatológico não está bem definido, mas os linfócitos CD4 e macrófagos são apontados como sendo responsáveis por aumento da atividade da enzima.(31)
Análise citológica
Leucócitos e Hemácias
A contagem total de leucócitos no LCR representa o mais sensível parâmetro para caracterização de uma doença inflamatória do sistema nervoso central (SNC).(32)
Identificar o tipo ou tipos de células presentes no LCR é uma ajuda valiosa de diagnóstico,(10) pois, conforme a linhagem celular predominante nessa contagem, é possível se estabelecer uma conduta terapêutica adequada de acordo com o significado clínico desse resultado.(4)
Em um LCR de um adulto normal, há uma predominância de linfócitos (60%-70%), seguido de monócitos (30%-50%), e, em menor quantidade, de neutrófilos (1%-3%).(1) Em crianças há uma maior proporção de monócitos, nos quais até 80% podem ser observados em um LCR normal.(5) Ocasionalmente, pode-se observar isoladamente eosinófilo ou neutrófilo no LCR normal.(14)
Para uma melhor conduta médica, a contagem global e diferencial de leucócitos no LCR não deve ser usada isoladamente, na tentativa de se distinguir entre meningite viral, bacteriana, fúngica ou tuberculosa. A condição clínica do paciente, assim como outros parâmetros do LCR, devem ser levados em consideração na formulação do diagnóstico e do tratamento.(4)
A linfocitose é vista em infecções virais, fúngicas e tuberculosas do SNC,(14) embora um aumento de neutrófilos possa ser observado nas fases iniciais (24 a 48 horas) dessas infecções.(10) Em meningite bacteriana, o LCR apresenta tipicamente o predomínio de neutrófilos, entretanto mais de 10% dos casos de meningite bacteriana apresentam predominância de linfócitos, especialmente no início do curso clínico e quando há menos de 1.000 leucócitos/mm3.(14)
O LCR normal não apresenta hemácias.(6) A presença isolada de hemácias é frequentemente associada ao resultado de uma punção traumática.(33) Se presente em grandes quantidades (com exceção da punção traumática), é provável que haja um processo patológico.(5)
Quando há presença de hemácias no LCR, a distinção de uma punção traumática de uma hemorragia patológica é de vital importância. Embora a presença de hemácias crenadas não seja útil,(5) três exames visuais do LCR podem usualmente determinar se o sangue é resultado de uma hemorragia ou uma punção traumática: prova dos três tubos, formação de coágulo e sobrenadante xantocrômico após centrifugação ou sedimentação espontânea.(10)
A prova dos três tubos se fundamenta no fato de que o sangue proveniente de uma hemorragia cerebral estará uniformemente distribuído ao longo dos três tubos de LCR, enquanto que em uma punção traumática haverá uma maior concentração de sangue no primeiro tubo.(10) Entretanto, esse método de diferenciação não é sempre confiável, principalmente quando há presença de um alto número de hemácias.(34)
A formação de coágulo pode acontecer em casos de punção traumática devido à introdução de fibrinogênio do plasma; já um LCR hemorrágico causado por hemorragia não contém fibrinogênio suficiente para coagular.(10)
Xantocromia é uma coloração amarelada, laranja ou rosa do LCR, mais frequentemente causada pela lise de hemácias, resultando em quebra de hemoglobina para meta-hemoglobina oxi-hemoglobina, e bilirrubina.(14) As hemácias permanecem cerca de duas horas no LCR antes de se ter uma hemólise visível, por isso, um sobrenadante xantocrômico seria o resultado de sangue que está presente por mais tempo do que o introduzido pela punção traumática.(10) A xantocromia está presente em mais de 90% dos pacientes no período de 12 horas do início da hemorragia intracraniana.(14)
Embora a contagem de hemácias tenha um valor diagnóstico limitado, pode ser útil na interpretação do valor real de leucócitos ou proteína total na presença de uma punção traumática,(5) já que, nessa situação, o LCR tem um aumento das células e das proteínas devido à introdução no LCR desses elementos a partir do sangue. Em termos práticos, considera-se que a cada 700 a 1.000 hemácias/mm³ aumenta 1 leucócito/mm³. Esta correção é válida apenas para punção lombar traumática.(6)
MATERIAL E MÉTODO
Foram realizadas buscas nas bases de dados Medline/Pubmed, Lilacs/SciELO e Web of Science, à procura de artigos nacionais e internacionais, com o termo “Líquido cefalorraquidiano”. Para busca de artigos relacionados às variáveis que pesquisamos, foram incluídos os termos “glicose”, “proteína”, “lactato desidrogenase”, “lactato”, “adenosina deaminase”, “leucócitos”, “hemácias” e “valores de referência”. Todos os termos foram pesquisados nas línguas portuguesa e inglesa.
Realizou-se a seleção inicial dos artigos com base nos títulos e resumos e, após verificação do conteúdo apropriado ao tema, buscou-se o texto completo. Foram selecionados os artigos que apresentavam uma fundamentação teórica de LCR e que traziam informações de valores de referência dos exames pesquisados.
As buscas não foram restritas para data, e de todos os artigos revisados foram incluídos aqueles de interesse para a elaboração do trabalho, não havendo critério de exclusão, tendo em vista a necessidade de revisão abrangente. Outras fontes consultadas foram livros.
Foram selecionados 58 trabalhos científicos para a elaboração deste artigo, sendo que, desses, 32 foram utilizados para a tabulação dos valores normais de exames bioquímicos no LCR em adultos, em RN e crianças até 10 anos; 13 trabalhos para a tabulação de valores normais de leucócitos e hemácias no LCR em adultos; e 9 para valores normais de leucócitos e hemácias no LCR em RN.
RESULTADOS E DISCUSSÃO
Foram selecionados estudos de LCR que apresentavam valores de referência da análise bioquímica e citológica realizados entre o ano de 1964 e 2013. Os valores de referência desses estudos estão descritos nas tabelas em ordem cronológica de realização ou de sua publicação.
Na Tabela 1 estão avaliados os valores normais de lactato no LCR em adultos conforme dez referências bibliográficas. O valor mais elevado de lactato encontrado foi observado por Almeida et al.,(6) considerando como normal um valor até 3,5 mmol/L. Em 2001, Cabeça et al.(35) avaliaram como normal um valor até 2,1 mmol/L, não identificando um valor mínimo normal para esse exame.
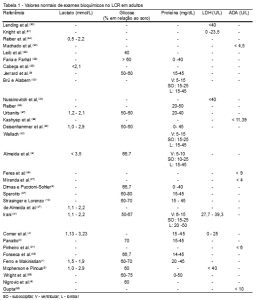
Ferro e Makinistian(1) apresentaram o menor valor considerado como normal dentre os artigos pesquisados, apresentando um limite superior de lactato de 1,9 mmol/L.
Apenas um estudo apresentou diferença nos valores de referência para lactato no LCR de RN. Mcpherson e Pincus(5) avaliaram como normal para menores de dois dias o valor de 1,1 a 6,7 mmol/L e para RN de três a dez dias o valor de 1,1 a 4,4 mmol/L (Tabela 2).
De acordo com os estudos pesquisados que avaliaram os valores normais em adultos, observamos na Tabela 1 que os valores de referência de glicose no LCR variaram de 40% – 80% do valor da glicemia, sendo que Leib et al.(36) apresentaram a menor porcentagem (40%) e Sperotto(37) a maior, considerando normal um valor até 80% da glicemia.
Faria e Farhat(38) apresentaram uma diferenciação dos valores de glicose para adultos e RN, observando que, em RN, a glicose corresponde em média a 75%-80% da glicemia, sofrendo amplas variações (Tabela 2).
Os valores de referência para proteínas no LCR em adultos variaram de 0-50 mg/dL, sendo que o valor de 15-45 mg/dL considerado como normal, foi o mais citado pelos estudos. Oito dos 17 estudos avaliados apresentaram essa faixa de normalidade de proteínas no LCR colhido por punção lombar.
Embora discrepâncias em gênero e pessoas com idade maior que 60 anos tenham sido reportadas, essa diferença não é significante na avaliação dos valores de proteínas no LCR. Entretanto, RN apresentam níveis de proteínas no LCR significativamente elevados em relação a crianças e adultos.(5) Assim, a concentração normal de proteína no LCR deve ser relatada de acordo com a idade do paciente.(20)
Outro fator que deve ser considerado quando são estabelecidos os valores normais de proteínas do LCR é a via de colheita das amostras.(39) Limites superiores normais de concentração de proteínas também diferem de acordo com a técnica e análise do laboratório.(20)
Em RN, a concentração de proteínas no LCR é elevada, mas decresce gradativamente durante o primeiro ano de vida, e é mantida em baixos níveis na infância.(20)
Há poucos estudos que fazem essa diferenciação. No nosso trabalho podemos observar, na Tabela 2, os valores de referência de proteínas no LCR em crianças e RN obtidos por punção lombar.
Comar et al.(4) relataram os valores de referência de acordo com a idade, classificando como valor normal de punção lombar em RN de 15 mg/dL-100 mg/dL (Tabela 2).
De acordo com Faria e Farhat,(38) a concentração média de proteínas no LCR em RN a termo é de 90 mg/dL (20-170 mg/dL) e, nos prematuros, a média é de 115 mg/dL (65-150 mg/dL). Já Mcpherson e Pincus(5) apresentaram um valor de referência normal até 150 mg/dL para recém-nascidos a termo e de até 170 mg/dL para prematuros (Tabela 2).
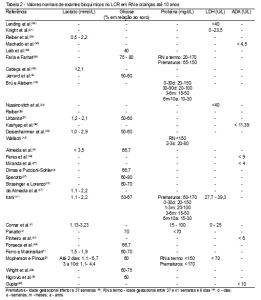
Brú e Alabern(40) e Irani(41) classificaram os valores de acordo com faixas etárias de 0 a 30 dias, 1 a 3 meses, 3 a 6 meses e 6 meses a 10 anos; sendo respectivamente os valores considerados normais de 20-150 mg/dL, 20-100 mg/dL, 15-50 mg/dL, 15-30 mg/dL. Além dos valores de referência dessas faixas etárias, Irani(41) também apresentou o valor normal de proteínas em prematuros, como sendo de 60 a 170 mg/dL. Pode-se constatar, por esses valores, a maior concentração de proteínas em RN com um decréscimo desse valor até a vida adulta (Tabela 2).
Postura e atividade física podem influenciar na concentração de proteínas, resultando em um aumento em pacientes inativos e acamados.(20)
Em 2009, Irani(41) observou que os valores de proteínas no LCR obtidos pela punção ventricular apresentaram as menores concentrações (6-15 mg/dL), enquanto que amostras obtidas por punção suboccipital apresentaram concentrações intermediárias (15-25 mg/dL) comparadas à amostra de coleta lombar apresentada na Tabela 1, assim como Wallach(42) e Brú e Alabern,(40) que observaram concentrações de amostra por punção ventricular de 5-15 mg/dL e suboccipital de 15-25 mg/dL, e Almeida et al.(6) o valor de referência de 5-10 mg/dL para punção ventricular e 10-25 mg/dL em punção suboccipital.
Estudos recentes mostram que essa diferença no valor de proteínas em relação ao local da coleta ocorre devido à permeabilidade da barreira hematoliquórica, que se apresenta mais permeável às proteínas na região lombar.(41)
O valor diagnóstico de LD total em meningite permanece controverso. Alguns autores concluíram que, apesar da alta sensibilidade para a detecção de meningite bacteriana, este valor não apresenta vantagem sobre outros marcadores do LCR.(24)
Pesquisas e artigos sobre os níveis de concentração de ADA em meningite tuberculosa são limitados. Chander e Shrestha(43) mostraram que os níveis de ADA no LCR são elevados em casos de meningite tuberculosa comparados com meningite não tuberculosa com uma boa sensibilidade e alta especificidade. Os resultados de ADA devem ser interpretados de acordo com achados clínicos e outros exames.
Os resultados dos estudos são variáveis e alguns deles demonstraram que a atividade de ADA no LCR tem um valor diagnóstico limitado para tuberculose. Diferentes sensibilidades e especificidades foram reportadas pelo uso de diferentes valores de cut-off de acordo com a variabilidade de metodologias e projetos de estudo.(28) Diferentes raças também podem apresentar uma variabilidade nesses valores.(44)
Em nosso estudo observamos essa variabilidade, sendo que Miranda et al.(27) apresentaram o menor valor de referência para ADA, considerando <4 U/L e Kashyap et al.(29) o maior valor dos estudos avaliados, considerando < 11,39 U/L.
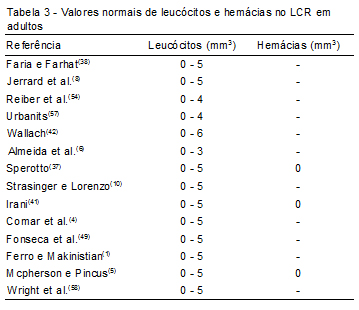
Os valores de referência de leucócitos no LCR em adultos não apresentaram ampla variância, sendo observado o valor máximo de 3 em um estudo e de 5 na maioria deles (Tabela 3).
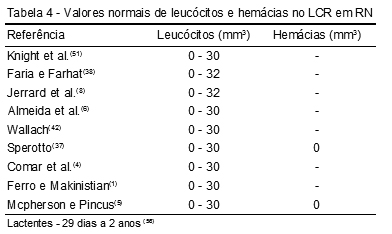
De acordo com Faria e Farhat(38) e Jerrard et al.,(8) durante a primeira semana de vida, o LCR normal contém em média 8 leucócitos/mm3, mas valores até 32 leucócitos/mm3 têm sido observados em RN não infectados. Já os outros seis estudos que avaliaram os valores de referência em RN mostraram um valor normal de até 30 leucócitos/mm3.
Apenas Comar et al.(4) classificaram o número de leucócitos normal separados em várias faixas etárias da seguinte forma: < 1 ano (0-30 leucócitos/mm3), 1-4 anos (< 20 leucócitos/mm3), 5 anos até a puberdade (< 10 leucócitos/mm3) e adultos (0-5 leucócitos/mm3).
Apenas três estudos descreveram o valor de referência de hemácias apresentando o valor de 0, que não há hemácias no LCR normal.
A contagem de leucócitos no LCR varia conforme a idade, por isso é imprescindível que se avalie cada faixa etária independentemente.(45) O LCR normal de neonatos apresenta uma contagem imprecisa de leucócitos, que pode variar de 0-30 leucócitos/mm3. A maior permeabilidade da barreira hematoencefálica imatura do RN tem sido apontada como a principal causa dessa alteração.(46) (Tabela 4)
A análise do LCR auxilia os clínicos na identificação de pacientes com meningite ou encefalite e, portanto, requer o conhecimento de valores de referência precisos de contagem de leucócitos. A determinação dos valores normais para LCR em lactentes e recém-nascidos é um desafio. Não é ética a avaliação de crianças saudáveis com um procedimento doloroso, potencialmente prejudicial num momento em que eles não podem fornecer um consentimento por escrito ou verbal, portanto, os valores de referência devem ser baseados em crianças que não são totalmente saudáveis; geralmente, os valores são determinados a partir de bebês que se submetem a punção lombar por suspeita de meningite.(55)
CONCLUSÃO
Os estudos abordados nesta revisão mostraram que ainda não existe uma padronização dos valores de referência para o exame de LCR. Apesar disso, os trabalhos não apresentaram uma ampla variância nesses valores.
Apesar da escassez de trabalhos sobre o assunto, esta revisão contribui para a ampliação dos conhecimentos no exame do LCR. A escassez de estudos no LCR se deve à carência de profissionais especializados nesse tipo de análise e a menor demanda do exame em relação a outros fluidos, o que acarreta maior custo na implantação de procedimentos de qualidade.
Abstract
The cerebrospinal fluid (CSF) is a colorless liquid that circulates the brain and spinal cord through the subarachnoid space, cerebral ventricles and the central canal of the spinal cord. The CSF examination provides important information regarding the etiological diagnosis and monitoring of inflammatory, infectious or neoplastic organs that are involved in this liquid. The examination shall include an analysis of the physical, biochemical and cytological CSF. Setting the ranges of reference is a challenging task for all clinical laboratories, being essential for laboratories provide reliable information that clinicians can correctly interpret the results and choose the best approach towards the assisted population. Searches were conducted in Medline / Pubmed, LILACS / SciELO and Web of Science, looking for articles that presented a theoretical foundation of the CSF with information of reference values of exams researched. Were tabulated values of biochemical tests for glucose, protein, lactate, LDH, ADA, and cytology of leukocytes and erythrocytes. The studies covered in this review showed that there is still no standardization of reference values for CSF examination. Nevertheless, the studies did not show a wide variance in these values.
Keywords
Cerebrospinal fluid; Reference Values; Data Analysis
REFERÊNCIAS
- Ferro RJ, Makinistian RL. El líquido cefalorraquídeo. Publicación digital de la 1ra Cátedra de Clínica Médica y Terapéutica y la Carrera de Posgrado de especialización en Clínica Médica. Facultad de Ciencias Médicas – Universidad Nacional de Rosario. 2011 Jul.
- Panatto APR. Avaliação do efeito de novos compostos com L-poli-lisina no dano oxidativo causado pela meningite pneumocócica em ratos wistar adultos. Criciúma. Trabalho de Conclusão de Curso – Universidade do Extremo Sul Catarinense – UNESC; 2009.
- Dimas LF, Puccioni-Sohler M. Exame do líquido cefalorraquidiano: influência da temperatura, tempo e preparo da amostra na estabilidade analítica. J Bras Patol Med Lab. 2008; 44(2):97-106.
- Comar SR, Machado NA, Dozza TG, Haas P. Análise citológica do líquido cefalorraquidiano. Estud Biol. 2009; 31(73/74/75):93-102.
- Mcpherson RA, Pincus MR. Henry’s clinical diagnosis and management by laboratory methods. 22ª ed. Philadelphia: Saunders, 2011.
- Almeida SM, Nogueira MB, Raboni SM, Vidal LC. Laboratorial diagnosis of lymphocytic meningitis. Braz J Infect Dis. 2007;11(5): 489-95.
- Bonavigo AG, Gelinski V, Costa GFM, Plewka J, Costa MA. Comparação entre a contagem manual e automatizada de células no líquido cefalorraquidiano. RBAC. 2009; 41(1):47-50.
- Jerrard DA, Hanna JR, Schindelheim GL. Cerebrospinal fluid. J Emerg Med. 2001 Aug;21(2):171-8.
- Nigrovic LE, Kimia AA, Shah SS, Neuman MI. Relationship between cerebrospinal fluid glucose and serum glucose. N Engl J Med. 2012;366 (6):576-8.
- Strasinger SK, Lorenzo MSD. Urinalysis and body fluids. 5ª ed. Philadelphia: F. A. Davis Company, 2008.
- Kaplan LA, Pesce AJ. Quimica clinica. Teoría, análisis y correlacion. Buenos Aires: Medica Panamericana, 1986.
- Lima AO, Soares BJ, Greco JB, Galizzi J, Cançado JR. Métodos de laboratório aplicados à clínica. 8ª ed. Rio de Janeiro: Guanabara Koogan S.A., 2001.
- Biou D, Benoist JF, Nguyen-Thi C, Huong X, Morel P, Marchand M. Cerebrospinal fluid protein concentrations in children: age-related values in patients without disorders of the central nervous system. Clin Chem. 2000;46(3):399-403.
- Seehusen DA, Reeves MM, Fomin DA. Cerebrospinal fluid analysis. Am Fam Physician. 2003;68(6):1103-8.
- Ministério da Saúde (Brasil). Portaria nº. 497, de 23 de dezembro de 2009. Protocolo Clínico e Diretrizes Terapêuticas – Síndrome de Guillain-Barré.
- Sampaio MJ, Figueiroa S, Temudo T, Gomes S, Janeiro P, Silva RL. Síndrome de Guillain-Barré em idade pediátrica. Protocolo de actuação. Acta Pediatr Port. 2011;42(1):33-42.
- Maciel EP. Esclerose múltipla: correlação clínica, líquido cefalorraquidiano e neuroimagem. Campinas. Tese de Doutorado – Universidade Estadual de Campinas – UNICAMP; 2002.
- Puccioni-Sohler M, Lavrado FP, Bastos RRG, Brandão CO, Alvarenga RP. Esclerose múltipla: correlação clínico-laboratorial. Arq Neuropsiquiatr. 2001; 59(1):89-91.
- Koneski JAS. Características bioquímicas e citologia do líquido cefalorraquidiano de recém-nascidos a termo com asfixia perinatal. Florianópolis. Tese de Mestrado – Universidade Federal de Santa Catarina; 2006.
- Deisenhammer F, Bartos A, Egg R, Gilhus NE, Giovannoni G, Rauer S, Sellebjerg F; EFNS Task Force. Guidelines on routine cerebrospinal fluid analysis. Report from an EFNS task force. Eur J Neurol. 2006 Sep;13(9):913-22.
- Huy NT, Thao NT, Diep DT, Kikuchi M, Zamora J, Hirayama K. Cerebrospinal fluid lactate concentration to distinguish bacterial from aseptic meningitis: a systemic review and meta-analysis. Crit Care. 2010;14(6):R240.
- Zehtabchi S, Sinert R, Soghoian S, Liu Y, Carmody K, Shah L, et al. Identifying traumatic brain injury in patients with isolated head trauma: are arterial lactate and base deficit as helpful as in polytrauma? Emerg Med J. 2007 May;24(5):333-5.
- Drent M, Cobben NA, Henderson RF, Wouters EF, van Dieijen-Visser M. Usefulness of lactate dehydrogenase and its isoenzymes as indicators of lung damage or inflammation. Eur Respir J. 1996 Aug;9 (8):1736-42.
- Nussinovitch M, Prais D, Finkelstein Y, Harel D, Amir J, Volovitz B. Lactic dehydrogenase isoenzymes in cerebrospinal fluid of children with Guillain-Barré syndrome. Arch Dis Child. 2002 Sep;87(3):255-6.
- Motta VT. Bioquímica Clinica para o laboratório: princípios e interpretações. 5ª ed. Rio de Janeiro: Medbook, 2008, 419 p.
- Bota A, Gella FJ, Canalias F. Optimization of adenosine deaminase assay by response surface methodology. Clin Chim Acta. 2000 Jan 5;290(2):145-57.
- Miranda E, Peruchi MM, Lin J, Masruha MR, Reis MLAA, Reis Filho JB. Atividade da adenosinadeaminase no líquido cefalorraquidiano. Rev Bras Neurol. 2008;44(2):5-11.
- Moghtaderi A, Niazi A, Alavi-Naini R, Yaghoobi S, Narouie B. Comparative analysis of cerebrospinal fluid adenosine deaminase in tuberculous and non-tuberculous meningitis. Clin Neurol Neurosurg. 2010 Jul;112(6):459-62.
- Kashyap RS, Kainthla RP, Mudaliar AV, Purohit HJ, Taori GM, Daginawala HF. Cerebrospinal fluid adenosine deaminase activity: a complimentary tool in the early diagnosis of tuberculous meningitis. Cerebrospinal Fluid Res. 2006 Mar 30;3:5.
- Machado LR, Livramento JA, Spina-França A. Adenosino-deaminase no líquido cefalorraqueano de pacientes com a síndrome de imunodeficência adquirida. Arq Neuropsiquiatr. 1995; 53(4):755-9.
- Pinheiro FV, Pimentel VC, Moresco RN, Moretto MB. Evaluation of cerebrospinal fluid adenosine deaminase activity in HIV-seropositive subjects and its association with lactate dehydrogenase and protein levels. Biomed Pharmacother. 2010 Apr;64(4):302-5.
- Reiber H, Peter JB. Cerebrospinal fluid analysis: disease-related data patterns and evaluation programs. J Neurol Sci. 2001 Mar 1;184(2):101-22.
- Arora S, Swadron SP, Dissanayake V. Evaluating the sensitivity of visual xanthochromia in patients with subarachnoid hemorrhage. J Emerg Med. 2010 Jul;39(1):13-6.
- Gorchynski J, Oman J, Newton T. Interpretation of traumatic lumbar punctures in the setting of possible subarachnoid hemorrhage: who can be safely discharged? Cal J Emerg Med. 2007 Feb;8(1):3-7.
- Cabeça HLS, Gomes HR, Machado LR, Livramento JA. Dosage of lactate in the cerebrospinal fluid in infectious diseases of the central nervous system. Arq Neuropsiquiatr. 2001 Dec;59(4):843-8.
- Leib SL, Boscacci R, Gratzl O, Zimmerli W. Predictive value of cerebrospinal fluid (CSF) lactate level versus CSF/blood glucose ratio for the diagnosis of bacterial meningitis following neurosurgery. Clin Infect Dis. 1999 Jul;29(1):69-74.
- Sperotto RL. Hidrólise de ATP e ADP em líquor humano. Santa Maria. Tese de mestrado – Universidade Federal de Santa Maria; 2008.
- Faria SM, Farhat CK. Bacterial meningitis – diagnosis and treatment. J Pediatr (Rio J). 1999 Jul;75 Suppl 1:S46-56. [Article in Portuguese].
- Vermes LMS. Proteínas do líquido cefalorraqueano. Arq. Neuro-Psiquiatria. 1983;41(1):10-24.
- Brú CM, Alabern IL. Recomendaciones para el estudio de las proteínas del líquido cefalorraquídeo. Química Clínica, 2000; 21(2):83-90.
- Irani DN. Cerebrospinal fluid in clinical practice. 1ª ed. Philadelphia: Saunder Elsevier, 2009.
- Wallach JB. Interpretation of diagnostic tests. 8ª ed. Lippincott Williams & Wilkins, 2007.
- Chander A, Shrestha CD. Cerebrospinal fluid adenosine deaminase levels as a diagnostic marker in tuberculous meningitis in adult Nepalese patients. Asian Pac J Trop Dis. 2013;3(1):16-9.
- Choi S, Kim YS, Bae I, Chung J, Lee MS, Kang JM, et al. The possible role of cerebrospinal fluid adenosine deaminase activity in the diagnosis of tuberculous meningitis in adults. Clin Neurol Neurosurg. 2002;104:10-5.
- Kestenbaum LA, Ebberson J, Zorc JJ, Hodinka RL, Shah SS. Defining cerebrospinal fluid white blood cell count reference values in neonates and young infants. Pediatrics. 2010;125(2): 257-64.
- Martín-Ancel A, García-Alix A, Salas S, Castillo F, Cabañas F, Quero J. Cerebrospinal fluid leucocyte counts in healthy neonates. Arch Dis Child Fetal Neonatal Ed. 2006; 91:F357-F358.
- de Almeida SM, Faria FL, de Goes Fontes K, Buczenko GM, Berto DB, Raboni SM, et al. Quantitation of cerebrospinal fluid lactic acid in infectious and non-infectious neurological diseases. Clin Chem Lab Med. 2009;47(6):755-61.
- Feres MC, Martino MC, Maldijian S, Batista F, Júnior AG, Tufik S. Validação laboratorial de um método automatizado de dosagem da atividade de adenosina desaminase em líquido pleural e em líquido cefalorraquidiano. J Bras Pneumol. 2008; 34(12):1033-9.
- Fonseca FM, Santana SC, Fonseca MM, Terra APS, Sarmento RR. Diagnóstico laboratorial das meningites bacterianas. R. Ci. md. biol. 2011;10(1):77-81.
- Gupta BK, Goel P, Baruah H, Shukla P, Kiran J. Cerebrospinal fluid Adenosine deaminase: its evaluation as a marker for diagnosing tuberculous meningitis in paediatric patients. Journal of Dental and Medical Sciences. 2013;4(1): 21-4.
- Knight JA, Dudek SM, Haymond RE. Early (chemical) diagnosis of bacterial meningitis-cerebrospinal fluid glucose, lactate, and lactate dehydrogenase compared. Clin Chem. 1981 Aug;27(8):1431-4.
- Lending M, Slobody LB, Mestern J. Cerebrospinal fluid glutamic oxaloacetic transaminase and lactic dehydrogenase activities in children with neurologic disorders. J Pediatr. 1964 Sep;65:415-21.
- Reiber H. Beta-trace protein concentration in nasal secretion: discrepancies and flaws in recent publications. Acta Neurol Scand 2004;110:339-41.
- Reiber H, Ruff M, Uhr M. Ascorbate concentration in human cerebrospinal fluid (CSF) and serum. Intrathecal accumulation and CSF flow rate. Clin Chim Acta. 1993 Aug 31;217(2):163-73.
- Secretaria de Assistência à Saúde. Manual de assistência ao recém-nascido. Brasília-DF: Ministério da Saúde; 1994.
- Secretaria de Políticas de Saúde. Saúde da criança: acompanhamento do crescimento e desenvolvimento infantil. Brasília-DF: Ministério da Saúde; 2002.
- Urbanits S. Cellular diagnostics of CSF. J Int Fed Clin Chem. 2004;15(3).
- Wright BL, Lai JT, Sinclair AJ. Cerebrospinal fluid and lumbar puncture: a practical review. J Neurol. 2012; 259(8):1530-45.
Correspondência
Laísa Vieira Gnutzmann
Hospital Universitário do Oeste do Paraná
Av. Tancredo Neves, 3224 – Santo Onofre
85806-470 – Cascavel, PR
