Análise da temperatura, do tempo e da relação sangue/ anticoagulante no hemograma
Analysis of temperature, time and blood/anticoagulant ratio in the complete blood count
Larissa Seniv1
Mackelly Simionatto2
Bruno Ribeiro Cruz3
Danielle Cristyane Kalva Borato4
1Graduanda em Farmácia pela Universidade Estadual de Ponta Grossa (UEPG) – Ponta Grossa, PR, Brasil.
2Mestre em Ciências Farmacêuticas pela Universidade Federal do Paraná (UFPR), Professora da Universidade Estadual de Ponta Grossa (UEPG), PR, Brasil.
3Mestre em Medicina (Hematologia) pela Universidade Federal de São Paulo (UNIFESP), Professor da Universidade Estadual de Ponta Grossa (UEPG)
PR, Brasil.
4Mestre em Ciências Farmacêuticas pela Universidade Estadual de Ponta Grossa (UEPG), Professora da Universidade Estadual de Ponta Grossa (UEPG)
PR, Brasil.
Instituição: Universidade Estadual de Ponta Grossa (UEPG) – Ponta Grossa, PR, Brasil
Suporte financeiro: Próprio
Artigo recebido em 28/10/2016
Artigo aprovado em 14/12/2016
DOI: 10.21877/2448-3877.201600545
Resumo
Objetivo: Verificar o impacto da fase pré-analítica na avaliação quantitativa do hemograma, no dia-a-dia do laboratório clínico, como: a temperatura de armazenamento e o efeito do anticoagulante de acordo com o tempo de estocagem após coleta. Métodos: Foram coletadas 60 amostras biológicas de sangue venoso, sendo distribuídas em dois tubos de EDTA K2 respeitando a relação sangue/anticoagulante e dois tubos com alteração nesta relação. Estas amostras foram armazenadas de diferentes formas: em temperatura ambiente (25°C) e em temperatura de 4°C. Posteriormente, as amostras foram analisadas em contador hematológico, em diferentes tempos de estocagem 2, 5, 12 e 24 horas após a coleta. Resultados: Verificou-se que, durante as 24 horas de estocagem, a maioria dos parâmetros não apresentou alteração significativa, com exceção do percentual de células médias. Além disso, observou-se que as amostras armazenadas sob refrigeração apresentam valores mais estáveis, com exceção de alguns parâmetros, como: percentual de granulócitos, VPM e PDW, que apresentaram oscilações quando armazenados a 4°C, principalmente para as amostras com alteração da relação sangue/anticoagulante. Conclusão: O presente estudo demonstrou que os fatores pré-analíticos podem afetar a variabilidade dos parâmetros quantitativos do hemograma, devendo-se respeitar a correta relação sangue/anticoagulante e evitar o processamento da amostra após longos períodos de estocagem.
Palavras-chave
Contagem de células sanguíneas; Hemograma; Preservação
INTRODUÇÃO
O hemograma é o mais frequente exame laboratorial solicitado atualmente na prática clínica,(1) sendo decisivo para o diagnóstico, acompanhamento e tratamento de diversos distúrbios hematológicos; contanto que, a qualidade durante todo o processo do teste seja garantida.(2) Desta forma, é necessário que os resultados hematológicos sejam exatos e precisos para assegurar a interpretação dos resultados no momento da decisão clínica pelo médico.(3)
Porém, muitos fatores pré-analíticos podem afetar a variabilidade dos resultados laboratoriais, como: a estabilidade da amostra (temperatura de armazenamento e o tempo de estocagem) e os efeitos dos anticoagulantes.(3)
A estabilidade da amostra biológica pode ser definida como a capacidade da manutenção do resultado inicial, por um período de tempo definido, dentro de limites específicos, quando armazenada em condições definidas.(6)
Porém, na prática laboratorial existem algumas situações que promovem atraso no processamento do hemograma, contribuindo para modificações na estabilidade da amostra, como: as amostras de sangue enviadas para laboratórios de referência distantes do local da coleta, a análise não realizada por algum problema técnico ou a solicitação de uma nova amostra necessária para verificar o resultado do teste.(2)
Como frequentemente os laboratórios recebem amostras armazenadas em temperatura ambiente e com um expressivo intervalo de tempo após a coleta, isto pode representar erro pré-analítico bastante comum,(5) pois quando as amostras chegam com atraso significativo e em péssimas condições de armazenamento, os valores obtidos podem estar errados, comprometendo a confiabilidade, precisão e exatidão do resultado hematológico.(6)
Com relação aos efeitos do anticoagulante, o EDTA K2 (ácido etilenodiamino tetra-acético dipotássico) é recomendado como o anticoagulante de escolha para coleta das amostras na realização do hemograma.(7) Quando está presente na concentração de 1,5 a 2,2 mg/mL de sangue, não apresenta efeito expressivo sobre os parâmetros do hemograma.(8)
Porém, quando a quantidade de sangue colocada no tubo de EDTA não é respeitada e/ou quando o tempo de estocagem da amostra biológica torna-se prolongado podem produzir alterações significativas nos resultados; desta forma, torna-se necessário o mínimo de cuidado com a relação sangue/anticoagulante.(3,7,9)
Portanto, o objetivo do presente estudo é verificar o impacto da fase pré-analítica na avaliação quantitativa do hemograma, como: a temperatura de armazenamento e o efeito do anticoagulante de acordo com o tempo de estocagem após coleta.
MATERIAL E MÉTODOS
Foram coletadas sessenta amostras biológicas de sangue venoso de indivíduos ed ambos os sexos, com idade superior a 18 anos, sendo excluídos do estudo fumantes, indivíduos com doença infecciosa, inflamatória ou clínica para qualquer patologia, uso de qualquer medicamento que pudesse alterar os resultados hematológicos e exercício físico realizado antes da coleta de sangue.
As amostras foram coletadas conforme procedimento padrão, com agulha e seringa estéreis. O sangue total coletado foi distribuído em quatro tubos com anticoagulante EDTA K2, sendo que dois tubos respeitavam a correta relação sangue/anticoagulante, com a inserção de 2 mL de sangue em cada tubo, e dois tubos apresentavam alteração da proporção sangue/anticoagulante, com a inclusão de 1 mL de sangue em cada tubo. Estas amostras foram armazenadas de diferentes formas: em temperatura ambiente (25°C) e em temperatura de 4°C.
Por conseguinte, as amostras foram divididas em quatro grupos para análise: 1) Temperatura Ambiente, 2) Temperatura Ambiente com Alteração Sangue/Anticoagulante, 3) Refrigerado a 4°C e 4) Refrigerado a 4°C com Alteração Sangue/Anticoagulante.
Posteriormente, as amostras foram analisadas em contador hematológico Hemacounter 60-RT 7600® (Hemogram, Brasil) em diferentes tempos de estocagem 2, 5, 12 e 24 horas após a coleta. Os parâmetros hematológicos analisados foram: i) Eritrograma: contagem de eritrócitos, hemoglobina, hematócrito, Volume Corpuscular Médio (VCM), Hemoglobina Corpuscular Média (HCM), Concentração Hemoglobínica Corpuscular Média (CHCM) e Amplitude de Distribuição Eritrocitária (Red Cell Distribution Width – RDW); ii) Leucograma: contagem de leucócitos totais e a porcentagem de três subpopulações – linfócito, células de tamanho médio (incluindo monócitos, basófilos e eosinófilos) e granulócitos e iii) Plaquetograma: contagem de plaquetas, Volume Médio de Plaquetas (VPM) e Amplitude de Distribuição Plaquetária (Platelets Distribution Width – PDW).
Na análise estatística foi realizado o teste de Shapiro-Wilk para verificar a normalidade dos dados. Todos os parâmetros demonstraram distribuição normal. Portanto, os resultados foram apresentados como média e, para comparação entre as médias dos parâmetros hematológicos de acordo com os tempos 2, 5, 12 e 24 horas após a coleta, para os quatro grupos do estudo, foi utilizada a análise de variância (ANOVA) seguida do pós-teste de Tukey. Em todas as análises, o nível de significância foi pré-fixado em dep<0,05. Os dados foram analisados pelo programa estatístico SPSS 17® (Chicago, EUA).
Ética
Os voluntários que permitiram a utilização das amostras biológicas para realização desta pesquisa foram devidamente informados sobre os métodos e objetivos deste estudo e, após concordarem, assinaram um termo de consentimento livre e esclarecido. Este estudo foi aprovado pelo Comitê de Ética em Pesquisa da Universidade Estadual de Ponta Grossa (UEPG), parecer N° 1.339.496. Esta pesquisa foi realizada em conformidade com a Declaração de Helsinki.
RESULTADOS
Os parâmetros analisados no eritrograma estão representados na Figura 1. A média da contagem de eritrócitos apresentou um perfil de oscilação semelhante para a maioria das amostras. Os valores médios permaneceram homogêneos para ambas as formas de armazenamento (temperatura ambiente e refrigerado a 4°C); assim como, para relação sangue/anticoagulante, com alterações mínimas de 4,89 a 4,98 milhões de eritrócitos/µL após 24 horas de estocagem (Figura 1 – A).
Com relação às médias da dosagem de hemoglobina, as amostras armazenadas em temperatura ambiente com alteração na relação sangue/anticoagulante apresentaram um aumento progressivo mínimo durante as 24 horas (0,24 g/dL), enquanto que as demais amostras mostraram oscilações entre as médias de hemoglobina com relação aos tempos de estocagem; porém, mantiveram seus valores médios homogêneos, com variações inferiores a 0,14 g/dL durante as 24 horas (Figura 1 – B).
Na análise do hematócrito verificou-se que, durante as 24 horas de estocagem, as amostras armazenadas em temperatura ambiente sem e com alteração na relação sangue/anticoagulante demostraram aumento do valor médio dos resultados de 0,98% e 1,25%, respectivamente, enquanto que as amostras refrigeradas a 4°C, independente da relação sangue/anticoagulante, não demonstraram grandes oscilações nos resultados (Figura 1 – C).
Para a análise do VCM observaram-se dois perfis, o primeiro representado pelas amostras armazenadas em temperatura ambiente e o segundo, representado pelas amostras refrigeradas a 4°C, independente da relação sangue/anticoagulante. O primeiro perfil, em até 24 horas após a coleta, apresentou um aumento do valor médio dos resultados de 1,37 fL e 1,60 fL para as amostras sem e com alteração na relação sangue/anticoagulante, respectivamente. O segundo perfil não obteve grandes oscilações nos resultados em até 24 horas após a coleta (Figura 1 – D).
Nos resultados do HCM observou-se que a amostra armazenada em temperatura ambiente com alteração na relação sangue/anticoagulante apresentou uma elevação após 5 horas e decréscimo em até 12 horas; porém, estas oscilações foram ínfimas, enquanto que as outras amostras apresentaram um perfil de oscilação semelhante às das médias. Contudo, as amostras mantiveram seus valores médios homogêneos para as diferentes formas de armazenamento, independente da relação sangue/ anticoagulante, com diferenças menores que 0,24 pg, durante as 24 horas de estocagem (Figura 1 – E).
Nos valores de CHCM observou-se, após 24 horas de estocagem, queda das médias de 0,61% e 0,47% para os dois grupos de amostras armazenadas em temperatura ambiente sem e com alteração da relação sangue/anticoagulante, respectivamente. As amostras refrigeradas, independente da relação sangue/anticoagulante, mantiveram o mesmo perfil, com aumento após 5 horas, uma pequena queda em 12 horas e aumento em 24 horas; porém, estas oscilações foram ínfimas e os valores médios de CHCM permaneceram homogêneos durante as 24 horas de estocagem (Figura 1 – F).
Para as médias analisadas para o RDW, as amostras armazenadas em temperatura ambiente apresentaram um aumento gradativo ínfimo de 0,30 durante as 24 horas após a coleta; já as amostras refrigeradas não apresentaram uma variação nos valores e se mantiveram próximas a 12,85 (Figura 1 – G).
No entanto, apesar das oscilações de médias observadas em todos os parâmetros do eritrograma analisados, não houve diferença estatística para ambas as temperaturas de armazenamento e diferentes relações sangue/anticoagulante de acordo com o tempo de estocagem.
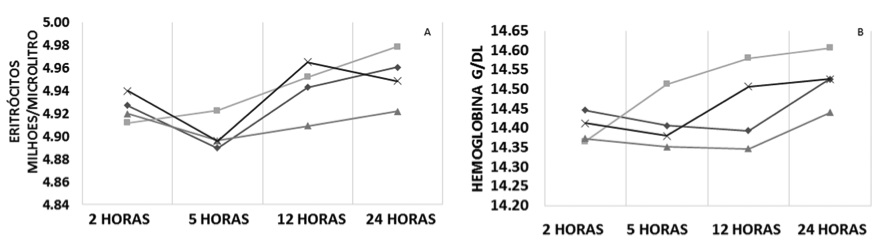
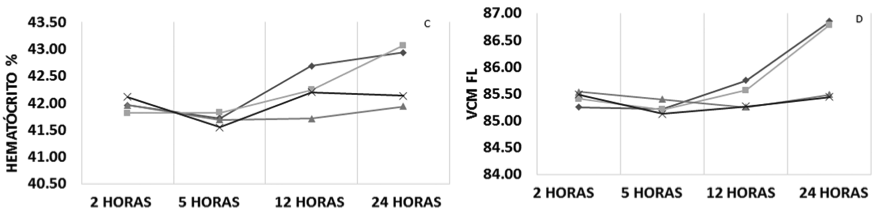
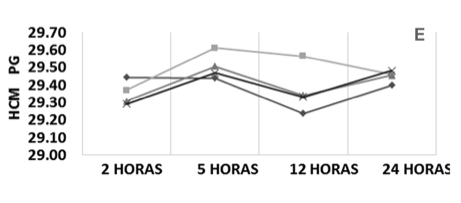

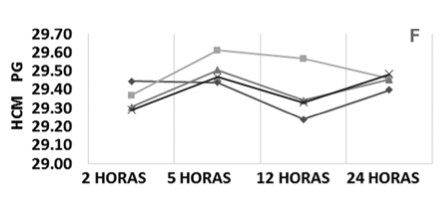
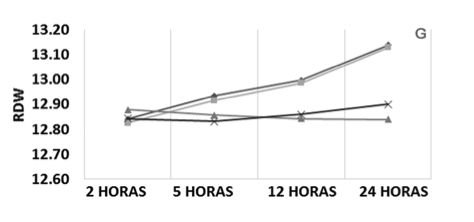
Figura 1. Perfil médio dos parâmetros do eritrograma conforme a relação sangue/anticoagulante, temperatura e tempo de estocagem. VCM, Volume Corpuscular Médio; HCM, Hemoglobina Corpuscular Média; CHCM, Concentração Hemoglobinica Corpuscular média; RDW, Amplitude de Distribuição das Hemácias.
Os resultados do leucograma estão representados na Figura 2. Analisando os leucócitos totais observa-se que as amostras armazenadas em temperatura ambiente com alteração da relação sangue/anticoagulante apresentam maior variação que as demais amostras. Porém, exibiram uma variação das médias menor que 400 células/µL durante as 24 horas de armazenamento. As demais amostras mantiveram um perfil semelhante, com valores médios homogêneos entre 6.500 e 6.700 leucócitos/µL durante as 24 horas de armazenamento. Desta forma, não foi observada diferença estatística para contagem de leucócitos totais (Figura 2 – A).
Os linfócitos apresentaram uma queda em cinco horas de 0,95% (34,57% para 33,62%) e um aumento em 24 horas de 1,49% (33,47% para 34,96%) para as amostras armazenadas em temperatura ambiente sem alteração da relação sangue/anticoagulante. Para as demais amostras, observou-se uma oscilação das médias durante as 24 horas; porém, não houve uma variação de média superior a 0,5 do percentual de linfócitos.
Apesar das oscilações observadas, não houve diferença estatística para este parâmetro do leucograma (Figura 2 – B).
Com relação ao percentual das células de tamanho médio (incluindo monócitos, basófilos e eosinófilos), os valores médios das amostras em temperatura ambiente sem ou com alteração da relação sangue/anticoagulante apresentaram aumento significativo de 8,34% para 11,00% (p=0,008) e 8,89% para 11,81% (p=0,022), respectivamente. Porém, as amostras armazenadas refrigeradas a 4°C com alteração da relação sangue/anticoagulante, demostraram uma diminuição significativa das médias de 11,61% em duas horas para 8,71% em 24 horas (p=0,029), enquanto que as armazenadas também a 4°C, sem alteração da relação sangue/anticoagulante, permaneceram com valores médios homogêneos durante as 24 horas após a coleta (Figura 2 – C).
Nos valores médios para o percentual de granulócitos, todas as amostras mantiveram ínfima variação em até 12 horas após a coleta. Porém, em 24 horas as amostras refrigeradas com alteração da relação sangue/anticoagulante tiveram um aumento de 2,67% (54,86% para 57,53%), enquanto que as demais amostras apresentaram uma queda das médias: em temperatura ambiente, sem alteração da relação sangue/anticoagulante, de 14,02% (57,66 para 43,64); em temperatura ambiente, com alteração da relação sangue/anticoagulante, de 12,89% (56,82 para 43,93) e refrigeradas a 4°C, sem alteração da relação sangue/ anticoagulante, de 4,67% (56,03% para 52,36%). Porém, não houve diferença estatística para o percentual de granulócitos (Figura 2 – D).
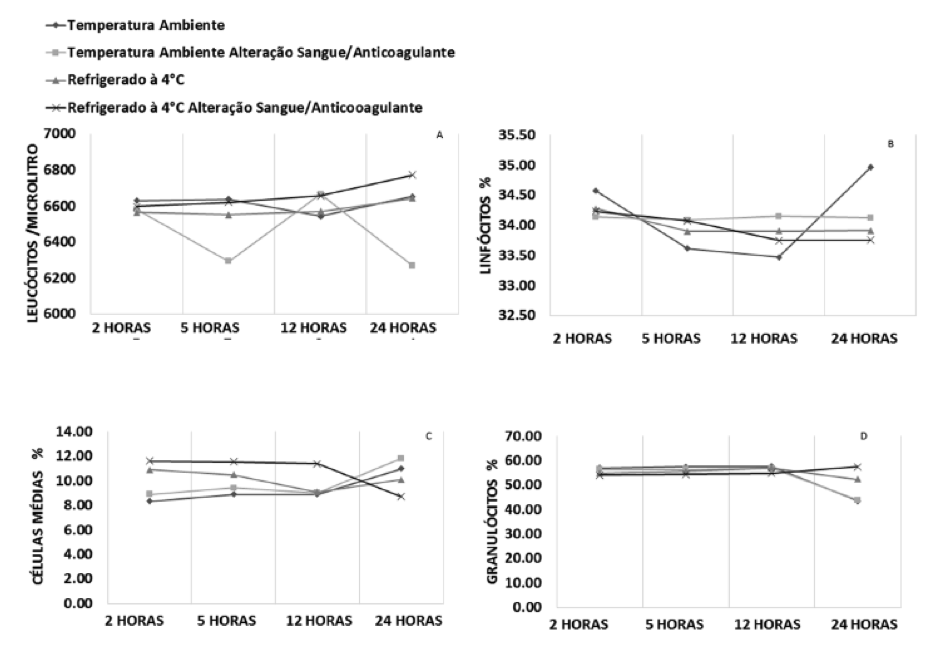
Figura 2. Perfil médio dos parâmetros do leucograma, conforme a relação sangue/anticoagulante, temperatura e tempo de estocagem.
*diferença estatística significativa (p<0,05).
Os resultados do plaquetograma estão representados na Figura 3. A média da contagem de plaquetas apresentou aumento após 24 horas para todas as amostras, com alteração mais evidente de 216.000/mm3 em duas horas para 240.000/mm3 em 24 horas para as amostras armazenadas em temperatura ambiente com correta relação sangue/anticoagulante; porém, os valores médios permaneceram homogêneos para todas as amostras analisadas (Figura 3 – A).
A média dos resultados de VPM para as amostras refrigeradas a 4°C com alteração sangue/anticoagulante apresentou oscilações mais evidentes com diminuição de 0,5fL em cinco horas e aumento progressivo de 0,88 fL em 24 horas de estocagem, enquanto que as demais amostras não apresentaram grandes variações, mantendo seus valores médios homogêneos em 24 horas após a coleta (Figura 3 – B).
A média dos valores de PDW acompanharam o mesmo perfil do VPM para as amostras refrigeradas a 4°C e com alteração sangue/anticoagulante, observando-se queda no tempo de cinco horas de 0,80, em seguida aumento progressivo de 1,52 em 24 horas de estocagem. Entretanto, as demais amostras não apresentaram ampla alteração nos resultados (Figura 3 – C).
Embora tenham se observado variações entre as diferentes formas, temperaturas e tempo de armazenamento de armazenamento, não foram encontradas diferenças significativas para os parâmetros analisados.
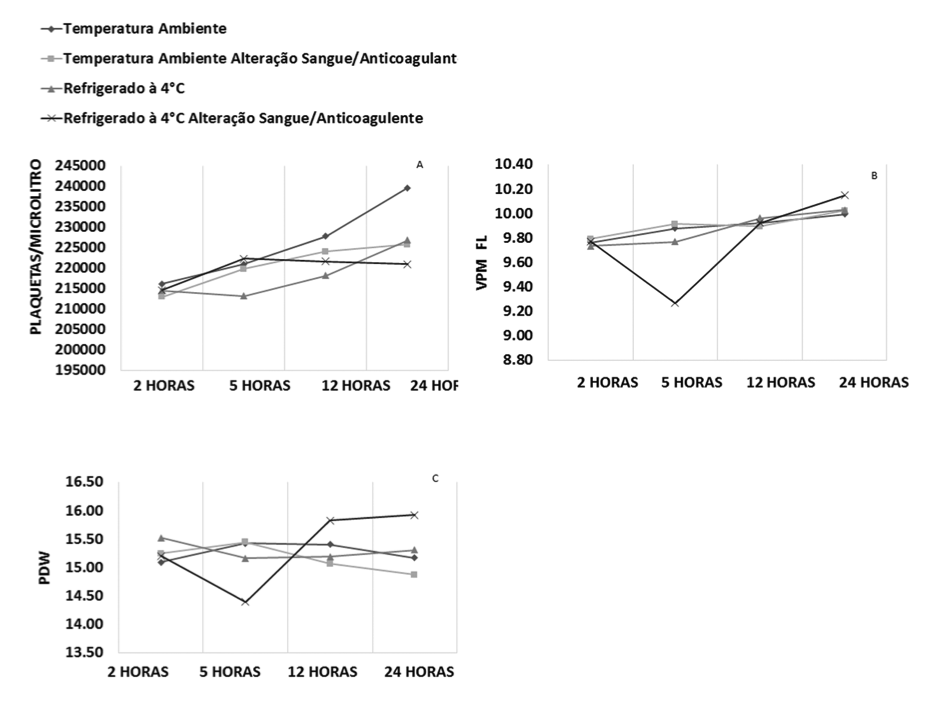
Figura 3. Perfil médio dos parâmetros do plaquetograma, conforme a relação sangue/anticoagulante, temperatura e tempo de estocagem.
DISCUSSÃO
No presente estudo observaram-se oscilações nos valores de média para os parâmetros analisados do eritrograma, leucograma e plaquetograma, principalmente para as amostras armazenadas em temperatura ambiente, assim como para as amostras com alteração da relação sangue/anticoagulante, independente da forma de armazenamento.
Os resultados encontrados concordam com informações prévias, mostrando que as amostras armazenadas a 4°C apresentam menores oscilações em comparação com as armazenadas à temperatura ambiente.(2,6)
Entretanto, na maioria dos parâmetros analisados, as alterações não foram estatisticamente significativas, sugerindo que as pequenas oscilações encontradas podem ter ocorrido devido à variabilidade do equipamento hematológico.(10)
Com relação os parâmetros analisados no eritrograma, a contagem de eritrócitos e a dosagem de hemoglobina mantiveram-se estáveis durante as 24 horas de estocagem, condizendo com um estudo anterior desenvolvido por Dalanhol et al.,(11) que também não encontraram diferença estatística no período de 72 horas após a coleta, enquanto que o hematócrito e o VCM apresentaram aumento nos resultados das amostras armazenadas em temperatura ambiente, independente da alteração sangue/anticoagulante. Esse aumento pode ser explicado devido ao inchaço dos eritrócitos quando as amostras são armazenadas em temperatura ambiente, após um período de 12 horas, levando a um aumento do VCM e, consequentemente, do hematócrito.(6,11) Porém, quando estas amostras são armazenadas sob refrigeração a 4ºC estes parâmetros apresentam uma estabilidade aceitável,(11) estando de acordo com os resultados obtidos pelo presente estudo, que não apresentaram grandes oscilações para as amostras refrigeradas.
Assim como a contagem de eritrócitos e a dosagem de hemoglobina, os valores de HCM apresentaram-se estáveis durante as 24 horas após a coleta. Segundo o estudo desenvolvido por Baca et al.,(5) que analisou o efeito do tempo de estocagem em temperatura ambiente durante quatro dias, o HCM se manteve estável durante toda a duração do estudo, ao contrário do CHCM, que começou a apresentar queda dos resultados depois do primeiro dia após a coleta de sangue venoso. Assim como, no presente estudo, onde os valores de CHCM apresentaram uma queda, entretanto inferior a 1%, nos resultados das amostras armazenadas em temperatura ambiente com e sem alteração da relação sangue/anticoagulante após 24 horas de estocagem, esta queda ocorreu devido ao longo período de estocagem,(11) enquanto que, para a média dos valores de RDW, as amostras armazenadas em temperatura ambiente com e sem alteração da relação sangue/anticoagulante apresentaram um aumento ínfimo durante as 24 horas após a coleta. Entretanto, no estudo realizado por Dalanhol et al.,(11) as amostras armazenadas em temperatura ambiente apresentaram aumento significativo após as 12 horas de estocagem.
No que diz respeito ao efeito do anticoagulante, EDTA K2 é recomendado como o anticoagulante de escolha;(8) porém, quando a relação sangue/anticoagulante não é respeitada, pode produzir alterações, principalmente morfológicas, das células sanguíneas, pois excesso de EDTA induz a modificações da membrana celular.(9)
Ao ser adicionada uma quantidade inferior de amostra que o necessário ocorre um excesso de anticoagulante, que pode causar a desidratação dos eritrócitos, levando a uma diminuição do volume corpuscular e seus parâmetros derivados, além de causar microcitose e diminuição da hemoglobina.(12) Estas alterações não foram observadas no presente estudo, porém, em alguns casos, quando se utilizam diferentes formas de EDTA, existe uma dificuldade em comparar os resultados, principalmente quando não é considerada a correta relação sangue/anticoagulante.(10)
Por exemplo, a utilização do EDTA K3 (ácido etilenodiamino tetra-acético tripotássico) pode diluir as amostras, principalmente as com alteração da relação sangue/anticoagulante com menor volume de sangue; ainda, os eritrócitos podem contrair-se por consequência do efeito osmótico, resultando em diminuição considerável do hematócrito em 2% a 3% nas primeiras quatro horas de estocagem,(10) enquanto que a utilização do EDTA K2 não evidencia implicações com relação à diluição das amostras.(10) Além disso, as amostras, quando coletadas em EDTA, devem apresentar uma oscilação de ± 5% dos resultados com relação aos valores iniciais durante 24 horas de estocagem.(10)
Com relação aos parâmetros analisados no leucograma, os leucócitos totais mantiveram-se estáveis em 24 horas após a coleta de sangue venoso, como demonstrando também por um estudo desenvolvido por Edlund et al.,(13) que avaliou o efeito do tempo de estocagem de oitenta amostras de sangue em temperatura ambiente no tempo zero, 12, 24, 48, 72 e 145 horas após a coleta. No entanto, outros estudos demonstram a estabilidade da contagem total de leucócitos por um período superior de tempo, até 72 horas após a coleta, para ambas as formas de armazenamento: temperatura ambiente e refrigerado a 4°C.(5,6,14,15)
Para contagem diferencial automatizada, o percentual de linfócitos do presente estudo apresentou oscilação mais evidente nas amostras armazenadas em temperatura ambiente, porém, sem diferença significativa entre os resultados. Assim como o percentual de granulócitos, que se manteve estável até 12 horas e apresentou oscilações apenas em 24 horas após a coleta de sangue venoso, demonstrando uma diminuição mais evidente nos resultados das amostras armazenadas em temperatura ambiente; contudo, sem apresentar diferença significativa.
Entretanto, diferenças significativas foram observadas apenas para o percentual das células de tamanho médio (incluindo monócitos, basófilos e eosinófilos), com aumento significativo para amostras em temperatura ambiente e diminuição significativa para as amostras armazenadas refrigeradas a 4°C com alteração da relação sangue/anticoagulante, apresentando estabilidade apenas para as amostras refrigeradas a 4°C sem alteração da relação sangue/anticoagulante de acordo com o tempo de estocagem.
Os resultados encontrados no presente estudo para contagem diferencial automatizada concordam com informações relatadas em outras pesquisas, as quais demonstraram que a contagem diferencial automatizada é estável a 4°C durante pelo menos 24 horas, com diferenças significativas em função do tipo celular como: a contagem de monócitos com tendência a aumentar, a contagem de eosinófilos e linfócitos com tendência a diminuir ao longo do tempo, enquanto que a contagem de neutrófilos é estável até 72 horas após a coleta.(13,14,16)
No entanto, o estudo desenvolvido por Joshi et al.,(6) em 2015, demonstrou que a estabilidade da contagem diferencial automatizada mantém-se até 72 horas para as amostras em temperatura ambiente e refrigeradas a 4°C, onde as contagens de neutrófilos e linfócitos permanecem praticamente inalteradas ao longo do tempo, com a exceção para contagem de monócitos em temperatura ambiente. O mesmo estudo demonstrou que as alterações na contagem de monócitos não foram significativas em 24 horas após a coleta de sangue venoso em temperatura ambiente; porém, além deste tempo de estocagem, os resultados tornaram-se progressivamente menores.(6) Em contraste, os resultados demonstraram estabilidade para contagem de monócitos quando as amostras foram armazenadas a 4°C, em até 72 horas,(6) como observado pelo presente estudo para o percentual de células médias, que incluiu os monócitos em até 24 horas após a coleta.
Em relação ao EDTA, estudos demonstram que as contagens de neutrófilos e monócitos demonstram ser mais sensíveis, enquanto que a contagem de linfócitos apresentam-se mais estáveis,(17) de acordo com o observado no presente estudo. Quando ocorre um excesso de anticoagulante, a contagem de leucócitos pode diminuir quando a amostra é estocada em temperatura ambiente e quando refrigeradas lentamente, como observado nas amostras armazenadas em temperatura ambiente com alteração da relação sangue/anticoagulante desta pesquisa.(12)
Uma possível explicação para as oscilações na contagem diferencial automatizada pode ser que, quando as amostras, coletas com EDTA, permanecem estocadas durante um longo período de tempo, podem exibir alterações morfológicas: os neutrófilos podem apresentar alterações no seu núcleo, corando-se de forma menos homogênea que em amostras frescas, podendo tornar-se picnótico e apresentar figuras de cariorréxis, além de margens celulares irregulares e menos definidas, e vacúolos no citoplasma. O mesmo ocorre para os monócitos e linfócitos, apresentando pequenos vacúolos citoplasmáticos e lobulação irregular do núcleo.(10)
Com relação aos parâmetros analisados para o plaquetograma, a contagem de plaquetas apresentou um pequeno aumento durante as 24 horas de estudo; porém, as médias permaneceram estáveis para todas as amostras analisadas, contradizendo com o estudo realizado por Joshi et al.,(6) que indicou uma diminuição na contagem de plaquetas tanto nas amostras estocadas em temperatura ambiente, quanto nas refrigeradas a 4°C.
Para as amostras estocadas sob refrigeração a 4°C com alteração sangue/anticoagulante, os dados obtidos para VPM e PDW apresentaram uma queda em cinco horas e uma elevação em 12 horas, concordando com informações previas que evidenciam em indivíduos saudáveis uma relação direta entre VPM e PDW.(10) Entretanto, um estudo desenvolvido por Daves et al. (2015)(2) observou, após 24 horas, um aumento significativo para o VPM à temperatura ambiente e refrigerado a 4°C.
Além disso, imediatamente após a exposição ao EDTA ocorre modificação da morfologia plaquetária, da forma elíptica para a forma esférica com pseudópodes.(10) Outra implicação importante da exposição ao EDTA para o parâmetro VPM é a alteração da permeabilidade da membrana citoplasmática, induzindo intumescência progressiva e diminuição da densidade óptica, com consequente aumento do VPM com o tempo de estocagem após coleta, quando determinado por impedância.(10)
CONCLUSÃO
Neste estudo, foi verificado que a maioria dos parâmetros do hemograma são mais estáveis quando refrigerados a 4°C do que em temperatura ambiente. Além disso, a correta relação sangue/ anticoagulante, independente da forma de armazenamento, fornece menos oscilações quantitativas para os parâmetros hematológicos analisados. Entretanto, alguns parâmetros, como: percentual de células médias e granulócitos, VPM e PDW, apresentaram oscilações quando armazenados a 4°C, principalmente para as amostras com alteração da relação sangue/anticoagulante.
Portanto, o presente estudo demonstrou que fatores pré-analíticos, como a temperatura de armazenamento e o tempo de estocagem, podem afetar a variabilidade dos parâmetros quantitativos do hemograma, no dia-a-dia do laboratório clínico, podendo produzir resultados equivocados. Deste modo, deve-se respeitar a correta relação sangue anticoagulante e evitar o processamento do hemograma após longos períodos de estocagem, independente da temperatura. Além disso, devem ser consideradas variações que podem ocorrer com as diferentes marcas de tubos de EDTA e com a metodologia utilizada pelo equipamento hematológico; portanto, cada laboratório deve verificar a estabilidade da amostra biológica de acordo com as características da sua rotina laboratorial.
Agradecimentos:
Os autores são gratos ao Departamento de Análises Clínicas e Toxicológicas – UEPG por permitir a realização deste estudo.
Abstract
Objective: To assess the impact of the pre-analytical phase in the quantitative CBC evaluation, day-to-day clinical laboratory, such as storage temperature and effect of anticoagulant, according to the storage time after collection. Methods: Sixty biological samples of venous blood have been collected and distributed in two EDTA K2 tubes respecting the blood/anticoagulant relation and two tubes with change in this relationship. These samples were stored in different ways: at room temperature (25°C) and at 4°C. Subsequently, samples were analyzed for hematologic counter in different storage times of 2, 5, 12 and 24 hours after collection. Results: It was verified that during the 24 hours of storage most parameters showed no significant alteration, except percentage of medium-sized cells (including monocytes, basophils and eosinophils). Moreover, it was observed that stored refrigerated samples exhibit more stable values, except for some parameters such as the percentage of granulocytes, MPV and PDW, which showed oscillations when stored at 4°C, especially for samples with abnormal blood/anticoagulant relation. Conclusion: This study showed that pre-analytical factors could affect the variability of the quantitative complete blood count parameters. The correct blood/anticoagulant ratio should be respected, and the processing of the sample after long periods of storage.
Keywords
Blood cell; Blood count; Preservation
REFERÊNCIAS
- Buttarello M, Plebani M. Automated blood cell counts: state of the art. Am J Clin Pathol. 2008 Jul;130(1):104-16.
- Daves M, Zagler EM, Cemin R, Gnech F, Joos A, Platzgummer S, et al. Sample stability for complete blood cell count using the Sysmex XN haematological analyser. Blood Transfus. 2015 Oct;13(4):576-82.
- Buttarello M. Quality specification in haematology: the automated blood cell count. Clin Chim Acta. 2004 Aug 2;346(1):45-54.
- Ricós C, Alvarez V, Cava F, García-Lario JV, Hernández A, Jiménez CV, et al. Integration of data derived from biological variation into the quality management system. Clin Chim Acta. 2004 Aug 2;346(1):13-8.
- de Baca ME, Gulati G, Kocher W, Schwarting R. Effects of Storage of Blood at Room Temperature on Hematologic Parameters Measured on Sysmex XE-2100. Lab Med 2006;37(1):28-35.
- Joshi A, McVicker W, Segalla R, Favaloro E, Luu V, Vanniasinkam T. Determining the stability of complete blood count parameters in stored blood samples using the SYSMEX XE-5000 automated haematology analyser. Int J Lab Hematol. 2015 Oct;37(5):705-14.
- Recommendations of the International Council for Standardization in Haematology for Ethylenediaminetetraacetic Acid Anticoagulation of Blood for Blood Cell Counting and Sizing. International Council for Standardization in Haematology: Expert Panel on Cytometry. Am J Clin Pathol. 1993 Oct;100(4):371-2.
- Clinical and Laboratory Standards Institute. Procedures for the colletion of diagnostic blood specimens by venipuncture. In: CLSI, ed. 6th ed. ed. Wayne 2007.
- Lewis SM, Stoddart CT. Effects of anticoagulants and containers (glass and plastic) on the blood count. Lab Pract. 1971 Oct;20 (10):787-92.
- Silva PH AH, Comar SR, Henneberg R, Merlin JC, Stinghen ST. Hematologia Laboratorial. Teoria e Procedimentos. Porto Alegre: Artmed 2016.
- Dalanhol M BM, Mazuchelli J, Silva PH, Hashimoto Y, Largura A. Efeitos quantitativos da estocagem de sangue periférico nas determinações do hemograma automatizado. Rev. Bras. Hematol. Hemoter. 2010;32(1):16-22.
- Silva PH HY, Alves HB. Hematologia Laboratorial. Rio de Janeiro: Revinter. 2009.
- Edlund B, Jones I, Eriksson M, Fredlund I, Magnuson A. Effect of sample aging on patient samples kept at ambient temperature before analysis with the Abbott Cell-Dyn 4000 hematology analyzer. Lab Hematol. 2004;10(1):38-41.
- Hedberg P, Lehto T. Aging stability of complete blood count and white blood cell differential parameters analyzed by Abbott CELL-DYN Sapphire hematology analyzer. Int J Lab Hematol. 2009 Feb;31(1):87-96. Erratum in Int J Lab Hematol. 2009 Feb;31(1):118.
- Gulati GL, Hyland LJ, Kocher W, Schwarting R. Changes in automated complete blood cell count and differential leukocyte count results induced by storage of blood at room temperature. Arch Pathol Lab Med. 2002 Mar;126(3):336-42.
- Zini G1; International Council for Standardization in Haematology (ICSH). Stability of complete blood count parameters with storage: toward defined specifications for different diagnostic applications. Int J Lab Hematol. 2014 Apr;36(2):111-3.
- Reardon DM, Warner B, Trowbridge EA. EDTA, the traditional anticoagulant of haematology: with increased automation is it time for a review? Med Lab Sci. 1991 Jan;48(1):72-5.
Correspondência
Danielle Cristyane Kalva Borato
Universidade Estadual de Ponta Grossa
Departamento de Análises Clínicas e Toxicológicas
Avenida General Carlos Cavalcanti, 4748 – Uvaranas
84030-900 – Ponta Grossa, PR
Telefone: 3220-3118
e-mail: [email protected]
