Acurácia diagnóstica dos métodos sorológicos de detecção da COVID-19
Diagnostic accuracy of serological methods for detecting COVID-19
Flávia Martinello1
1Docente do Departamento de Análises Clínicas, Universidade Federal de Santa Catarina, SC, Brasil.
Recebido em 10/03/2021
Aprovado em 29/04/2021
DOI: 10.21877/2448-3877.202100966
INTRODUÇÃO
Com a identificação da síndrome respiratória aguda grave (SARS) causada pelo Coronavírus-2 (SARS-CoV-2) em dezembro de 2019 e a rápida caracterização do genoma completo do vírus, a indústria de produtos para diagnóstico in vitro se mobilizou rapidamente para a produção em larga escala de métodos diagnósticos.(1) Inicialmente, além dos métodos moleculares para identificação do vírus, foram produzidos exames chamados sorológicos para a identificação de anticorpos das classes IgA, IgM, IgG e totais. Posteriormente, surgiram os imunoensaios para detecção de antígeno (Ag) viral. Estes imunoensaios, principalmente os imunocromatográficos, possibilitaram a testagem em massa na população.(1) No entanto, foram os métodos moleculares desenvolvidos in house que garantiram o diagnóstico preciso em larga escala. Não há registro precedente de aplicação do conhecimento científico tão rápido e eficiente para produção de métodos diagnósticos (kits) de forma simultânea ao descobrimento e expansão da doença no planeta.(1)
Desde o início da emergência de saúde pública, a Organização Mundial de Saúde (OMS) enfatizou testar quantos indivíduos fosse possível e rastrear pessoas infectadas e seus contatos como estratégia eficaz para reduzir a propagação do vírus.(2-4) Assim, agências regulatórias como a OMS, o FDA (do inglês, Food and Drug Administration) americano e mesmo a ANVISA (Agência Nacional de Vigilância Sanitária) no Brasil, aprovaram condicionalmente o uso emergencial de vários novos métodos.(2,3) Dessa forma, vários tipos de exames disponíveis foram utilizados ainda que sem o devido conhecimento da qualidade dos mesmos.
Acurácia diagnóstica dos métodos laboratoriais diagnósticos da COVID-19
Os ensaios diagnósticos diretos identificam a infecção diretamente ao detectar o RNA ou um antígeno viral, enquanto os indiretos detectam os anticorpos contra o vírus em um indivíduo que foi exposto.(5) A Figura 1 ilustra os principais métodos laboratoriais para diagnóstico da doença causada pelo SARS-CoV-2, denominada COVID-19, do inglês coronavirus disease.
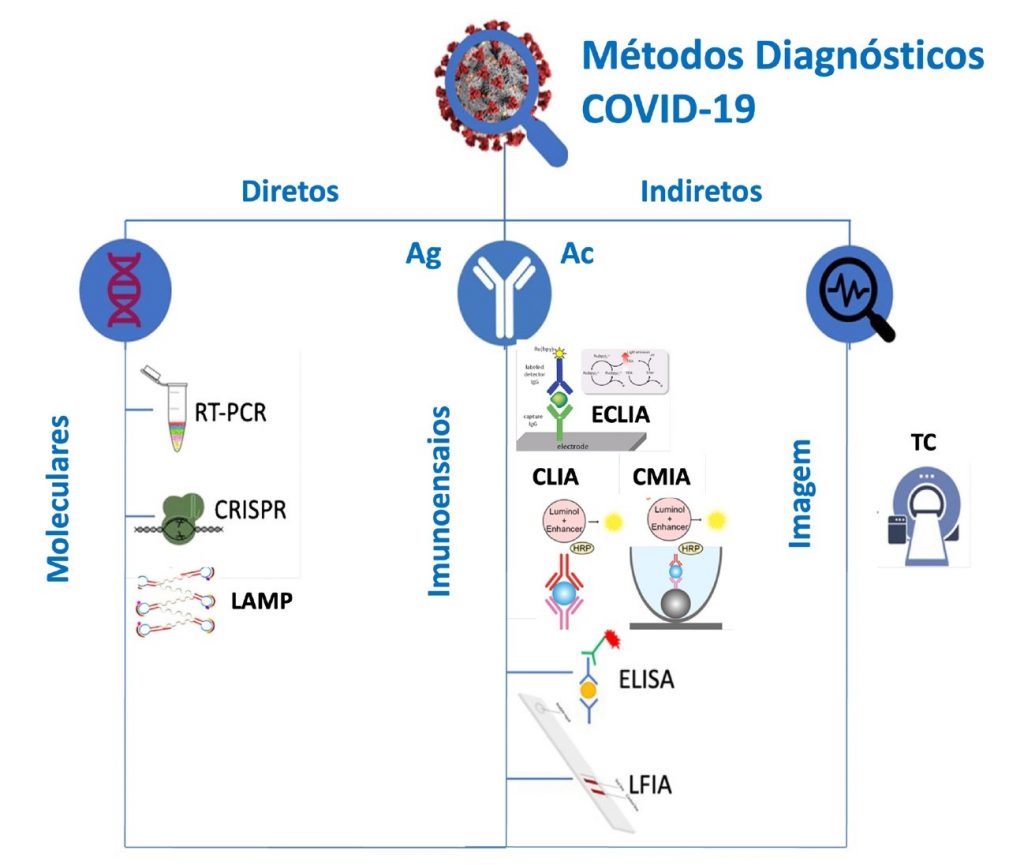
Figura 1. Principais métodos para diagnóstico da COVID-19.
Legenda:RT-PCR, transcrição reversa seguida da reação em cadeia da polimerase em tempo real; CRISPR, repetições palindrômicas curtas agrupadas e regularmente espaçadas; LAMP, amplificação isotérmica mediada por alça; ELISA, imunoensaio enzimático; LFIA, imunoensaio de fluxo lateral, CLIA, imunoensaio de quimiluminescência; CMIA, imunoensaio de micropartículas de quimiluminescência; ECLIA, imunoensaio de eletroquimiluminescência; Ag, antígeno; Ac, anticorpo; TC, tomografia computadorizada.
Fonte:Adaptado de GIRI et al, 2021.(6)
Esses métodos de diagnóstico têm rendimento, eficiência, requisitos de configuração e de infraestrutura, desempenho analítico e tempos de liberação de resultado variáveis. Além de depender do equipamento e do método em si, o resultado laboratorial também depende do protocolo de coleta de amostra, da qualidade dos reagentes usados, do potencial de contaminação cruzada e da forma de armazenamento das amostras e reagentes.(5) Esses fatores devem ser considerados ao selecionar um método de diagnóstico rápido e confiável para ajudar a tomar uma decisão apropriada e ações de saúde pública imediatas.(6)
Poucos estudos têm apresentado dados de desempenho analítico de testes moleculares ou imunoensaios quantitativos como precisão intra e interensaio, exatidão, limite de detecção, avaliação de interferentes, linearidade, sensibilidade analítica, etc.(1,4) Assim, não está claro para os laboratórios quais ensaios apresentam melhor desempenho e se os resultados desses diferentes ensaios são comparáveis.(7)
Com a utilização em larga escala dos métodos sorológicos qualitativos, na rotina laboratorial, as validações dos mesmos têm se limitado à análise da sensibilidade e especificidade clínicas.
A sensibilidade analítica compreende a concentração do analito que causa uma variação no valor do sinal analítico medido. Quanto mais sensível um método, menor é a concentração do analito capaz de gerar um sinal no sistema de detecção do método.(8) Contudo, o termo sensibilidade analítica tem sido utilizado, de forma equivocada, como sinônimo de limite de detecção (LD), que é o menor valor detectável do teste, significantemente diferente de zero, e depende da amplitude da leitura do branco e da precisão desta medida.(1,4,9) A especificidade analítica, por sua vez, é a capacidade de um método analítico de medir apenas o analito procurado.(8)
Por outro lado, a sensibilidade clínica ou sensibilidade diagnóstica define quão frequentemente um resultado é positivo quando uma doença em particular está presente. Normalmente é expressa como percentual de indivíduos com uma doença que tem o resultado positivo. A especificidade clínica, por sua vez, é quão frequentemente um resultado é negativo na ausência de uma doença em particular. Normalmente é expressa como percentual de indivíduos sem uma doença que tem o resultado positivo.(8)
Os exames laboratoriais desempenham papel fundamental no diagnóstico e tratamento da COVID-19. Um método diagnóstico deve ter sensibilidade e especificidade suficientes para tomar decisões clínicas apropriadas rapidamente.(1,5) Nesse contexto, o objetivo desta revisão narrativa foi destacar a acurácia diagnóstica dos métodos sorológicos de diagnóstico da COVID-19 em termos de sensibilidade e especificidade clínicas, e sob essa perspectiva discutir a influência das limitações dos métodos no controle da pandemia.
Resultados e Discussão
Há vários estudos apresentando a acurácia clínica de ensaios sorológicos, possivelmente por ser o tipo de ensaio mais produzido. Entre as dezenas de marcas de reagentes disponíveis no mercado, buscamos apresentar o desempenho daquelas conhecidas internacionalmente e utilizadas no Brasil, e também dos kits produzidos no Brasil, ainda que haja poucos estudos sobre estes últimos.
A Tabela 1 sumariza os achados e apresenta os dados de 14 marcas de reagentes. Destas, algumas analisam anticorpos totais (2), IgA (1), IgM (7), IgG (12), IgM+IgG (6), e IgA+IgM (1). Cinco métodos são utilizados pelas diferentes marcas, LFIA – imunoensaio de fluxo lateral ou imunocromatográfico (5), ELISA – imunoensaio enzimático (4), CLIA – imunoensaio de quimiluminescência (3), CMIA – imunoensaio de micropartículas de quimiluminescência (1), e ECLIA imunoensaio de eletroquimiluminescência (1). Para um mesmo ensaio foram encontrados de um a quatro estudos. Os sete estudos foram realizados em seis países, sendo dois no Brasil. Assim, como observado por Mark etal.,(9) foi possível verificar que a acurácia diagnóstica varia entre estudos e entre as marcas de reagentes. A especificidade diagnóstica apresentou menor variação entre os estudos, no entanto, uma mesma marca chegou a apresentar 32% de diferença de especificidade. A sensibilidade diagnóstica dos ensaios foi analisada, em amostras coletadas, em média, 14 dias após o início dos sintomas, que representa um período com maior sensibilidade. A sensibilidade dos reagentes variou até 50% entre estudos. Contudo, cabe destacar que algumas marcas dispõem de apenas um estudo de avaliação da acurácia diagnóstica (Tabela 1).
Tabela 1 – Sensibilidade e especificidade diagnósticas segundo o ensaio, o fabricante, o método, o número de amostras testadas na pesquisa, o período da coleta de amostra, o país e a referência do estudo.
| Teste | Fabricante | Método | Sensibilidade clínica (%) | Especificidade clínica (%) | N° de amostras testadas | N° de dias após o início dos sintomas | (Referência) País do estudo |
| IgG | Abbott (Architect) – EUA | CMIA | 79,2 | 99,3 | 433 | >14 | (25) EUA |
| IgG | Abbott (Architect) – EUA | CMIA | 95,2 | – | 21 | 16-20 | (26) França |
| IgG | Abbott (Architect) – EUA | CMIA | 84,7 | 99,5 | 2970 | >14 | (27) Israel |
| IgG | Abbott (Architect) – EUA | CMIA | 96 | 100 | 76 | >10 | (22) Croácia |
| IgG | Beckman (Accsess) – EUA | CLIA | 58,3 | 99,8 | 424 | >14 | (25) EUA |
| IgG | Beckman (Accsess) – EUA | CLIA | 81,5 | 100 | 480 | >14 | (27) Israel |
| IgG | Diasorin (Liaison S1/S2) – EUA | CLIA | 54,2 | 98,4 | 433 | >14 | (25) EUA |
| IgG | Diasorin (Liaison S1/S2) – EUA | CLIA | 71,4 | – | 21 | 16-20 | (26) França |
| IgG | Diasorin (Liaison S1/S2) – EUA | CLIA | 82,4 | 98,7 | 2941 | >14 | (27) Israel |
| IgG | Euroimmun – Alemanha | ELISA | 50,0 | 97,5 | 433 | >14 | (25) EUA |
| IgG | Euroimmun – Alemanha | ELISA | 87,2 | 95,8 | 47 | >14 | (14) Brasil |
| IgG | Euroimmun – Alemanha | ELISA | 100 | 93 | 76 | >10 | (22) Croácia |
| IgG | Euroimmun – Alemanha | ELISA | 88,2 | 100 | 28 | >10 | (16) Brasil |
| IgG | Vircell Microbiologists – Espanha | ELISA | 93,2 | 53,4 | 74 | >14 | (14) Brasil |
| IgG | Vircell Microbiologists – Espanha | ELISA | 96 | 85 | 72 | >10 | (22) Croácia |
| IgG | Snibe (MAGLUMI™ 2000 Plus) – China | CLIA | 88,0 | – | 25 | >13 | (4) Itália |
| IgG | Snibe (MAGLUMI™ 2000 Plus) – China | CLIA | 93 | 100 | 76 | >10 | (22) Croácia |
| IgG | Snibe (MAGLUMI™ 2000 Plus) – China | CLIA | 87,5 | 96,0 | 90 | >15 | (16) Brasil |
| IgG | Biotech (One Step) – China | LFIA | 68,9 | – | 74 | >14 | (14) Brasil |
| IgG | Biomanguinhos – Brasil | LFIA | 78,4 | – | 74 | >14 | (14) Brasil |
| IgG | ECO teste – Brasil | LFIA | 87,8 | – | 74 | >14 | (14) Brasil |
| IgG | Gold Analisa – Brasil | LFIA | 74,3 | – | 74 | >14 | (14) Brasil |
| IgG | MbiologDiagnósticos (Allserum) – Brasil | ELISA | 78,9 | 98,1 | 71 | >14 | (14) Brasil |
| IgG | Wama (Imunorápido) – Brasil | LFIA | 83,8 | – | 74 | >14 | (14) Brasil |
| IgG | Wama (Imunorápido) – Brasil | LFIA | 72,2 | 100 | 28 | >15 | (16) Brasil |
| IgM | Snibe (MAGLUMI™ 2000 Plus) – China | CLIA | 56 | 100 | 76 | >10 | (22) Croácia |
| IgM | Snibe (MAGLUMI™ 2000 Plus) – China | CLIA | 88,0 | – | 25 | >13 | (4) Itália |
| IgM | Biotech (One Step) – China | LFIA | 28,4 | – | 74 | >14 | (14) Brasil |
| IgM | Biomanguinhos – Brasil | LFIA | 62,2 | – | 74 | >14 | (14) Brasil |
| IgM | ECO teste – Brasil | LFIA | 82,4 | – | 74 | >14 | (14) Brasil |
| IgM | Gold Analisa – Brasil | LFIA | 12,2 | – | 74 | >14 | (14) Brasil |
| IgM | MbiologDiagnósticos (Allserum) – Brasil | ELISA | 50,7 | 70,4 | 71 | >14 | (14) Brasil |
| IgM | Wama (Imunorápido) – Brasil | LFIA | 44,6 | – | 74 | >14 | (14) Brasil |
| IgM | Wama (Imunorápido) – Brasil | LFIA | 55,6 | 100 | 28 | 15 a 21 dias | (16) Brasil |
| Ig Total | Bio-Rad (Platelia) – EUA | ELISA | 83,3 | 99,3 | 433 | >14 | (25) EUA |
| Ig Total | Bio-Rad (Platelia) – EUA | ELISA | 90,5 | 76 | 16-20 | (26) França | |
| Ig Total | Roche (Elecsys) – EUA | ECLIA | 79,2 | 99,8 | 433 | >14 | (25) EUA |
| Ig Total | Roche (Elecsys) – EUA | ECLIA | 85,7 | – | 21 | 16-20 | (26) França |
| Ig Total | Roche (Elecsys) – EUA | ECLIA | 89,0 | 100 | 2005 | >14 | (27) Israel |
| Ig Total | Roche (Elecsys) – EUA | ECLIA | 96 | 100 | 76 | >10 | (22) Croácia |
| IgM+IgG | Biotech (One Step) – China | LFIA | 83,7 | 100 | 74 | (14) Brasil | |
| IgM+IgG | Biotech (One Step) – China | LFIA | 68,9 | 100 | 74 | >14 | (14) Brasil |
| IgM+IgG | Biomanguinhos – Brasil | LFIA | 82,4 | 81,0 | 74 | >14 | (14) Brasil |
| IgM+IgG | ECO teste – Brasil | LFIA | 89,2 | 99,1 | 74 | >14 | (14) Brasil |
| IgM+IgG | Gold Analisa – Brasil | LFIA | 74,3 | 98,3 | 74 | >14 | (14) Brasil |
| IgM+IgG | Wama (Imunorápido) – Brasil | LFIA | 86,5 | 97,4 | 74 | >14 | (14) Brasil |
| IgA+IgM | Vircell Microbiologists – Espanha | ELISA | 95,9 | 23,3 | 74 | >14 | (14) Brasil |
| IgA+IgM | Vircell Microbiologists – Espanha | ELISA | 100 | 70 | 73 | >10 | (22) Croácia |
| IgA | Euroimmun – Alemanha | ELISA | 70,8 | 79,9 | 433 | >14 | (25) EUA |
| IgA | Euroimmun – Alemanha | ELISA | 89,4 | 82,2 | 47 | >14 | (14) Brasil |
| IgA | Euroimmun – Alemanha | ELISA | 96,0 | 90 | 76 | >10 | (22) Croácia |
| IgA | Euroimmun – Alemanha | ELISA | 88,0 | 90,0 | 106 | >15 | (16) Brasil |
LFIA: imunoensaio de fluxo lateral (imunocromatográfico), CLIA: imunoensaio de quimiluminescência, CMIA: imunoensaio de micropartículas de quimiluminescência, ECLIA: imunoensaio de eletroquimiluminescência, -: Não informado.
Considerando-se o critério de especificidade >95% definido pelo FDA para autorização de uso emergencial,(10) entre os ensaios em que foi descrita a especificidade, apenas uma marca (Vircell) de ensaio para detecção IgG não atingiu essa meta em dois estudos. Para a detecção de IgM, apenas uma marca com um único estudo não atingiu a meta (Mbiolog Diagnósticos). Para a detecção de IgA, a única marca apresentada (Euroimmun) não atingiu a especificidade clínica mínima proposta pelo FDA em quatro estudos diferentes. Para a detecção de IgA+IgM, a única marca apresentada (Vircell) não atingiu a especificidade clínica mínima proposta pelo FDA em dois estudos diferentes. Entre as cinco marcas que produzem kits para detecção de IgM+IgG, apenas uma marca (Biomanguinhos) não atingiu a especificidade clínica. Para Ig totais, as duas marcas apresentaram especificidade aceitável em diferentes estudos (Tabela 1).
Considerando o critério de sensibilidade clínica >90%, a maioria dos ensaios não atingiu a meta especificada pelo FDA para autorização de uso emergencial.(10) Apenas 6 (24%) dos 25 estudos com as 12 diferentes marcas de ensaios para detecção de IgG apresentam o desempenho especificado, destas nenhuma é brasileira. Nenhum dos nove estudos com sete diferentes marcas de ensaios para detecção de IgM apresentaram o desempenho especificado, incluindo as cinco marcas brasileiras. Da mesma forma, nenhum dos seis estudos com cinco diferentes marcas de ensaios para detecção de IgM+IgG apresentam o desempenho especificado, incluindo as cinco marcas brasileiras. Da única marca apresentada com ensaio para detecção de IgA (Euroimmun), apenas um dos quatro estudos indicou sensibilidade >90%. Por outro lado, a única marca apresentada (Vircell) para detecção de IgA+IgM atinge a meta especificada pelo FDA nos dois estudos (Tabela 1).
Contudo, diversas revisões sistemáticas e meta-análises da acurácia diagnóstica dos ensaios sorológicos para COVID-19 destacam alto risco de falhas nos estudos em relação à seleção de pacientes/amostras, interpretação dos resultados dos ensaios e da performance dos mesmos.(11,12) Além disso, vários estudos consideram amostras positivas baseando-se em apenas um resultado de RT-PCR (transcrição reversa seguida da reação em cadeia da polimerase em tempo real), ignorando o potencial de resultados falsos negativos também deste método.(11) Estas revisões têm demonstrado uma especificidade total de 96,6% a 98% para os imunoensaios e sensibilidade variável de acordo com o método, tipo de anticorpo pesquisado, tempo de coleta após início dos sintomas,(1,11,12) tipo de amostra, e do limite de detecção dos métodos.(1) De forma semelhante ao que observamos, alguns estudos também concluíram que, em geral, os ensaios imunocromatográficos (LFIA) apresentaram menor sensibilidade.(11,12)
Castro et al. analisaram a acurácia diagnóstica informada pelos fabricantes dos ensaios comerciais registrados no Brasil em 2020.(13) Os autores observaram que, segundo os dados dos fabricantes, a sensibilidade dos ensaios para detecção de anticorpos anti-SARS-CoV-2 da classe IgM varia de 55% a 90%, portanto, tendo sido autorizada a comercialização de reagentes que podem apresentar taxa de resultados falsos negativos de 44%.(13) Este dado foi confirmado no estudo de Cota et al., que encontraram sensibilidade de 52% para o mesmo ensaio (Biomanguinhos). Outros dois ensaios (Biotech-OneStep e ECO teste) apresentaram desempenho no estudo de Cota et al. inferior ao especificado pelos fabricantes.(14)
No Brasil, o Instituto Nacional de Controle da Qualidade em Saúde (INCQS) também tem feito um monitoramento pós-mercado da qualidade de dispositivos para diagnóstico in vitro da COVID-19. O instituto tem verificado que aproximadamente 39% dos reagentes, incluindo todos os tipos de testes, têm se mostrado em não conformidade em relação às informações declaradas pelos fabricantes na instrução de uso, normalmente com sensibilidade e/ou especificidades divergentes.(15)
A Sociedade Brasileira de Análises Clínicas assim como outras sociedades científicas também se uniu para avaliar kits de diagnóstico para SARS-CoV-2 disponíveis no mercado brasileiro. Ainda, no momento dessa pesquisa, os resultados dos kits da Roche (Elecsys), da Biotech e da Eco estavam, a pedido das empresas, em revisão pelo comitê gestor da parceria.(16)
Os resultados apresentados nesta revisão, assim como os resultados de Controle Externo da Qualidade disponíveis,(17) podem contribuir na escolha do método e marca a serem adquiridos por um laboratório. A falta de consenso ou a baixa reprodutibilidade dentro de uma mesma marca de reagente também pode estar relacionada à realização das análises de forma diferente do preconizado pelo fabricante. A observação de tamanha variação de resultados entre estudos reforça a necessidade de validação ou verificação dos métodos antes da sua implantação na rotina laboratorial.
Padoan et al. relataram que a validação dos métodos representa um pré-requisito dos ensaios laboratoriais no diagnóstico e monitoramento dos pacientes com COVID-19. Os autores relataram que poucos ensaios têm sido completamente validados pelos laboratórios, porque esse processo demanda tempo.(4) Com grande dificuldade, devido à ausência de amostras controle no início da pandemia, os laboratórios necessitaram realizar validações, na mesma velocidade da expansão da COVID-19, para atender com segurança à crescente demanda pelos testes diagnósticos. Nesse contexto, certamente foram realizados exames laboratoriais sem a devida validação, e, consequentemente, a menor qualidade dos resultados pode ter contribuído para o diagnóstico incorreto ou não isolamento de pacientes com suspeita de COVID-19 e disseminação do vírus na sociedade.
A OMS não recomenda o uso de testes laboratoriais remotos baseados em anticorpos na tomada de decisão clínica.(6,18) Contudo, dois estudos mostraram menor sensibilidade clínica da RT-PCR, em relação à tomografia computadorizada e aos ensaios sorológicos, para detectar a COVID-19 em pacientes altamente suspeitos.(19,20)
Em estudos clínicos, outros fatores ainda podem afetar os resultados. Foram relatadas possíveis interferências nos imunoensaios por Candida albicans, Bordetella pertusis, Chlamydia pneumoniae, Haemophilus influenzae, Legionella pneumophila, Streptococcus pneumoniae, Streptococcus pyogenes, Mycobacterium tuberculosis, Staphylococcus aureus, Staphylococcus epidermidis, Mycoplasma pneumoniae, Rhinovirus, Adenovirus, Enterovírus, Vírus Parainfluenza e Influenza.(21) Reações cruzadas com imunoensaios para detecção de anticorpos contra SARS-CoV-2 foram observadas em amostras expressando IgG para vírus Epstein-Barr, IgG para Citomegalovírus, IgG para Varicella zoster, e anticorpos anti-HBS.(22) Reações cruzadas também podem ser causadas por algumas substâncias presentes no nariz dos pacientes como os descongestionantes fenilefrina, oximetazolina e gel nasal de cloreto de sódio, antifúngico fluconazol, pastilhas para dor de garganta contendo benzocaína e mentol, antiviral oseltamivir (Tamiflu), antibióticos em pomada nasal como mupirocina e tobramicina, e o anti-inflamatório propionato de fluticasona.(21)
Nesse contexto, percebe-se que ainda há um longo caminho para os fabricantes de ensaios sorológicos buscarem conjuntos diagnósticos mais sensíveis e específicos para o SARS-CoV-2. Assim como foi observado no diagnóstico sorológico do vírus da imunodeficiência humana (HIV), várias gerações de ensaios foram produzidas até que chegássemos ao desempenho atual dos reagentes que se tornaram muito mais sensíveis e específicos, e ainda assim o diagnóstico é realizado por pelo menos dois testes. Uma nova geração de testes sorológicos para o SARS-CoV-2, que utilizam uma glicoproteína Spike trimérica recombinante como antígeno de captura, já está disponível.(23) No entanto, ainda não há estudos científicos comparando as acurácias clínicas em uma mesma população.
A garantia de qualidade e o suporte regulatório em torno dos testes continuam sendo um desafio. Há vários exemplos de kits de diagnóstico de COVID-19 sendo retirados do mercado em vários países devido à falta de qualidade. A falta de um padrão de referência estabelecido, o uso de diferentes amostras, o preparo de amostras e a compreensão incompleta da dinâmica viral ao longo do tempo da infecção dificultam a avaliação rigorosa da precisão do diagnóstico dos muitos ensaios introduzidos para COVID-19,(6) que são considerados ainda recentes.
Uma ampla variedade de exames laboratoriais para diagnóstico da COVID-19 de diferentes fabricantes está entrando no mercado a cada semana, e, na pressa para colocá-los em operação, as informações sobre esses parâmetros críticos de desempenho analítico e diagnóstico e as informações exclusivas do fabricante, muitas vezes, ainda não estão divulgadas.(6)
Por enquanto, a OMS recomenda os exames de detecção de Ag por imunoensaios para monitorar a incidência da COVID-19, particularmente, em regiões remotas ou grupos fechados, como escolas, presídios e casas de permanência de longa duração.(24) Novas tecnologias, como métodos baseados em CRISPR (repetições palindrômicas curtas agrupadas e regularmente espaçadas) e LAMP (amplificação isotérmica mediada por alça) aplicados em testes laboratoriais remotos, devem fornecer sistemas de ensaio rápidos, simples, de baixo custo, portáteis e estáveis à temperatura configurados para locais com recursos limitados.(6) Considerando-se a possibilidade de que a COVID-19 permanecerá na população como os vírus da gripe, um método de teste multiplex para múltiplas doenças deve ser considerado como uma plataforma de teste de rotina no futuro.(6)
Considerações Finais
Os resultados demonstram o pobre valor diagnóstico dos imunoensaios, mas com potencial para estudos soroepidemiológicos. Sugere-se que são essenciais mais estudos de validação analítica e acurácia diagnóstica de ensaios, principalmente dos reagentes nacionais.
Abstract
The rapid characterization of the coronavirus-2 (SARS-CoV-2) genome has mobilized the large-scale production of diagnostic methods. Regulatory agencies have conditionally approved the emergency use of several of them. In the health emergency, numerous tests were used without proper knowledge of quality. The aim of this narrative review was to highlight the diagnostic accuracy of serological methods for the diagnosis of COVID-19 in terms of clinical sensitivity and specificity. The diagnostic sensitivity varied up to 50% between studies, while the specificity showed less variation, however, the same brand even showed a variation of 32%. Considering the >95% specificity criteria defined by the FDA, only one test brand for detection of IgG and one for IgM reached the goal. For the detection of IgA and IgA+IgM, the only brands presented did not reach the goal. Among the 5 marks for detecting IgM+IgG, only one did not reach clinical specificity. For total Ig, both brands had acceptable specificity. Considering the criterion of clinical sensitivity >90%, only 6 of the 25 studies with different brands of assays for detection of IgG present the specified performance, none of which are Brazilian. None of the brands of assays for detecting IgM and IgM+IgG showed the specified performance. The only brand presented for detection of IgA+IgM reached the target specified by the FDA. Immunochromatographic assays showed lower sensitivity. The results demonstrated the poor diagnostic value of immunoassays, but with potential for seroepidemiological studies. More studies on analytical validation and diagnostic accuracy of assays are essential, especially for national reagents.
Keywords
Diagnostic accuracy; COVID-19; IgG; IgM; serological tests; SARS-CoV-2
Referências
- Uhteg K, Jarrett J, Richards M, Howard C, Morehead E, Geahr M, et al. Comparing the analytical performance of three SARS-CoV-2 molecular diagnostic assays. J Clin Virol. 2020 Jun;127:104384. doi: 10.1016/j.jcv.2020.104384.
- FDA. U.S. Food & Drug Administration. Coronavirus Disease 2019 (COVID-19) Emergency Use Authorizations for Medical Devices. Disponível em: https://www.fda.gov/medical-devices/emergency-use-authorizations-medical-devices/coronavirus-disease-2019-covid-19-emergency-use-authorizations-medical-devices. Acesso em 04 de ago de 2021.
- Agência Nacional de Vigilância Sanitária (ANVISA). Produtos para diagnóstico in vitro da COVID-19. Disponível em: https://www.gov.br/anvisa/pt-br/assuntos/produtosparasaude/coronavirus. Acesso em 04 de ago de 2021.
- Padoan A, Cosma C, Sciacovelli L, Faggian D, Plebani M. Analytical performances of a chemiluminescence immunoassay for SARS-CoV-2 IgM/IgG and antibody kinetics. Clin Chem Lab Med. 2020 Jun 25;58(7):1081-1088. doi: 10.1515/cclm-2020-0443.
- Cheng MP, Papenburg J, Desjardins M, Kanjilal S, Quach C, Libman M, et al. Diagnostic testing for severe acute respiratory syndrome–related coronavirus-2: a narrative review. Ann Intern Med. 2020 Jun 2;172(11):726-734. doi: 10.7326/M20-1301.
- Giri B, Pandey S, Shrestha R, Pokharel K, Ligler FS, Neupane BB. Review of analytical performance of COVID-19 detection methods. Anal Bioanal Chem. 2021 Jan;413(1):35-48. doi: 10.1007/s00216-020-02889-x.
- Vogels CBF, Brito AF, Wyllie AL, Fauver JR, Ott IM, Kalinich CC, et al. Analytical sensitivity and efficiency comparisons of SARS-CoV-2 RT-qPCR primer-probe sets. Nat Microbiol. 2020 Oct;5(10):1299-1305. doi: 10.1038/s41564-020-0761-6.
- Westgard, JO. Glossary of QC terms.Definitions of the key terms in quality control and assurance are obtained from documents of professional societies and organizations such ASQ, IFCC, CLSI, ISO, CAP. Disponível em: https://www.westgard.com/glossary.htm. Acesso em 01 ago de 2021.
- Mak GC, Lau SS, Wong KK, Chow NL, Lau CS, Lam ET, et al. Analytical sensitivity and clinical sensitivity of the three rapid antigen detection kits for detection of SARS-CoV-2 virus. J Clin Virol. 2020 Dec;133:104684. doi: 10.1016/j.jcv.2020.104684.
- FDA. U.S. Food & Drug Administration. In Vitro DiagnosticEUAs. Disponível em: https://www.fda.gov/medical-devices/coronavirusdisease-2019-covid-19-emergency-use-authorizations-medical-devices/vitro-diagnostics-euas. Acesso em 21 fev 2021.
- Deeks JJ, Dinnes J, Takwoingi Y, Davenport C, Spijker R, Taylor-Phillips S, et al. Antibody tests for identification of current and past infection with SARS-CoV-2. Cochrane Database Syst Rev 2020 Jun 25;6(6):CD013652. doi: 10.1002/14651858.CD013652.
- Bastos ML, Tavaziva G, Abidi SK, Campbell JR, Haraoui LP, Johnston JC, et al. Diagnostic accuracy of serological tests for covid-19: systematic review and meta-analysis. BMJ 2020;370:m2516.doi: 10.1136/bmj.m2516.
- Castro R, Luz PM, Wakimoto MD, Veloso VG, Grinsztejn B, Perazzo H. COVID-19: a meta-analysis of diagnostic test accuracy of commercial assays registered in Brazil. Braz J Infect Dis. 2020 Mar-Apr;24(2):180-187. doi: 10.1016/j.bjid.2020.04.003.
- Cota G, Freire ML, de Souza CS, Pedras MJ, Saliba JW, Faria V, et al. Diagnostic performance of commercially available COVID-19 serology tests in Brazil. Int J Infect Dis. 2020 Dec;101:382-390. doi: 10.1016/j.ijid.2020.10.008.
- Instituto Nacional de Controle da Qualidade em Saúde (INCQS). Monitoramento pós-mercado da qualidade de dispositivos para diagnóstico in vitro da COVID-19: análises laboratoriais. Disponível em: https://app.powerbi.com/view?r=eyJrIjoiZjQzMDE0NGUtN 2M4Yi00NTZiLTliN2MtMzA2YTZkMjcyNDRhIiwidCI6ImI2N2Fm MjNmLWMzZjMtNGQzNS04MGM3LWI3MDg1ZjVlZGQ4MSJ9. Acesso em 01 de ago de 2021.
- Teste COVID-19. Programa de avaliação de kits de diagnóstico para SARS-CoV-2. Disponível em: https://testecovid19.org/avaliacoes/ Acesso em 01 de ago de 2021.
- ControlLab. Sociedade Brasileira de Patologia Clínica/Medicina Laboratorial. Segunda avaliação de ensaio de proficiência pioneiro para os principais métodos de detecção do SARS-CoV2. Disponível em: https://d3q24xqhohc8r0.cloudfront.net/wp-content/uploads/Relatorio_EP_SARSCOV2_280920_v1_pt_final-1.pdf Acesso em 03 de ago de 2021.
- Alemany A, Baró B, Ouchi D, Rodó P, Ubals M, Corbacho-Monné M, et al. Analytical and clinical performance of the panbio COVID-19 antigen-detecting rapid diagnostic test. J Infect. 2021 May;82(5):186-230. doi: 10.1016/j.jinf.2020.12.033.
- Yang Y, Yang M, Shen C, Wang F, Yuan J, Li J, et al. Evaluating the accuracy of different respiratory specimens in the laboratory diagnosis and monitoring the viral shedding of 2019-nCoV infections. medRxiv 2020doi: 10.1101/2020.02.11.20021493 Disponível em: https://www.medrxiv.org/content/medrxiv/early/2020/02/17/2020.02.11.20021493. full.pdf Acesso em 04 de ago 2021.
- Ai T, Yang Z, Hou H, Zhan C, Chen C, Lv W, et al. Correlation of chest CT and RT-PCR testing in coronavirus disease 2019 (COVID-19) in China: a report of 1014 cases. Radiology. 2020 Aug;296(2):E32-E40. doi: 10.1148/radiol.2020200642.
- Bačura AS, Dorotić M, Grošić L, Džimbeg M, Dodig S. Current status of the lateral flow immunoassay for the detection of SARS-CoV-2 in nasopharyngeal swabs. Biochem Med (Zagreb). 2021 Jun 15;31(2):020601. doi: 10.11613/BM.2021.020601.
- Kuna AT, Hanžek M, Vukasović I, NikolacGabaj N, Vidranski V, Ćelap I, et al. Comparison of diagnostic accuracy for eight SARS-CoV-2 serological assays. Biochem Med (Zagreb). 2021 Feb 15;31(1):010708. doi: 10.11613/BM.2021.010708.
- Liu L, Wang P, Nair MS. et al. Potent neutralizing antibodies against multiple epitopes on SARS-CoV-2 spike. Nature 2020 Aug;584(7821):450-456. doi: 10.1038/s41586-020-2571-7.
- WHO. World Health Organization. Antigen-detection in the diagnosis of SARS-CoV-2 infection using rapid immunoassays, 2020. Disponível em: https://www.who.int/publications/i/ item/antigen-detection-in-the-diagnosis-of-sars-cov-2infection-using-rapid-immunoassays. Acesso em 04 de ago 2021.
- Plaga A, Wei R, Olson E, Payto D, Harrington J, Nwe-Kissig PT, et al. Evaluation of the Clinical Performance of 7 Serological Assays for SARS-CoV-2 for Use in Clinical Laboratories. J Appl Lab Med. 2021 Jul 7;6(4):998-1004. doi: 10.1093/jalm/jfab038.
- Trabaud MA, Icard V, Milon MP, Bal A, Lina B, Escuret V. Comparison of eight commercial, high-throughput, automated or ELISA assays detecting SARS-CoV-2 IgG or total antibody. J Clin Virol. 2020 Nov;132:104613. doi: 10.1016/j.jcv.2020.104613.
- Oved K, Olmer L, Shemer-Avni Y, Wolf T, Supino-Rosin L, Prajgrod G, et al. Multi-center nationwide comparison of seven serology assays reveals a SARS-CoV-2 nonresponding seronegative subpopulation. E Clinical Medicine. 2020, 29-30. doi: 10.1016/j.eclinm.2020.100651
Correspondência
Flávia Martinello
Departamento de Análises Clínicas
Centro de Ciências da Saúde
Universidade Federal de Santa Catarina
E-mail: [email protected]
