A importância da realização de cultura de escarro para o diagnóstico de tuberculose pulmonar em pacientes paucibacilares
The importance of performing sputum culture for the diagnosis of pulmonary tuberculosis in paucibacillary patients
Fabiano de Jesus Santos1, Joyce Eliza de Oliveira Souza Tenorio1, Luciana Galdino Portugal1
1 Fundação Oswaldo Cruz, Laboratório de Diagnóstico, Ensino e Pesquisa, Centro de Saúde Escola Germano Sinval Faria – Escola Nacional de Saúde Pública. Rio de Janeiro, RJ, Brasil.
Recebido em 13/10/2023
Aprovado em 19/02/2024
DOI: 10.21877/2448-3877.202400152
INTRODUÇÃO
A tuberculose é uma das doenças mais antigas da história, cujo agente etiológico conhecido como Mycobacterium tuberculosis ou bacilo de Koch foi descrito em 1882 por Robert Koch. É um patógeno aeróbico estrito, e por possuir a habilidade de multiplicação no interior de células fagocitárias é considerado intracelular facultativo.(1)
A transmissão do Mycobacterium tuberculosis ocorre diretamente entre pessoas. No momento em que o portador fala, espirra ou tosse, perdigotos que contenham o agente infeccioso podem ser aspirados por outro indivíduo, contaminando-o. A probabilidade de infecção e evolução para a doença depende de vários fatores, como condições socioeconômicas, debilidade física, inanição, fome, população carcerária, população em situação de rua, indígenas, uso de medicamentos como imunossupressores e corticoides, neoplasias, infecção pelo HIV, e algumas condições clínicas como diabetes mellitus e silicose.(2,3)
Segundo a Organização Mundial de Saúde, um terço da população, em nível mundial, já está infectada pelo Mycobacterium tuberculosis.(4) Em 2018, houve uma estimativa de 10,4 milhões de pessoas que desenvolveram tuberculose, 580 mil com tuberculose multirresistente ou tuberculose resistente somente à rifampicina, e 1,4 milhão de morte pela doença. No mesmo ano foram detectados 6,1 milhões de casos novos de tuberculose. Houve redução da subnotificação entre 2013 e 2015, porém ainda há 4,3 milhões de casos subnotificados, sobretudo pela Índia, Indonésia e Nigéria. Os 60% de casos novos notificados de tuberculose no mundo têm por origem a China, o Paquistão e a África do Sul.(4) Nas Américas, a taxa de tuberculose corresponde a 3% da carga mundial desta doença, com 268 mil casos novos, distribuídos entre Brasil (33%), Peru (14%), México (9%) e Haiti (8%), que possuem a maior carga.(5)
O Brasil está entre os 30 países que apresentam as maiores taxas de tuberculose. Em 2015, o percentual de detecção de tuberculose no país foi de 87%, segundo a Organização Mundial de Saúde. No Rio de Janeiro, em 2018, foram registrados 66,3 casos/100 mil habitantes, o que faz com que este estado seja o segundo com o maior coeficiente de incidência de tuberculose, antecedido apenas pelo estado do Amazonas, que teve coeficiente de incidência de 72,9 casos/100 mil habitantes.(6,7)
O controle da tuberculose se estabelece quando há diagnóstico laboratorial e tratamento correto prontamente, contribuindo assim para a interrupção da cadeia de transmissão da doença.(8) De acordo com a Organização Mundial de Saúde, o Estado deve disponibilizar uma rede de laboratório para obter resultados com agilidade e qualidade.(1) Devido a isto, o laboratório clínico é considerado estratégico por fornecer dados que influenciam diretamente o diagnóstico de tuberculose, seguimento de tratamento e nas ações epidemiológicas.
Dentre as técnicas laboratoriais, destaca-se a pesquisa de bacilo álcool ácido resistente – BAAR (baciloscopia), cultura de escarro e o teste rápido molecular, que são técnicas preconizadas pela Organização Mundial de Saúde e indicadas para investigação de micobactérias.
Embora o teste rápido molecular seja o mais indicado por otimizar e acelerar o diagnóstico de tuberculose pulmonar, este teste ainda é considerado um exame de custo elevado, não estando acessível a todos os pacientes. A baciloscopia, portanto, ainda é considerada a técnica de menor custo, simples e rápida, porém apresenta baixa sensibilidade, que varia de 60% a 80% quando comparada com a cultura, sendo necessária uma quantidade de bacilo maior que 5.000/mL de escarro para que o resultado seja positivo. Além disso, a partir desta técnica não é possível isolar a micobactéria, o que impossibilita a identificação de espécie e a obtenção do perfil de sensibilidade aos fármacos tuberculostáticas.(9)
A cultura é apontada como o “padrão ouro” para análise investigativa do Mycobacterium tuberculosis, tendo em vista que são necessárias apenas de 10 a 100 células bacterianas viáveis para obter um resultado positivo. Possui elevada especificidade e sensibilidade, dependendo da quantidade e qualidade da amostra submetida à cultura. Dentre os casos pulmonares que apresentem baciloscopias negativas, definidos como paucibacilares, a cultura pode aumentar em até 30% o diagnóstico bacteriológico da doença, tornando-se assim o meio mais eficaz de se detectar a tuberculose em pacientes que apresentem uma carga bacilar insuficiente para ser evidenciada na baciloscopia.
Neste sentido, o objetivo deste estudo foi destacar, através da avaliação do panorama de análises laboratoriais realizadas em uma Unidade Básica de Saúde, a importância da cultura para o diagnóstico de tuberculose pulmonar em pacientes paucibacilares.
MATERIAL E MÉTODOS
Foram analisadas, retrospectivamente, durante o período de Julho de 2019 a Dezembro de 2020, um total de 1.059 culturas e baciloscopias realizadas em amostras de escarros de pacientes sintomáticos respiratórios, com suspeita clínica de tuberculose, atendidos no Laboratório de Diagnóstico, Ensino e Pesquisa do Centro de Saúde Escola Germano Sinval Faria, uma Unidade Básica de Saúde da Escola Nacional de Saúde Pública/FIOCRUZ no Rio de Janeiro. Todas as culturas foram realizadas através do método de Ogawa-Kudoh e as baciloscopias pela técnica de Ziehl-Neelsen. Também se procedeu a um estudo descritivo transversal. Esta pesquisa só foi iniciada após o parecer favorável do Comitê de Ética em Pesquisa da Escola Nacional de Saúde Pública, sob o número CAAE: 66431522.5.0000.5240.
RESULTADOS E DISCUSSÃO
A cultura e a baciloscopia de escarro são metodologias de escolha para a investigação laboratorial de tuberculose pulmonar. Com a execução destes métodos em todas as amostras de sintomáticos respiratórios com suspeita de tuberculose, foi possível verificar uma prevalência de 19% de amostras com cultura positiva (Figura 1). Os indivíduos que apresentaram cultura negativa (76,60%) não tiveram registros de análises em amostras posteriores e nem dados clínicos que evidenciassem a hipótese de resultado falso negativo e, portanto, considerados casos negativos para tuberculose. A partir deste levantamento foi possível observar também que houve contaminação em 4,40% das amostras analisadas, condição que inviabiliza a continuidade da análise laboratorial. Observou-se, ainda, que deste grupo de amostras contaminadas, não houve retorno de pacientes para recoleta, sendo considerados como diagnóstico modificado ou clinicamente não relevantes.
A baciloscopia é utilizada para o diagnóstico de tuberculose não somente pela sua rapidez, mas pelo baixo custo e fácil execução. Estas características facilitam a realização deste exame pela maioria dos laboratórios; o diagnóstico laboratorial apresenta baixo custo, pois, uma vez que se obtenha um resultado positivo, é necessária a presença de um quantitativo de 5 a 10 mil bacilos por mL de amostra.(10) A partir deste estudo pode-se observar a presença de resultados falsos negativos, ou seja, 32,70% das amostras que apresentaram crescimento bacteriano não tinham baciloscopia positiva em exame direto do escarro (Figura 2).
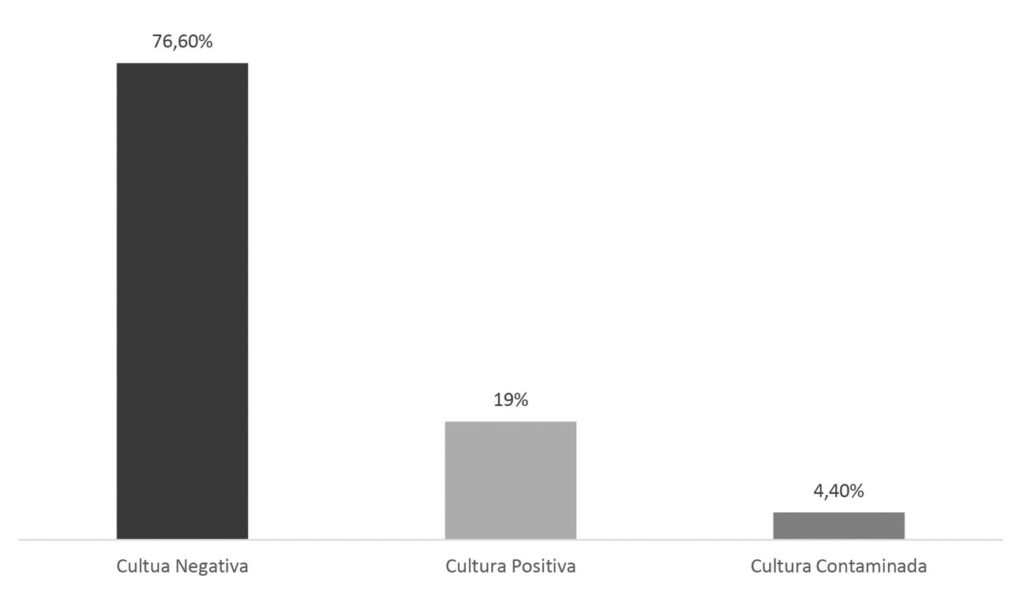
Figura 1
Panorama de culturas realizadas no período de Julho de 2019 a Dezembro de 2020 (n=1059).
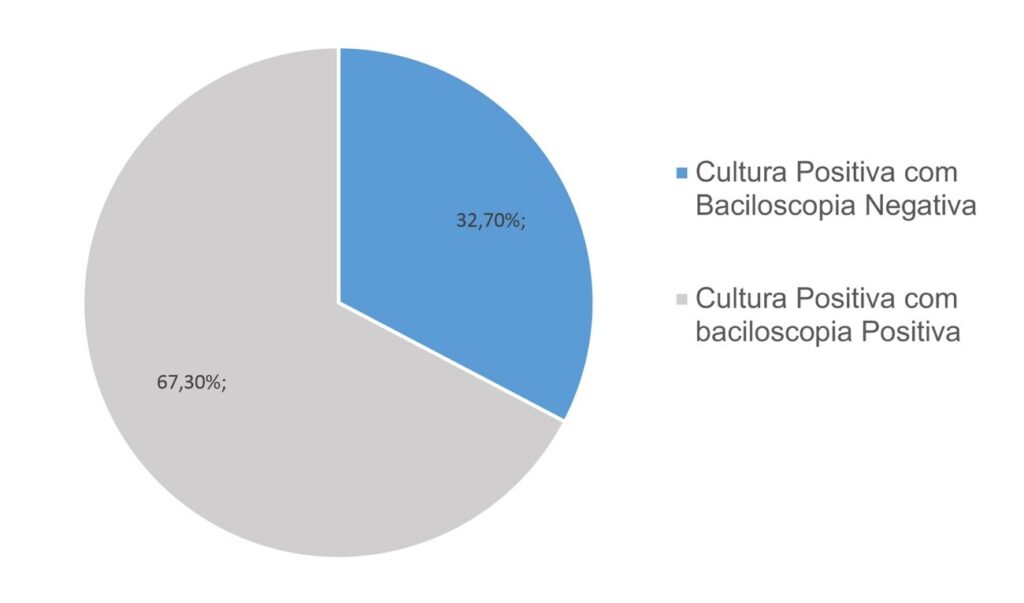
Figura 2
Distribuição de culturas positivas que apresentaram, em análise direta do escarro, baciloscopias positivas (BAAR+) e Baciloscopias Negativas (BAAR-) (n = 202).
Legenda: BAAR = bacilo ácool-ácido resistente.
Segundo Bethlem,(11) a presença de resultados falsos negativos pode ser decorrente do sistema imunitário do próprio indivíduo, que mantém os níveis de infecção sob controle por um período, ou das características metabólicas do bacilo, que em sua maioria apresenta um crescimento lento, sobretudo no estágio inicial da doença.
A partir deste estudo foi possível verificar, também, que 7,50% das micobactérias isoladas em amostras clínicas previamente negativas no exame de baciloscopia apresentaram resistência aos fármacos tuberculostáticos, conforme pode ser observado na Figura 3. Esta condição tem sido associada ao abandono de tratamento e ao uso incorreto dos medicamentos.(12)
Ainda em relação ao perfil de suscetibilidade, constatou-se que em todas as micobactérias que apresentaram resistência a frequência maior foi à isoniazida (100%), seguida da resistência à estreptomicina (40%) e à rifampicina (20%), conforme pode ser observado na Figura 4.
Não se evidenciou resistência dessas cepas ao etambutol. A resistência é definida como um mecanismo preocupante, pois essa condição diminui a probabilidade de cura, aumenta o tempo de tratamento, a toxicidade e eleva custos.(13) De acordo com Carneiro,(14) espera-se que mais de 80% dos casos identificados com resistência à rifampicina apresentem também resistência à isoniazida, isto porque a resistência à rifampicina sugere mudanças estruturais da RNA polimerase que é produto de expressão do gene rpoB e que também se relaciona à resistência aos outros fármacos do esquema terapêutico. Entretanto, neste trabalho foi observado que a isoniazida foi a mais prevalente e não foi associada à rifampicina. Isto evidencia que tais cepas possivelmente não acumularam etapas de mutações individuais de diversos genes independentes, o que resultou na não aquisição em bloco de resistência a múltiplos fármacos.(15)
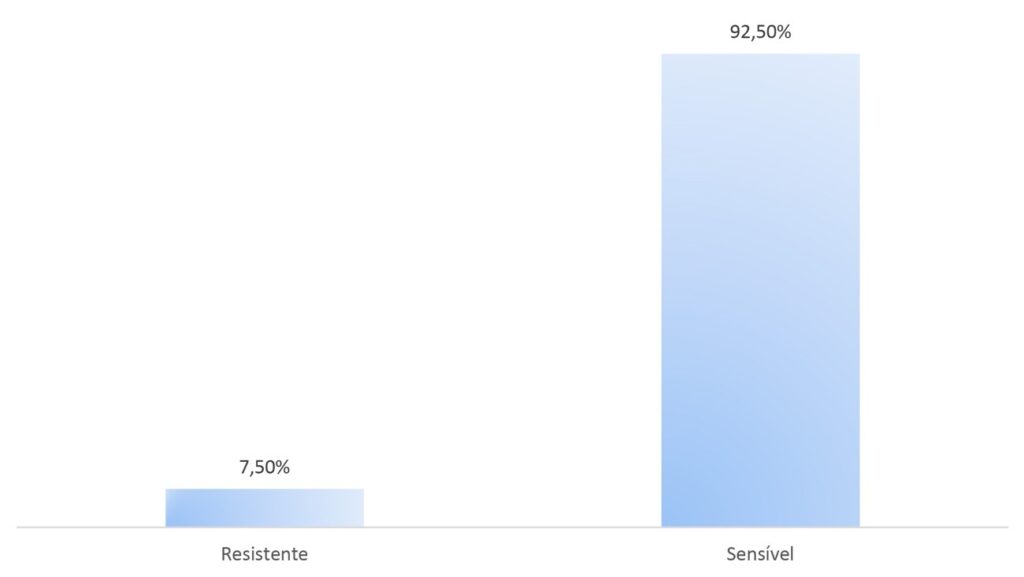
Figura 3
Relação de resistência aos fármacos tuberculostáticos, dentre as cepas resultantes de culturas positivas que apresentaram baciloscopias negativas em análise direta do escarro (n=66).
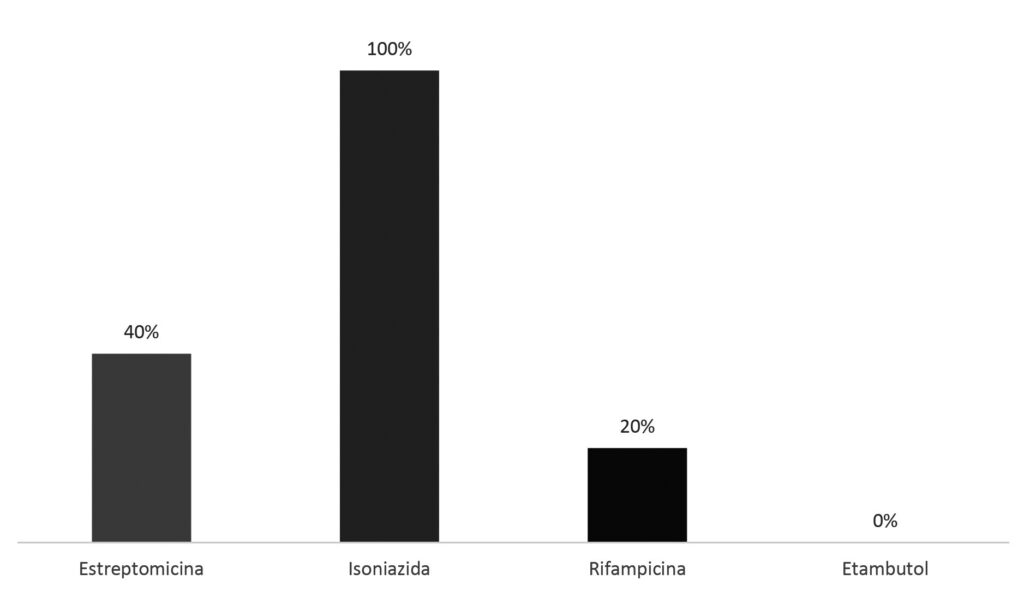
Figura 4
Perfil de resistência, por fármaco, encontrado em cepas resultantes de culturas positivas que apresentaram baciloscopias negativas em análise direta do escarro (n=8).
CONCLUSÃO
Diante deste cenário, verificou-se que dentre os pacientes que apresentaram baciloscopia negativa, o diagnóstico de tuberculose e a condução para o tratamento adequado só foram possíveis por ter sido realizada a cultura e, consequentemente, o isolamento do microrganismo. Este exame não só permite o diagnóstico de tuberculose pulmonar em pacientes paucibacilares, como também contribui para o direcionamento de um tratamento adequado e eficaz, tendo em vista que o perfil de resistência só foi evidenciado a partir do isolamento da micobactéria. Sendo assim, é imprescindível que a cultura seja realizada em todas as amostras de escarro na rotina laboratorial.
REFERÊNCIAS
- Brasil DF. Manual de Recomendações para Controle da Tuberculose no Brasil. Ministério da Saúde, 2019. Disponível em www.saúde.gov.br/bvs Acesso em: 13/09/2019.
- Biblioteca Virtual em Saúde; Dicas de Saúde, novembro de 2007; disponível em: http://bvsms.saude.gov.br/html/pt/dicas/dica_tuberculose.html; acessado em: 21/07/10.
- Brasil DF. Manual Nacional de Vigilância Laboratorial da Tuberculose e outras Micobactérias. Ed. 2008.
- Ministério da Saúde. Plano nacional pelo fim da tuberculose/ Brasil livre da tuberculose. Ministério da Saúde, 2017.
- Munayco CV, Mújica OJ, León FX, Granado M, Espinal MA. Social determinants and inequalities in tuberculosis incidence in Latin America and the Caribbean. Rev Panam Salud Publica. 2015;38(3):177-85.
- Valente BC, Angelo JR, Kawa H, Baltar VT. A tuberculose e seus fatores associados em um município da região metropolitana do Rio de Janeiro. Rev Bras Epidemiol, 22: E190027, 2019.
- Ministério da Saúde. Boletim Epidemiológico/Brasil livre da tuberculose: evolução dos cenários epidemiológicos e operacionais da doença. Ministério da Saúde, v.50, Mar 2019.
- Oliveira GS, Castro GRCL, Silva JX, Naves Janeth OS, Filho CMRM. Laboratory identification of mycobacteria from respiratory samples of patients with suspected pulmonary tuberculosis in samples isolated at the Central Laboratory of Public Health of the Federal District (LACEN-DF). J. Health Biol Sci. 2016, 4(3):187-192.
- Cetrangolo N. Prevalência da M. tuberculosis em paciente HIV resistente à Rifampicina no PCR do GeneXpert do HUGG. Dissertação: Universidade Federal do Estado do Rio de Janeiro, Programa de Pós-Graduação em Medicina, 2018.
- Silva NS, Almeida KRH, Neto CAM, Araújo AA, Oliviera SR. Análise comparativa da técnica de baciloscopia no diagnóstico da tuberculose pulmonar frente ao GeneXpert em amostras de pacientes da cidade de Recife, Pernambuco. RBAC, 2019;51(1):65-9.
- Bethlem EP. Manifestações clínicas da tuberculose pleural ganglionar, geniturinária e do sistema nervoso central. Pulmão RJ. 21(1):19-22, 2012.
- Tartara MB. Epidemiologia molecular e perfil de resistência do Mycobacterium tuberculosis em regiões de fronteira do Brasil, ICICT, Fiocruz, v.1, 2019.
- Jacobs R, Multidrug resistant tuberculosis. Clin Infect Dis 19; 1-10, 2019.
- Carneiro MDS, Nunes LS, David SMM, Dias CF, Barth AL, Unis G. Doença pulmonar por micobactéria não tuberculosa em um cenário de alta incidência de tuberculose no Brasil. J Bras Pneumol, 44 (2):106-111, 2018.
- Campos HS. Mycobacterium tuberculosis resistente: de onde vem a resistência. Boletim de Pneumologia Sanitária, v.7, n.1, Jan/Jun, 1999.
Correspondência
Fabiano de Jesus Santos
E-mail: [email protected]
