Sinergismo de ceftazidima/avibactam e aztreonam, associado à polimixina, para tratamento de dupla infecção por bactérias pan-resistentes
Synergism of ceftazidime/avibactam and aztreonam, associated with polymixin, for the treatment of dual infections by pan-resistant bacteria
José Felipe Pinheiro Vieira1,2,3, Thallyta Tavares Antunes1,2,4, Dilbert Silva Velôso1,2, Tairo Cesar Oliveira1,2,5, Ilara Ferreira Ribeiro1,2,5, Igor Denizarde Bacelar Marques1,5, Jeamile Lima Bezerra1,3, Laisa Fontinele Sá1,3, Telma Lima Vieira1,2,4, Jessica Sousa Vaz1,3, Daniel Matos Costa6
1 Hospital Universitário da Universidade Federal do Piauí – HU-UFPI. Teresina, PI, Brasil.
2 Empresa Brasileira de Serviços Hospitalares – Ebserh, Grupo de Trabalho em Uso Racional de Antimicrobianos. Teresina, PI, Brasil.
3 Empresa Brasileira de Serviços Hospitalares – Ebserh, Unidade de Farmácia Clínica e Dispensação. Teresina, PI, Brasil.
4 Empresa Brasileira de Serviços Hospitalares – Ebserh, Unidade de Vigilância em Saúde. Teresina, PI, Brasil.
5 Empresa Brasileira de Serviços Hospitalares – Ebserh, Unidade de Terapia Intensiva – Teresina, Piauí – Brasil
6 Universidade Federal do Piauí – UFPI, Departamento de Farmácia. Teresina, PI, Brasil.
Recebido em 18/08/2023
Aprovado em 08/01/2024
DOI: 10.21877/2448-3877.202400140
INTRODUÇÃO
Em março de 2020, a OMS declarou a pandemia de Covid-19, causada pelo vírus SARS-CoV-2, chegando aos 36.331.281 casos confirmados no Brasil, com 413.535 casos e 8.027 óbitos em 2022 no Piauí.(1,2) Enquanto a maioria dos casos requerem apenas tratamento sintomático, os quadros mais graves, sobretudo de pacientes com comorbidades, requerem manejo em UTI com intubação orotraqueal (IOT), com risco de evolução para pneumonia associada a ventilador. A internação em UTI com IOT apresentou alta taxa de mortalidade no Brasil, oscilando na faixa de 80% durante o pico da pandemia, e esteve associada a muitos casos de coinfecções por bactérias multirresistentes no mundo todo.(3-5) Somado à antibioticoterapia empírica pelos pacientes intubados pela infecção do novo coronavírus, cerca de 33% das pessoas diagnosticadas com Covid fizeram uso de algum antibiótico por automedicação antes de procurar o serviço hospitalar, fatos que contribuíram para o crescente número de bactérias multirresistentes durante a pandemia.(6,7) Dentre as bactérias isoladas em pacientes internados por SARS-CoV-2, a Klebsiella pneumoniae e Acinetobacter baumanii estão entre as mais recorrentes.(8) O presente trabalho objetiva relatar o caso de um paciente internado no Hospital Universitário da Universidade Federal do Piauí (HU-UFPI), em Teresina – Piauí, para tratamento de Covid-19, que evoluíra com coinfecção por Klebsiella pneumoniae produtora de carbapenemase e da metalo-beta-lactamase de Nova Deli (fenótipo KPC e NDM) e Acinetobacter baumanii, também produtora de carbapenemase.
RELATO DE CASO
Paciente admitido no HU-UFPI em 27/08/2020, portador de hipertensão e obesidade grau III, com Covid-19, apresentando síndrome respiratória aguda grave (SRAG), choque séptico e febre, com leucócitos de 16,28×10³/mm³, PCR de 146,5mg/L e dímero D de 634,8ng/mL, ocasião em que os parâmetros clínicos e laboratoriais convergiram para prontamente ser submetido à intubação e sedação. Ainda na admissão, foram prescritos empiricamente meropeném endovenoso (EV) 2000mg, 3 vezes ao dia, e vancomicina EV 1000mg, 2 vezes ao dia, e ambos antimicrobianos foram prescritos por 16 dias.
No terceiro dia de internação, o paciente teve o clearance de creatinina (ClCr) mais baixo registrado, de 18,8ml/min/1,73 m², com melhora progressiva sem hemodiálise, voltando a apresentar queda constante do ClCr a partir de D17, iniciando hemodiálise em D25. Além disso, o paciente evoluíra com dímero D permanentemente elevado, com pico de 3.839,4ng/dL. A Figura 1 apresenta um resumo da evolução.
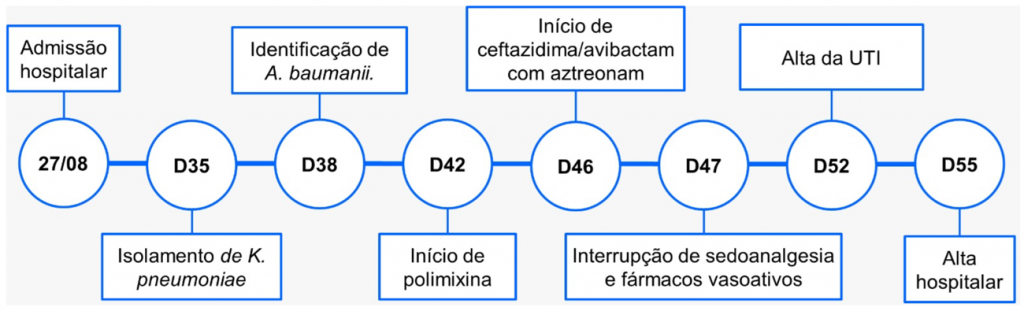
Figura 1
Evolução cronológica da internação.
No 35º dia, em cateter de nasofaringe, isolou-se Klebsiella pneumoniae fenótipo KPC (do inglês Klebsiella pneumoniae carbapenemase) e com gene de resistência NDM (metalo β-lactamase de Nova Deli) ambos identificados em teste NG-carba 5 (Laborclin®). Em D38, identificou-se Acinetobacter baumanii em hemocultura, produtora de carbapenemase, pan-resistente, sensível somente à colistina, que fora testada posteriormente. As espécies foram identificadas via Vitek-MS (BioMérieux Brasil), e os testes de sensibilidade aos antimicrobianos foram realizados de acordo com o preconizado Brazilian Committee on Antimicrobial Susceptibility Testing (BrCast). A padronização de antimicrobianos (ATM) do HU-UFPI segue a classificação AWaRe (do inglês Access, Watch, Reserve), proposta pela OMS. Diante disso, as bactérias supracitadas eram resistentes a todos os ATM padronizados no Hospital. O perfil de sensibilidade das bactérias está descrito na Tabela 1.
Tabela 1
Antibiograma das bactérias isoladas.
| ATB TESTADO | K. pneumoniae | A.baumanii |
| AMICACINA | R | R |
| AMPICILINA | R | R |
| AMPICILINA-SULBACTAM | R | R |
| CEFEPIMA | R | R |
| CEFOXITINA | R | R |
| CEFTAZIDIMA | R | R |
| CEFTRIAXONA | R | R |
| CEFUROXIMA | R | Não testado |
| CIPROFLOXACINA | R | R |
| ERTAPENÉM | R | Não testado |
| GENTAMICINA | R | R |
| IMIPENÉM | R | R |
| MERPENÉM | R | R |
| PIPERACILINA-TAZOBACTAM | R | R |
| TIGECICLINA | R | R |
O programa de stewardship de antimicrobianos (PSA) do HU-UFPI é composto por farmacêutico clínico, médico infectologista, microbiologista clínico e enfermeiro. Diante dos resultados dos antibiogramas e da comprovação fenotípica das bactérias pan-resistentes, o referido PSA, por meio de uma pesquisa bibliográfica, buscou por evidências de suscetibilidade das bactérias supracitadas a outros ATM. A busca foi realizada nas plataformas PubMed, SciELO e ScienceDirect, utilizando os descritores Gram-negative, NDM e KPC, buscando revisões bibliográficas, revisões sistemáticas e relatos de casos publicados no período de 2015 a 2020.
Portanto, foram encontradas evidências que embasaram os testes in vitro. Neste sentido, testou-se, em ensaio in vitro por semeio de cultura com K. pneumoniae, a associação de ceftazidima/avibactam com aztreonam, que apresentou halo de inibição (Figura 2) e possível alternativa para o tratamento.
Dessa forma, a antibioticoterapia incluiu polimixina B, iniciada em D42, e em D46 a associação ceftazidima/avibactam com aztreonam, administrados em “Y” na tentativa de reproduzir o mais próximo do observado in vitro. A partir de então, houve redução dos parâmetros de infecção como febre, além PCR e leucócitos (Figura 3), com melhora clínica progressiva, interrompendo a administração de fármacos vasoativos e sedoanalgesia em D47, melhora da função renal em D51, com alta da UTI em D52 e alta hospitalar em D55.

Figura 2
Cultura para K. pneumoniae. Notar halo de inibição por amicacina (seta amarela), colistina (seta azul) e pela associação ceftazidima/avibactam (seta verde) com aztreonam (seta vermelha).
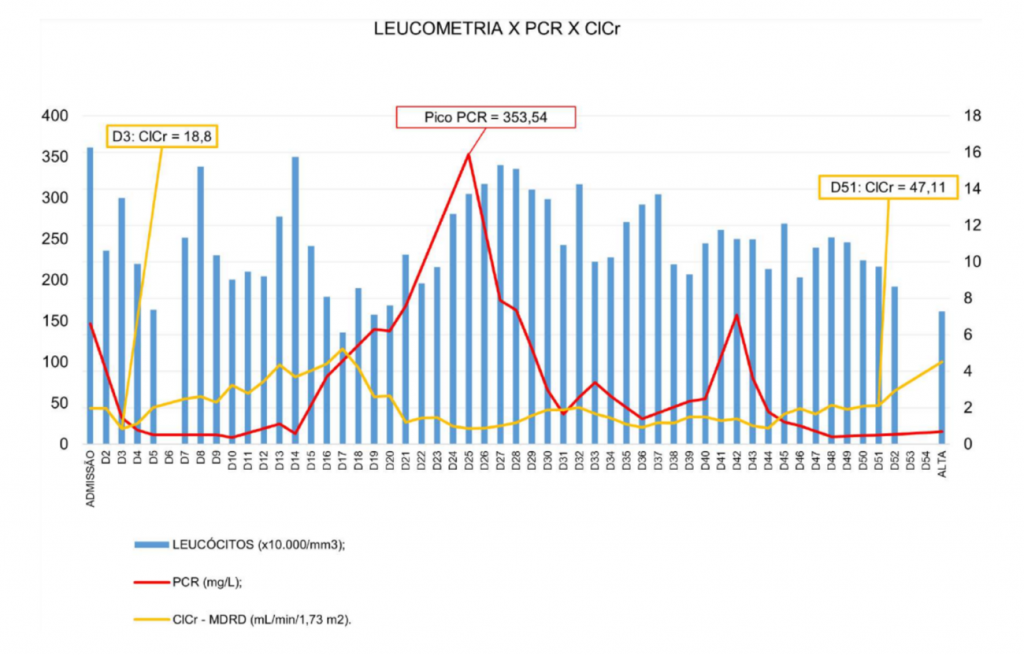
Figura 3
Evolução dos parâmetros laboratoriais.
Ao longo da internação outras infecções bacterianas foram diagnosticadas (Tabela 2), que não foram discutidas no trabalho por apresentarem sensibilidade aos antibióticos padronizados pelo hospital.
Os dados aqui mencionados foram retirados do prontuário eletrônico do paciente, com informações coletadas em conformidade com a Resolução nº 466/12, do Conselho Nacional de Ética em Pesquisa (CONEP), e com a Declaração de Helsinki/World Medical Association, sob o CAE n° 70407623.8.0000.8050.
Tabela 2
Demonstrativo das culturas positivas.
| Dia da coleta | Tipo de exame | Resultado | Observações |
| D5 | Hemocultura de cateter | Staphylococcus haemolyticus | Multirresistente, sensível à vancomicina |
| D23 | Lavado brancoalveolar | K. pneumoniae | Resistência intermediária à amicacina (MIC 32µg/mL) |
| D35 | Ponta de cateter – nasofaringe | K. pneumoniae | Pan-resistente. Fenótipo KPC e NDM |
| D35 | Hemocultura periférica | S. haemolyticus | Sensível à vancomicina |
| D38 | Ponta de cateter endovenoso | K. pneumoniae | Resistência intermediária à amicacina (MIC 32µg/mL) |
| D38 | Hemocultura de cateter | Acinetobacter baumanii | Fenótipo KPC |
DISCUSSÃO
Zeng et al.(9) (2020) relata uma correlação positiva dos valores de PCR com a gravidade da Covid-19. Não obstante, Zhan et al.(10) (2021) ressaltam que a gravidade da Covid-19 também está relacionada aos eventos cardiovasculares inerentes à infecção viral, sobretudo o alto risco de trombose venosa (TV), e portanto os biomarcadores de coagulação, principalmente dímero D, se mostram como marcadores de gravidade da Covid. Somado a isso, o SARS-CoV-2 provoca lesão renal aguda (LRA) de forma direta e indireta, sobretudo em pacientes crônicos, tendo a LRA como indicador de prognóstico ruim da doença, que somado ao uso de antimicrobianos nefrotóxicos levara o paciente à terapia substitutiva renal (11). Diante dessa perspectiva, dados os parâmetros laboratoriais expressos na Figura 3 nota-se que o paciente foi admitido em estado grave, evoluindo com piora ao longo da internação.
As bactérias Klebsiella pneumoniae e Acinetobacter baumanii produtoras de carbapenemase estão entre as bactérias multirresistentes mais recorrentes em casos de coinfecção hospitalar associada à Covid.(12) Segundo Dias et al.(13) (2021), durante a pandemia houve um importante aumento de K. pneumoniae e A. baumanii multirresistentes, fato corroborado por um estudo realizado no Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto, no qual Gaspar et al.(14) (2021) relatam que a ocorrência de K. pneumoniae KPC aumentou em 62,1% durante a pandemia, e que A. baumanii resistente a carbapenemase aumentou em 78,6% no mesmo período.
A respeito do tratamento das bactérias isoladas, Baravo et al.(15) (2022) elencam uma série de relatos de casos que mostram a combinação ceftazidima/avibactam como opção de tratamento viável contra K. pneumoniae KPC, bem como a necessidade de outras combinações para tratar o fenótipo NDM. Outros estudos sugerem a combinação de ceftazidima/avibactam com aztreonam, ou até mesmo a associação de aztreonam com meropeném/vavorbactam, como opções eficazes contra K. pneumoniae KPC e NDM.(16-18) Quanto ao A. baumanii KPC, um estudo multicêntrico conduzido por Boral et al.(19) (2019) mostrou alta suscetibilidade à polimixina E em infecções de trato urinário.
Portanto, uma abordagem terapêutica baseada em culturas microbiológicas evita a administração desnecessária de medicamentos ineficazes,(20) o que corrobora a importância do programa de Stewardship de antimicrobianos (PSA) do HU-UFPI, já que os testes in vitro, bem como a decisão das prescrições foram baseados em evidências. Diante disso, é notório o impacto da atuação do PSA sobre o desfecho do paciente, pois é fato que as intervenções, alterações, sugestões e decisões baseadas em evidências são peças-chave para eficácia terapêutica, evitar reações adversas e o desenvolvimento de resistência antimicrobiana.(21)
Ademais, o estudo mostrou a importância da padronização de antimicrobianos de reserva. A combinação ceftazidima/avibactam, comercialmente denominada Torgena® (Pfizer), e o aztreonam foram prescritas como “medicamento próprio do paciente”. Durante o presente relato, a padronização de antibacterianos de reserva AWaRe não incluía os antimicrobianos supracitados. O aztreonam, outrora padronizado, foi novamente incluído na padronização em outubro de 2020, e a combinação ceftazidima/avibactam incluída em junho de 2021.(22)
CONCLUSÃO
A combinação de ceftazidima/avibactam e aztreonam deve ser considerada uma opção de tratamento viável para pacientes com infecções por K. pneumoniae produtoras de carbapenemase do tipo NDM. Por isso, nota-se a importância da elucidação microbiológica e dos mecanismos de resistência, assim como a interação do time de Stewardship, com médico infectologista, farmacêutico clínico e microbiologista, e a padronização de antibióticos de reserva terapêutica, para o tratamento de infecções por microrganismos multirresistentes e pan-resistentes.
REFERÊNCIAS
- Ministério da Saúde. Boletins Epidemiológicos Covid-19. Disponível em: https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/boletins/epidemiologicos/covid-19. Acesso em: 05 mar. 2023.
- Hu B, Huang S, Yin L. The cytokine storm and Covid-19. J Med Virol. 2020 Jun;93(1): 250-256. doi 10.1002/jmv.26232. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7361342/. Acesso em: 5 de mar 2023.
- Parasher A. Covid-19: Current understanding of its Pathophysiology, Clinical presentation and Treatment. Postgrad Med J. 2021 May;97(1147):312-320. doi: 10.1136/postgradmedj-2020-138577. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10017004/. Acesso em: 5 de mar 2023
- Chang R, Elhusseiny KM, Yeh YC, Sun WZ. Covid-19 ICU and mechanical ventilation patient characteristics and outcomes-A systematic review and meta-analysis. 2021 Feb;16(2). doi: 10.1371/journal.pone.0246318. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7877631/. Acesso em: 5 de mar 2023.
- Orellana JDY, Marrero L, Horta BL. Letalidade hospitalar por Covid-19 em quatro capitais brasileiras e sua possível relação temporal com a variante gama, 2020-2021. Epidemiologia serv. saúde. 2021 dez;30(4). doi: 10.1590/S1679-49742021000400024. Disponível em: http://scielo.iec.gov.br/scielo.php?script=sci_arttext&pid=S1679-49742021000400316. Acesso em: 5 de mar 2023.
- Russo A, Gavaruzzi F, Ceccarelli G, Borrazzo C, Oliva A, Alessandri F, et al. Multidrug-resistant Acinetobacter baumannii infections in Covid-19 patients hospitalized in intensive care unit. 2022 Feb;50(1):83-92. doi: 10.1007/s15010-021-01643-4. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8236000/. Acesso em: 9 de mar 2023.
- Ghosh S, Bornman C, Zafer MM. Antimicrobial Resistance Threats in the emerging Covid-19 pandemic: Where do we stand? J Infect Public Health. 2021 May;14(5):555-560. doi: 10.1016/j.jiph.2021.02.011. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7934675/. Acesso em: 9 de mar 2023.
- Santos AP, Gonçalves LC, Oliveira ACC, Queiroz PHP, Ito CRM, Santos MO, Carneiro LC. Bacterial co-infection in patients with Covid-19 hospitalized (ICU and not ICU): Review and meta-analysis. 2022 Jul 4;11(7):894. doi: 10.3390/antibiotics11070894. Disponível em: https://pubmed.ncbi.nlm.nih.gov/35884147/. Acesso em: 15 set 2023.
- Zeng F, Huang Y, Guo Y, Yin M, Chen X, Xiao L, et al. Association of inflammatory markers with the severity of Covid-19: A meta-analysis. Int J Infect Dis. 2020 Jul; 96:467-474. doi: 10.1016/j.ijid.2020.05.055. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7233226/. Acesso em: 4 jun 2023.
- Zhan H, Chen H, Liu C, Cheng L, Yan S, Li H, et al. Diagnostic Value of D-Dimer in Covid-19: A Meta-Analysis and Meta-Regression. Clin Appl Thromb Hemost. 2021 Jan-Dec;27:1-10. doi: 10.1177/10760296211010976. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8114749/. Acesso em: 4 de jun 2023.
- Hilton J, Boyer N, Nadim MK, Forni LG, Kellum JA. Covid-19 and Acute Kidney Injury. Crit Care Clin. 2022 Jul;38(3):473-489. doi: 10.1016/j.ccc.2022.01.002. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8743571/. Acesso em: 26 de jun 2023.
- Wu HY, Chang PH, Chen KY, Lin IF, Hsih WH, Tsai WL, et al. Coronavirus disease 2019 (Covid-19) associated bacterial coinfection: Incidence, diagnosis and treatment. J Microbiol Immunol Infect. 2022 Dec;55(6):985-992. doi: 10.1016/j.jmii.2022.09.006. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9536868/. Acesso em: 4 de jun 2023.
- Dias VMCH, Tuon F, Capelo PJ, Telles JP, Fortaleza CMCB, Baena CP. Trend analysis of carbapenem-resistant Gram-negative bacteria and antimicrobial consumption in the post-Covid-19 era: an extra challenge for healthcare institutions. J Hosp Infect. 2022 Feb;120:43-47. doi: 10.1016/j.jhin.2021.11.011. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8603865/. Acesso em: 4 de jun 2023.
- Gaspar GG, Ferreira LR, Feliciano CS, Campos Júnior CP, Molina FMR, Vendruscolo ACS, et al. Pre- and post-Covid-19 evaluation of antimicrobial susceptibility for healthcare-associated infections in the intensive care unit of a tertiary hospital. Rev Soc Bras Med Trop. 2021 Jul 23;54. doi: 10.1590/0037-8682-0090-2021. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8313097/. Acesso em: 4 de jun 2023.
- Bavaro DF, Belati A, Diella L, Poli MA, Calamo A, De Candia G, et al. Prompt and Appropriate Antimicrobial Therapy Improves Outcomes of NDM-Producing and KPC-Producing Klebsiella pneumoniae Bloodstream Infections in Patients Hospitalized for Covid-19: A Comparative Retrospective Case-Series. Antibiotics (Basel). 2022 Oct 31;11(11):1519. doi: 10.3390/antibiotics11111519. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9686740/. Acesso em: 19 de jun 2023.
- Falcone M, Daikos GL, Tiseo G, Bassoulis D, Giordano C, Galfo V, et al. Efficacy of Ceftazidime-avibactam Plus Aztreonam in Patients With Bloodstream Infections Caused by Metallo-β-lactamase-Producing Enterobacterales. Clin Infect Dis. 2021 Jun 1;72(11):1871-1878. doi: 10.1093/cid/ciaa586. Disponível em: https://academic.oup.com/cid/article/72/11/1871/5840534?login=false. Acesso em: 19 de jun 2023.
- Belati A, Bavaro DF, Diella L, De Gennaro N, Di Gennaro F, Saracino A. Meropenem/Vaborbactam Plus Aztreonam as a Possible Treatment Strategy for Bloodstream Infections Caused by Ceftazidime/Avibactam-Resistant Klebsiella pneumoniae: A Retrospective Case Series and Literature Review. Antibiotics (Basel). 2022 Mar 10;11(3):373. doi: 10.3390/antibiotics11030373. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8944480/. Acesso em: 19 de jun 2023.
- Behzadi P, García-Perdomo HA, Karpiński TM, Issakhanian L. Metallo-ß-lactamases: a review. Mol Biol Rep. 2020 Aug;47(8):6281-6294. doi: 10.1007/s11033-020-05651-9. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32654052/. Acesso em: 19 de jun 2023.
- Boral B, Unaldi Ö, Ergin A, Durmaz R, Eser ÖK. A prospective multicenter study on the evaluation of antimicrobial resistance and molecular epidemiology of multidrug-resistant Acinetobacter baumannii infections in intensive care units with clinical and environmental features. Ann Clin Microbiol Antimicrob. 2019 Jul 2;18(1):19. doi: 10.1186/s12941-019-0319-8. Disponível em: https://ann-clinmicrob.biomedcentral.com/articles/10.1186/s12941-019-0319-8. Acesso em: 19 de jun 2023.
- Wu CT, Chen CL, Lee HY, Chang CJ, Liu PY, Li CY, et al. Decreased antimicrobial resistance and defined daily doses after implementation of a clinical culture-guided antimicrobial stewardship program in a local hospital. J Microbiol Immunol Infect. 2017 Dec;50(6):846-856. doi: 10.1016/j.jmii.2015.10.006. Disponível em: https://www.sciencedirect.com/science/article/pii/S1684118215009019?via%3Dihub. Acesso em: 19 de jun 2023.
- Majumder MAA, Rahman S, Cohall D, Bharatha A, Singh K, Haque M, et al. Antimicrobial Stewardship: Fighting Antimicrobial Resistance and Protecting Global Public Health. Infect Drug Resist. 2020 Dec 29; 13:4713-4738. doi: 10.2147/IDR.S290835. Disponível em: https://pubmed.ncbi.nlm.nih.gov/33402841/. Acesso em: 15 set 2023.
- Silva LK, Medeiros AF, Figueiró-Souza AF, Martins MA, Bertollo CM. Impacto potencial da Covid-19 no perfil de consumo de antibacterianos de reserva – AWaRe em unidade de terapia intensiva de um hospital público. Rec Bras Farm Hosp Serv Saúde. 2023 Mai; 14(2):0896. DOI: 10.30968/. Disponível em: https://www.hrtn.fundep.ufmg.br/wp-content/uploads/2023/06/Impacto-potencial-da-Covid-19-no-perfil-de-consumo-de-antibacterianos-de-reserva-–-AWaRe-em-unidade-de-terapia-intensiva-de-um-hospital-publico.pdf. Acesso em: 16 Set 2023
Correspondência
José Felipe Pinheiro Vieira
E-mail: felipepinheirofarmaceutico@gmail.com
