Avaliação fármaco-toxicológica do emprego de N-acetilcisteína no manejo da COVID-19
Pharmacological and toxicological evaluation of the N-acetylcysteine in clinical management of COVID-19
Matheus Grilo de Oliveira Carvalho1
Virgínia Martins Carvalho2
1Bacharel em Farmácia, Programa de Pós-Graduação em Alimentos e Nutrição da Universidade do Estado do Rio de Janeiro, Rio de Janeiro, RJ, Brasil.
2Bacharel em Farmácia, Mestre e Doutora em Toxicologia, Professor Adjunto da Faculdade de Farmácia da Universidade Federal do Rio de Janeiro, Rio de Janeiro, RJ, Brasil.
Recebido em 10/03/2021
Aprovado em 29/04/2021
DOI: 10.21877/2448-3877.202100960
INTRODUÇÃO
A doença COVID-19, causada pelo vírus SARS-CoV-2, é responsável pelo terceiro surto por coronavírus deste século e o sétimo a infectar seres humanos.(1) SARS-CoV-2 é um vírus zoonótico. O contato inicial entre humanos e o vírus em um mercado de frutos do mar em Wuhan, na China, com a ingestão de morcegos contaminados constitui uma das hipóteses da origem da SARS-Cov-2.(1) A partir desse contágio inicial, o vírus teria começado a se propagar pelo contato entre humanos, a partir de gotículas ou por via fecal.(1) Por mais que a SARS-CoV-2 seja menos letal do que os surtos anteriores, a taxa de transmissão é maior e pode explicar o porquê da COVID-19 ter causado uma pandemia com elevada taxa de transmissão em comparação aos demais surtos.(1)
Esforços globais foram adotados para o desenvolvimento de vacinas e terapias farmacológicas capazes, respectivamente, de prevenir e tratar efetivamente a COVID-19. Diferentes abordagens terapêuticas estão sendo avaliadas, como o uso de anti-inflamatórios, antivirais, anticoagulantes, imunomoduladores e antioxidantes.
Dentre os alvos farmacológicos, o estresse oxidativo é relevante na fisiopatologia da infecção e pode ser um alvo promissor. Essa hipótese é sustentada por alguns estudos que apontam o estresse oxidativo como um dos fatores que levam ao agravamento do paciente infectado, com base em dados epidemiológicos e de surtos anteriores.(2–4) Desta forma, o uso de antioxidantes como terapia de suporte é justificado e deve ser avaliado.
Entre os antioxidantes utilizados na clínica, a N-acetilcisteína (NAC) é um fármaco com propriedades terapêuticas conhecidas em infecções respiratórias, inclusive na síndrome respiratória aguda grave (SARA).(5) Sua atividade antioxidante, especialmente como precursor de glutationa, e anti-inflamatória pode ser explorada no tratamento da COVID-19. Assim, o objetivo deste trabalho foi realizar uma análise crítica, à luz das publicações científicas, sobre o uso da NAC como terapia de suporte em pacientes infectados pelo vírus SARS-CoV-2.
Material e métodos
A análise crítica foi realizada por revisão bibliográfica através de levantamento de artigos originais e de revisão de dados epidemiológicos, estudos clínicos e estudo de casos. As bases utilizadas no levantamento bibliográfico foram PubMed, Scielo, EBSCO e Elsevier. Os estudos clínicos foram levantados no site clinicaltrials.gov; os dados epidemiológicos foram extraídos de órgãos oficiais de saúde, como a Organização Mundial da Saúde e o Ministério da Saúde.
Os descritores adotados foram: “COVID19”, ”SARSCOV 2”, “ARDS”, “ACE2”, “antioxidants”, “antioxidants therapy”, “n-acetylcysteine”, “gluthatione” e “oxidative stress”. Para aperfeiçoar o mecanismo de busca, foram utilizados os operadores booleanos “and, “or” e “not”. Os estudos foram avaliados a partir da leitura dos resumos e os que se encaixaram dentro da temática do estudo foram incluídos na revisão. Além disso, foi aplicado um filtro temporal entre 2003 e 2021 dos estudos selecionados para a revisão bibliográfica.
Resultados e discussão
O estresse oxidativo e a COVID-19
Correlação entre o estresse oxidativo e o agravamento da COVID-19 foi sugerida em casos de SARA causada por outras coronoviroses, com base na avaliação de manifestações clínicas e mecanismos fisiopatológicos.
O estresse oxidativo é uma condição patológica definida como um desequilíbrio das concentrações endógenas de fatores pró-oxidantes em relação a antioxidantes.(6) Os radicais livres constituem os fatores pró-oxidantes e são compostos principalmente por espécies reativas de oxigênio (EROs) e espécies reativas de nitrogênio (ERNs) que contribuem em lesões celulares, desequilíbrio metabólico e na liberação de marcadores pró-inflamatórios.(2) As moléculas reativas em condições de homeostase atuam no metabolismo transportando elétrons em reações bioquímicase participam de mecanismos de defesa celular em processos inflamatórios, na ativação de genes e fertilização de óvulos.
Se o aumento de espécies reativas contribui para o agravamento da COVID-19, o uso de antioxidantes poderia atenuar o quadro de lesão celular ocasionado pelo estresse oxidativo, melhorando o desfecho clínico. Os dois principais danos estudados são os macromoleculares teciduais e o da interrupção dos circuitos tiol redox executado especialmente pela glutationa.(2)
Achados laboratoriais em pacientes com COVID-19 justificam a investigação do papel do estresse oxidativo neste quadro inflamatório. Alguns marcadores, como a ferritina, glutationa (GSH) e ácido úrico apresentam-se alterados em pacientes infectados. Polonikov(3) relatou uma deficiência de GSH em pacientes com COVID-19 e encontrou uma correlação entre essa deficiência e o agravamento da infecção, embora sua casuística seja de apenas quatro pacientes. O esgotamento de GSH afeta o potencial antioxidante celular, levando à maior concentração de EROs, que por sua vez estimula a produção de fatores pró-inflamatórios, como NF-kBe TNF-α.(4)A hiperferritina observada em pacientes com COVID-19 está associada ao aumento da mortalidade.(7) A ferritina é uma proteína globular que armazena ferro e é utilizada como marcador em processos inflamatórios e no processo de regulação do ferro. O aumento de ferritina ocorre concomitante ao aumento da hepcidina, um importante hormônio que induz o armazenamento de ferro devido a sua sobrecarga ou a estímulos de outros hormônios e citocinas.(8) Desta forma, é possível que esses dois marcadores possam sinalizar uma sobrecarga de ferro em especial no local da inflamação, que pode estar relacionada com o aumento do estresse oxidativo, a partir da reação de Fenton.
Outro marcador clínico observado em pacientes com COVID-19 foi a diminuição da dosagem de ácido úrico, sendo referida correlação entre o decréscimo de ácido úrico e aumento da gravidade da doença.(9) Na clínica, a avaliação da dosagem de ácido úrico é utilizada principalmente como marcador do metabolismo de purinas e de inflamação. O ácido úrico possui grande participação na defesa antioxidante, neutralizando por volta de 60% das EROs presentes no plasma.(10)
Avaliando os aspectos epidemiológicos da COVID-19, observa-se que pacientes idosos, portadores de doenças crônicas como hipertensão, diabetes e asma e fumantes são mais suscetíveis a ter insuficiência respiratória e, assim, um pior prognóstico em comparação aos demais grupos populacionais.(1)Este grupo de pacientes também está relacionado por possuir condições clínicas favoráveis ao aumento do estresse oxidativo,(3) em geral são pacientes que apresentam resposta antioxidante menos competente e um aumento de EROs e ERNs devido aos processos fisiopatológicos de suas morbidades. Desequilíbrio redox foi observado em ensaios em modelo animal, em que ratos idosos infectados com a SARS-CoV-1 apresentaram lesões pulmonares mais graves em comparação com ratos jovens, sendo sugerido que o sistema de defesa antioxidante enfraquecido devido à senescência com aumento de EROs estaria relacionado à gravidade.(2) Assim, um quadro clínico mais vulnerável a variações de EROs, especialmente em idosos, pode contribuir para a suscetibilidade do agravamento da infecção, justificando a inserção desse grupo de pacientes em grupo de risco para a COVID-19.
Diferentes mecanismos de geração de radicais livres foram propostos para o SARS-CoV-2a partir da fisiopatologia da COVID-19 e de comparações por infecções por outros coronavírus, em especial o SARS-CoV-1.Alguns desses mecanismos envolvem a ativação da NADPH oxidase (Nox) via receptor da enzima conversora de angiotensina-2 acoplado à proteína G tipo 1(AT1), a geração e liberação de EROs via NSP5 e a degranulação de neutrófilos (netose), abordados neste trabalho.
Ativação da NADPH Oxidase (Nox) via receptor AT1R
A ativação Nox é a principal via de formação de EROs, incluindo ânion radical de superóxido (O2•−) e peróxido de hidrogênio (H2O2).(4)Em estudo, Violi et al. mostraram que pacientes com COVID-19 apresentaram níveis elevados de Nox2 em relação ao controle, sendo que os níveis foram maiores em pacientes graves em comparação com pacientes com quadro leve a moderado,(11) sugerindo que a via da Nox estaria envolvida no aumento do estresse oxidativo durante a infecção por SARS-Cov-2. Além de aumentar os níveis de EROs, essa via ativa o NF-kB responsável pela síntese de diversas citocinas e quimiocinas pró-inflamatórias, estando presente, por exemplo, na formação do inflamassoma NLRP3, levando à piroptose de células infectadas.
A enzima conversora de angiotensina-2 (ECA-2) possui uma função contrarregulatória no sistema renina-angiotensina-aldosterona, promovendo vasodilatação, atividade anti-inflamatória, antiproliferativa e cardioprotetora.(12) A infecção por SARS-Cov-2 ocasiona um feedback negativo de ECA-2, aumentando a biodisponibilidade da angiotensina-2, uma vez que os receptores de ECA-2 estarão reduzidos e mais moléculas de angiotensina 2 estarão livres,(4) AT1R é ativado resultando em desequilíbrio redox a partir da ativação da Nox.(13) A ligação da angiotensina-2 em AT1R resulta na ativação de Nox 1 e 2 via proteína quinase C (PKC) e c-src (uma proto-oncogenese cinase) e na ativação de Nox 5 pela liberação de cálcio intracelular.(13) As Nox resultarão na produção de ERO via mitocondrial.
Geração de EROs pela 3CLpro (NSP5)
Lin et al.(14) avaliaram em estudo in vitro o papel da 3C-like protease (3CLpro), que é uma das proteases do tipo CoV nsp5 (NSP5) na ativação da via apoptótica na SARS-CoV-1, e demonstraram seu papel na ativação de caspases e aumento de EROs e NF-kB. A 3CLpro aumentou as concentrações de EROs e NF-kB em relação ao controle. É provável que o mesmo ocorra na SARS-CoV-2, uma vez que a NSP5 possui 97,5% de similaridade.(15)
Degranulação extracelular de espécies reativas
A degranulação extracelular por neutrófilos ocorre durante o processo inflamatório pulmonar pela COVID-19. É um mecanismo de destruição de patógenos alternativo à fagocitose, sendo, a princípio, benéfico ao organismo.(4) Entretanto, um descontrole desta via leva a uma liberação exacerbada de proteínas microbicidas e enzimas oxidantes.(4) Schönrich, Raftery e Samstag(16) sugerem que o aumento do estresse oxidativo em pacientes com COVID-19 leva a um aumento da netose, que por sua vez eleva a produção de EROs e suprime os mecanismos de imunidade adaptativa por linfócitos T, gerando um ciclo vicioso e levando à gravidade do paciente infectado.
Análise crítica da aplicação terapêutica da N-acetilcisteína no manejo da COVID-19
O emprego de antioxidantes mostrou resultados favoráveis no manejo de doenças respiratórias, como doença pulmonar obstrutiva crônica (DPOC), pneumonias, SARA e sepse pulmonar.(5,17)Há diversos tipos de terapias antioxidantes com medicamentos como a N-acetilcisteína e suplementos alimentares, como vitaminas C, D, E, e micronutrientes como o magnésio e o zinco que têm por objetivo melhorar o estado clínico do paciente, restabelecer o equilíbrio antioxidante ou atuar no mecanismo fisiopatológico.
NAC é um fármaco sintetizado a partir do aminoácido cisteína, que possui ação mucolítica, antioxidante, antídota e anti-inflamatória.(18) Por doar cisteína, atua como precursora de GSH, que compõe o sistema antioxidante endógeno. As indicações farmacológicas são: antídoto em pacientes intoxicados por paracetamol e mucolítico em doenças pulmonares como DPOC, fibrose pulmonar e infecções respiratórias pulmonares.(18) A posologia depende da indicação clínica, variando de 150mg/kg empregado no tratamento antidotal na intoxicação por paracetamol a 200 mg/dia como mucolítico. Em relação às propriedades farmacocinéticas, a NAC apresenta tempo de meia-vida biológica de 5 a 6 horas em adultos, baixa biodisponibilidade, entre 6% a 10% por administração oral, e volume de distribuição de 0,5 L/kg.(18)
Em relação ao perfil toxicológico, a NAC apresenta segurança em doses de até 500 mg/kg.(18)Em estudos experimentais, os níveis de doses letais foram 1000 mg/kg em camundongos, 2445 mg/kg em ratos, 1500 mg/kg em porquinhos da índia, 1200 mg/kg em coelhos e 500 mg/kg em cães.(18) Não existem dados sobre letalidade em seres humanos, porém a dose letal humana foi estimada entre 5 e 15 g/kg; considerando a menor dose estimada, a dose letal para indivíduo de 70 kg seria de 350 g. Os sinais e sintomas da intoxicação aguda são ataxia, hipoatividade, dificuldade respiratória, cianose, perda de reflexo e convulsões. Apesar do perfil de segurança elevado, a NAC pode apresentar eventos adversos, como broncoespasmo em pacientes asmáticos e irritação gástrica que pode agravar quadros de úlcera péptica.(18)
A possível atuação da NAC na infecção por SARS-CoV-2 tem base em mecanismos diretos e indiretos, tais como ação antioxidante, anti-inflamatória e mucolítica (Figura 1).
A ação antioxidante da NAC ocorre tanto direta quanto indiretamente, neste caso doando o substrato cisteína para a síntese de GSH endógena. Apesar de a NAC possuir baixa reatividade aos principais EROs, como H2O2, O²- e HO.,(19)apresenta alta reatividade ao ácido hipocloroso e espécies relacionadas, que são liberadas em processos inflamatórios por neutrófilos e macrófagos. O restabelecimento dos níveis de GSH em pacientes com COVID-19 permite o equilíbrio da defesa antioxidante e ação contra os principais mecanismos radicalares, neutralizando EROs como peróxido de hidrogênio (H2O2), superóxido (O²–) e radical hidroxila (HO.).(19) O esgotamento de GSH foi associado ao agravamento do quadro clínico de pacientes infectados pela COVID-19, assim a recuperação de GSH endógena é fundamental e pode ser considerada a principal via de atuação da NAC no manejo da COVID-19.(3).
Outro mecanismo indireto de ação antioxidante da NAC na COVID-19 é pela ação nos receptores ECA. O mecanismo de geração de EROs via receptor AT1 e da ativação da Nox ocorre de forma exacerbada na SARS-CoV-2 devido à ligação do vírus ao receptor ECA-2, que atua como contrarregulador desta via. Estudo in vitro demonstrou a capacidade da NAC de bloquear o receptor ECA-1, diminuindo as concentrações de angiotensina-2 e o estresse oxidativo celular.(20) O bloqueio dessa via pode atenuar a liberação de EROs, devido a inativação da Nox pela via da ECA-2.
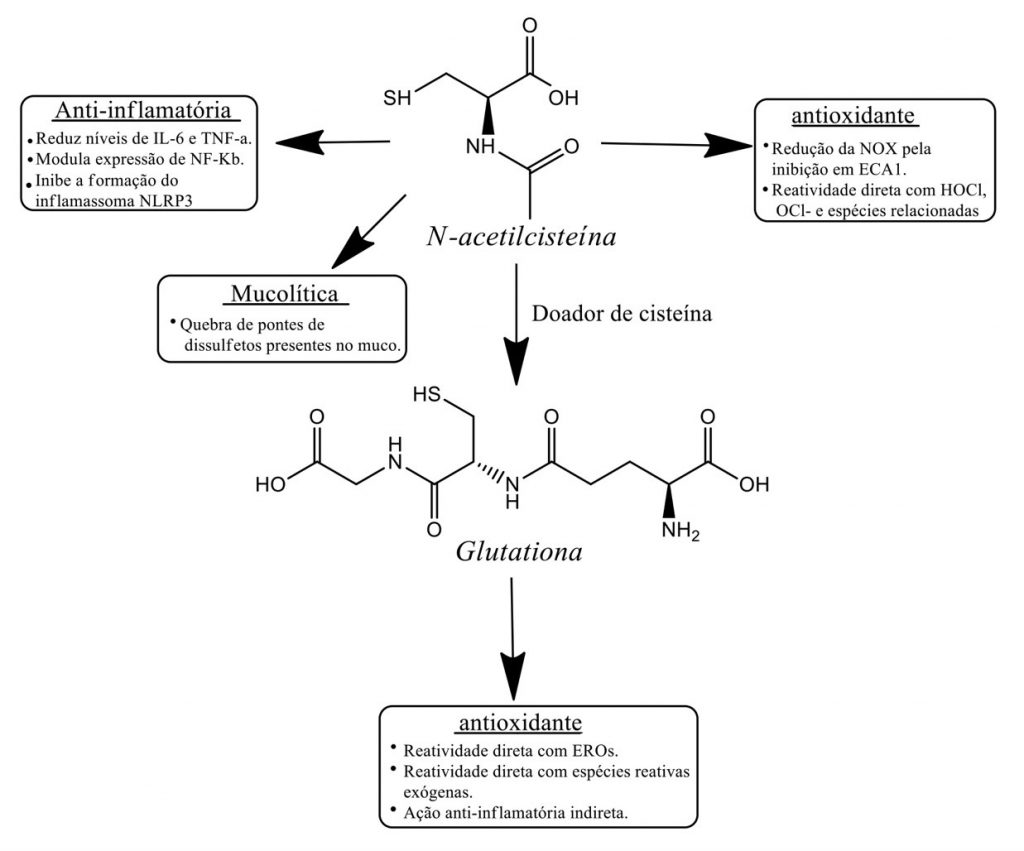
Figura 1. Atividade farmacológica da N-acetilcisteína
A atividade anti-inflamatória da NAC é devida, em parte, pelas propriedades da recuperação dos níveis de GSH. Estudos demonstram que a NAC diminui importantes marcadores inflamatórios, que estão presentes na COVID-19, como o NF-kB, TNF-α e a IL-6.(5,21) Além disso, a NAC diminui citocinas relacionadas à formação do inflamassoma NLRP3, como a IL-1β, IL-18, além do próprio NF-kB, que participam da via da piroptose e está relacionada com a fisiopatologia da COVID-19.(22) Essas citocinas são responsáveis pela produção de outras citocinas pró-inflamatórias e estão relacionadas com a resposta exacerbada, levando ao quadro de tempestade de citocinas. Assim, a NAC pode minimizar o quadro hiperinflamatório em estágios iniciais da COVID-19 antes que ocorra injúria do tecido pulmonar. Ainda, a inibição de NF-kB pela NAC tem sido associada a uma diminuição da replicação viral por vírus de RNA, como os Coronavirus.(23)
Em relação ao efeito mucolítico da NAC, ele é baseado na presença de um grupo sulfidrila livre(-SH) que abre as ligações dissulfeto(S-S) das glicoproteínas do muco, reduzindo a sua viscosidade e elasticidade.(24) Liu et al.(25) relata a produção de muco pela ativação da via IDO-Kyn como um dos fatores que levam ao quadro de hipóxia na COVID-19. A ação de um mucolítico como a NAC pode melhorar a fluidez pulmonar e contribuir para a melhora clínica da hipóxia.
A NAC demonstra um potencial farmacológico na COVID-19, com mecanismos que poderiam atenuar o quadro hiperinflamatório e minimizar a tempestade de citocinas, além de outros ganhos terapêuticos. Entretanto, é necessário cautela para não hiperestimar sua relevância na prática clínica. A meta-análise realizada por Galvão et al.(26)demonstrou resultados conflitantes para o uso da NAC no quadro de lesão pulmonar aguda e na SARA, embora parte dos estudos avaliados tenham demonstrado melhora no estresse oxidativo e nos níveis de oxigenação. Especificamente na COVID-19, um estudo clínico realizado no Hospital das Clínicas, São Paulo, Brasil, avaliou o uso da NAC intravenosa em pacientes graves e constatou que a NAC foi ineficaz em reduzir a mortalidade e a necessidade de ventilação mecânica,(27) embora tal estudo tenha sido realizado apenas com pacientes graves, já hospitalizados.
Em relação ao esquema terapêutico, é importante considerar que o lapso temporal entre o agravo do quadro clínico e início do tratamento farmacológico pode representar fator determinante no prognóstico clínico. O uso da NAC no tratamento de pacientes intoxicados por paracetamol é um exemplo. Em doses tóxicas o paracetamol forma o metabólito altamente reativo N-acetil-p-benzo-quinonaimina (NAPQI) responsável pela necrose hepática por promover peroxidação lipídica nos hepatócitos. Neste quadro, a administração da NAC possui o objetivo de fornecer cisteína ao tecido hepático para a síntese de GSH, que irá diminuir, por sua vez, o dano celular causado pelo aumento do estresse oxidativo promovido pela NAPQI. A administração da NAC após dez horas da intoxicação, entretanto, começa a demonstrar uma diminuição de eficácia terapêutica.(28) Isso ocorre porque o dano celular causado pelo estresse oxidativo já é extenso, e o uso da NAC não permite regenerar tecido já lesionado, mas evitar o processo que leva à necrose hepática. Essa lógica se aplica aos pacientes infectados por SARS-CoV-2. À medida que o quadro de hiperinflamação e dano celular avança, o potencial de prevenção ao estresse oxidativo da NAC diminui.
O objetivo terapêutico primário para a NAC é o restabelecimento da defesa antioxidante frente à COVID-19, a diminuição de citocinas pró-inflamatória, como o NF-kB, TNF-α e IL-6, e um desfecho clínico mais favorável, evitando o agravamento da infecção em pacientes com o quadro leve a moderado, quadro este que poderia ser aferido pela equipe de saúde. A determinação do momento certo para o início da terapia é fundamental, visto que a administração deva ocorrer antes do dano celular extenso devido ao aumento do estresse oxidativo. A transição entre o quadro moderado para forma grave seria tardia para o início do tratamento com a NAC. Isso porque, apesar da NAC apresentar pico plasmático em menos de duas horas, a glutationa demora quatro dias para chegar em seu pico em pacientes portadores de SARA.(29)
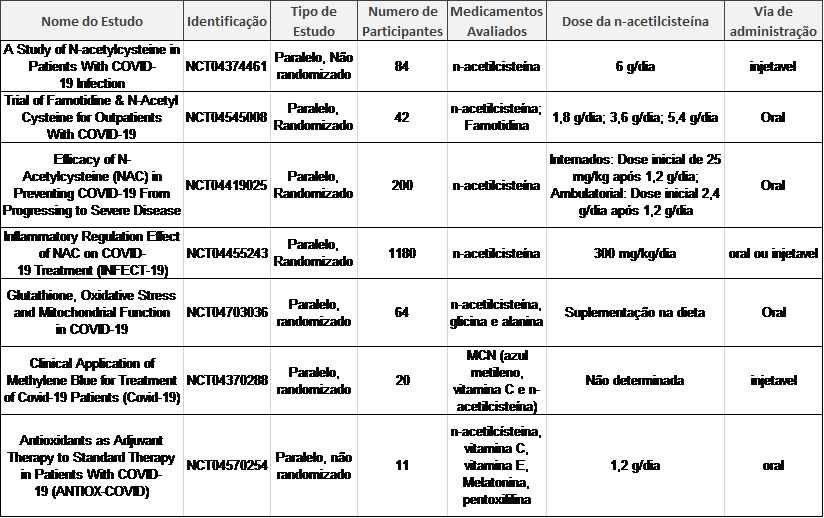
Atualmente há sete estudos clínicos registrados no clinicaltrials.gov que pesquisa a adoção de NAC no manejo da COVID-19 (Quadro1). De forma geral, os estudos utilizam doses elevadas de NAC, acima de 1200 mg/dia, em diferentes grupos populacionais. Dose de 1200 mg/dia foi suficiente para diminuir os níveis de TNF-α e IL-6 e elevar os níveis de GSH em estudos clínicos sugerindo o potencial terapêutico no tratamento de pacientes com quadro leve a moderado.(5,24) Em relação ao tempo de administração, os estudos clínicos trabalham com faixa de uma a três semanas de tratamento, sendo tal faixa relativa ao quadro clínico do paciente que deverá ser avaliada individualmente.
Quadro 1 – Estudos clínicos sobre manejo de COVID-19 com N-acetilcisteína.
O uso de GSH injetável possibilita a disponibilidade imediata do antioxidante independentemente da biossíntese celular,(30) sugerindo aplicação mais adequada em quadros moderado a grave em ambiente hospitalar que requer resultados clínicos mais imediatos. Por outro lado, a administração de NAC que apresenta latência de quatro dias para atingir o pico plasmático de GSH seria de maior aplicação em quadros leves a moderados, oferecendo, além da ação antioxidante, atividade anti-inflamatória e mucolítica. A disponibilidade de várias formulações de NAC no mercado, como comprimido, pó, xarope e injetável, facilita o planejamento da terapia.
Conclusão
A literatura científica mostra associação entre o estresse oxidativo e o agravamento da COVID-19 sugerindo o potencial de antioxidantes no manejo da doença. Dentre os antioxidantes disponíveis, a NAC se destaca pelo uso consagrado como antioxidante, mucolítico e antídoto para intoxicação por paracetamol. A NAC possui estudos de segurança e eficácia para as indicações arroladas por diferentes vias de administração e tem disponibilidade no mercado de várias formulações. O uso da NAC podeser recomendado como uma terapia de suporte na COVID-19. Seu uso individual não levará em si ao processo de cura da infecção, mas poderá atenuar alguns aspectos fisiopatológicos, como a hiperinflamação e o estresse oxidativo.
Outros antioxidantes com potencial de uso são melatonina,que também possui ação anti-inflamatória, vitamina C que vem sendo estudada no manejo da COVID-19 em 53 estudos clínicos registrados no clinicaltrials.gov, e outros suplementos tais como vitamina E e zinco.
Abstract
Introduction: Focusing the efforts to minimizing the injury caused by COVID-19 virus, many pharmacological targets have been studied. The lung hyper inflammation was referred as a consequence of the oxidative stress and supports the antioxidant therapy, especially the N-acetylcysteine administration that has been proposed in some clinical studies. Aims: In order to make a critical analysis of COVID-19 clinical management with N-acetylcysteine, the physiopathology of the infection was compared with the pharmacological and toxicological properties of the N-acetylcsteine. Methodology: A literature review was made and the peer-reviewed articles, epidemiologic data, clinical studies and case reports were consulted. The pharmacological and toxicological data were compared to evaluate the potential risks and benefits of the N-acetylcysteine therapy. Results: The COVID-19 physiopathology is based on the hyper inflammation that is a consequence of the cytokines storm (release of a large amount of pro-inflammatory cytokines and chemokines). The hyper inflammation can result in the Severe Acute Respiratory Syndrome (SARS). The cytokines storm was associated with the oxidative stress and the severity of the infection. N-acetylcysteine seems to improve the inflammation by its antioxidant and anti inflammatory properties. Furthermore, N-acetylcysteine shows high tolerability hate in doses until 500 mg/kg. Conclusion: N-acetylcysteine shows high therapeutic potential to decrease the oxidative stress in early stages of the infection in COVID-19 patients.
Keywords
COVID-19; oxidative stress; antioxidants; N-acetylcysteine
Referências
- Dhama K, Khan S, Tiwari R, Sircar S, Bhat S, Malik YS, et al. Coronavirus Disease 2019–COVID-19. Clin Microbiol Rev. 2020 Jun;33(4).
- Delgado-Roche L, Mesta F. Oxidative Stress as Key Player in Severe Acute Respiratory Syndrome Coronavirus (SARS-CoV) Infection. Arch Med Res. 2020 Jul;51(5) p. 384-7.
- Polonikov A. Endogenous Deficiency of Glutathione as the Most Likely Cause of Serious Manifestations and Death in COVID-19 Patients. ACS InfectDis. 2020 Jul;6(7) p. 1558-62.
- Beltrán-García J, Osca-Verdegal R, Pallardó FV, Ferreres J, Rodríguez M, Mulet S, et al. Oxidative Stress and Inflammation in COVID-19-Associated Sepsis: The Potential Role of Anti-Oxidant Therapy in Avoiding Disease Progression. Antioxidants. 2020 Sep;9(10) p. 936.
- Zhang Q, Ju Y, Ma Y, Wang T. N-acetylcysteine improves oxidative stress and inflammatory response in patients with community acquired pneumonia. Med (United States). 2018;97(45).
- Barbosa KBF, Costa NMB, Alfenas R de CG, De Paula SO, Minim VPR, Bressan J. Estresse oxidativo: conceito, implicações e fatores modulatórios. Rev Nutr. 2010 Aug;23(4) p. 629–43.
- Cheng L, Li H, Li L, Liu C, Yan S, Chen H, et al. Ferritin in the coronavirus disease 2019 (COVID-19): A systematic review and meta-analysis. J Clin Lab Anal. 2020 Oct;34(10).
- Zhou C, Chen Y, Ji Y, He X, Xue D. Increased Serum Levels of Hepcidin and Ferritin Are Associated with Severity of COVID-19. Med Sci Monit. 2020 Sep;26.
- He B, Wang J, Wang Y, Zhao J, Huang J, Tian Y, et al. The Metabolic Changes and Immune Profiles in Patients With COVID-19. Front Immunol. 2020 Aug;11.
- Fabbrini E, Serafini M, Colic Baric I, Hazen SL, Klein S. Effect of Plasma Uric Acid on Antioxidant Capacity, Oxidative Stress, and Insulin Sensitivity in Obese Subjects. Diabetes. 2014 Mar;63(3) p. 976-81.
- Violi F, Pastori D, Cangemi R, Pignatelli P, Loffredo L. Hypercoagulation and Antithrombotic Treatment in Coronavirus 2019: A New Challenge. ThrombHaemost. 2020 Jun 29;120(06) p. 949–-56. doi: 10.1055/s-0040-1710317
- Nunes-Silva A, Rocha GC, Magalhaes DM, Vaz LN, Salviano de Faria MH, Simoes e Silva AC. Physical Exercise and ACE2-Angiotensin-(1-7)-Mas Receptor Axis of the Renin Angiotensin System. Protein Pept Lett. 2017 Nov;24(9).
- Dikalov SI, Nazarewicz RR. Angiotensin II-Induced Production of Mitochondrial Reactive Oxygen Species: Potential Mechanisms and Relevance for Cardiovascular Disease. Antioxid Redox Signal. 2013 Oct;19(10) p. 1085-94.
- Lin C-W, Lin K-H, Hsieh T-H, Shiu S-Y, Li J-Y. Severe acute respiratory syndrome coronavirus 3C-like protease-induced apoptosis. FEMS Immunol Med Microbiol. 2006 Apr;46(3) p. 375-80.
- Yoshimoto FK. The Proteins of Severe Acute Respiratory Syndrome Coronavirus-2 (SARS CoV-2 or n-COV19), the Cause of COVID-19. Protein J. 2020 Jun;39(3) p. 198-216.
- Schönrich G, Raftery MJ, Samstag Y. Devilishly radical NETwork in COVID-19: Oxidative stress, neutrophil extracellular traps (NETs), and T cell suppression. Adv Biol Regul. 2020 Aug;77: 100741. doi: 10.1016/j.jbior.2020.100741.
- Nathens AB, Neff MJ, Jurkovich GJ, Klotz P, Farver K, Ruzinski JT, et al. Randomized, Prospective Trial of Antioxidant Supplementation in Critically Ill Surgical Patients. Ann Surg. 2002 Dec;236(6) p. 814-22.
- National Center for Biotechnology Information. Acetylcysteine. 2021.
- Aldini G, Altomare A, Baron G, Vistoli G, Carini M, Borsani L, et al. N-Acetylcysteine as an antioxidant and disulphide breaking agent: the reasons why. Free Radic Res. 2018 Jul;52(7) p. 751-62.
- Ullian ME, Gelasco AK, Fitzgibbon WR, Beck CN, Morinelli TA. N-Acetylcysteine Decreases Angiotensin II Receptor Binding in Vascular Smooth Muscle Cells. J Am Soc Nephrol. 2005 Aug;16(8) p. 2346-53.
- Griendling KK, Sorescu D, Ushio-Fukai M. NAD(P)H Oxidase. Circ Res. 2000 Mar;86(5) p. 494-501.
- Poe FL, Corn J. N-Acetylcysteine: A potential therapeutic agent for SARS-CoV-2. Med Hypotheses. 2020 Oct;143:109862.doi: 10.1016/j.mehy.2020.109862.
- Shi Z, Puyo CA. N-Acetylcysteine to Combat COVID-19: An Evidence Review. Ther Clin Risk Manag. 2020 Nov;Volume 16 p. 1047–55.
- Calzetta L, Matera MG, Rogliani P, Cazzola M. Multifaceted activity of N -acetyl- l -cysteine in chronic obstructive pulmonary disease. Expert Rev Respir Med. 2018 Aug;12(8) p. 693–708.
- Liu F, Li L, Xu M, Wu J, Luo D, Zhu Y, et al. Prognostic value of interleukin-6, C-reactive protein, and procalcitonin in patients with COVID-19. J ClinVirol. 2020 Jun;127:104370.doi: 10.1016/j.jcv.2020.104370.
- Galvão AM, Andrade AD de, Maia MB de S, Silva KER da, Bezerra A de A, Melo JF de, et al. Suplementação de antioxidantes no tratamento da lesão pulmonar aguda: meta-análise. RevBras Ter Intensiva. 2011 Mar;23(1) p. 41–8.
- de Alencar JCG, Moreira C de L, Müller AD, Chaves CE, Fukuhara MA, da Silva EA, et al. Double-blind, Randomized, Placebo-controlled Trial With N-acetylcysteine for Treatment of Severe Acute Respiratory Syndrome Caused by Coronavirus Disease 2019 (COVID-19). Clin Infect Dis. 2020 Sep.
- Park BK, Dear JW, Antoine DJ. Paracetamol (acetaminophen) poisoning. BMJ Clin Evid. 2015 Oct;2015.
- Bernard GR. N-Acetylcysteine in experimental and clinical acute lung injury. Am J Med. 1991 Sep;91(3) p. S54–9.
- Horowitz RI, Freeman PR, Bruzzese J. Efficacy of glutathione therapy in relieving dyspnea associated with COVID-19 pneumonia: A report of 2 cases. Respir Med Case Reports. 2020 Apr21;30:101063. doi: 10.1016/j.rmcr.2020.101063.
Correspondência
Virgínia Martins Carvalho
Faculdade de Farmácia da Universidade Federal do Rio de Janeiro, Avenida Carlos Chagas Filho, 373, 2º andar, Bloco A, Sala 3, Cidade Universitária – Ilha do Fundão – CEP 21941-902, Rio de Janeiro/RJ
Telefone:(21) 3938-6411 E-mail: [email protected]
