Diagnóstico laboratorial do SARS-CoV-2 por transcrição reversa seguida de reação em cadeia da polimerase em tempo real (RT-PCR)
Laboratory diagnosis of SARS-CoV-2 by real time reverse transcriptase-polymerase chain reaction (RT-PCR)
Maria Elizabeth Menezes1
Lenilza Mattos Lima2
Flávia Martinello2
1DNA ANÁLISES Laboratório. Florianópolis-SC, Brasil.
2Departamento de Análises Clínicas, Universidade Federal de Santa Catarina (UFSC). Florianópolis-SC, Brasil.
Instituições: Universidade Federal de Santa Catarina (UFSC); DNA Análises Laboratório. Florianópolis-SC, Brasil.
Recebido em 04/09/2020
Artigo aprovado em 18/09/2020
DOI: 10.21877/2448-3877.20200006
INTRODUÇÃO
No fim de 2019, um surto de pneumonia de etiologia indefinida na cidade de Wuhan, província de Hubei na China, foi relatado à Organização Mundial de Saúde (OMS). Subsequentemente, um novo coronavírus (nCoV) foi identificado. O coronavírus-2 da síndrome respiratória aguda grave (SARS-CoV-2), vírus que causa a doença do coronavírus-19 (COVID-19), é o mais novo membro do grupo coronavírus (CoV), família viral que foi descoberta pela cientista June Almeida em 1965. Os CoV foram identificados e assim denominados por apresentar, sob a luz da microscopia eletrônica, uma estrutura externa que lembra a de uma coroa.(1)
Os CoV são uma grande família de vírus causadora de doenças como o resfriado comum até doenças mais graves, como a Síndrome Respiratória do Oriente Médio (MERS) e a Síndrome Respiratória Aguda Grave (SARS).(2)
Trata-se de uma família de vírus de RNA que contém pelo menos 39 espécies em 27 subgêneros e é dividida em duas subfamílias: Orthocoronaviridae e Torovirinae. O novo coronavírus pertence à subfamília Orthocoronaviridae, e foi denominado pelo Comitê Internacional de Taxonomia de Vírus de SARS-CoV-2. A subfamília é ainda subdividida em quatro gêneros: a, b, g e d. Os a e b-CoV são capazes de infectar mamíferos, incluindo humanos, enquanto que g e d-CoV tendem a infectar aves.
O SARS-CoV-2 foi caracterizado como um bCoV, envelopado de RNA de fita simples (+ ssRNA), polaridade positiva e não segmentada, de aproximadamente 30 kb, sendo o maior genoma viral conhecido até o momento. O genoma do SARS-CoV-2 codifica 14 poliproteínas Open Reading Frames (ORF). Na extremidade 5′, a ORF1ab é o maior gene e está envolvido na codificação de 14 proteínas não estruturais. Na extremidade 3′ estão os genes das proteínas estruturais: E (envelope); M (membrana); N (nucleocapsídeo) necessário à síntese viral, S (Spike) e HE (hemaglutinina-esterase), que permite a entrada e a infecção da célula hospedeira (Figura 1A), além dos genes de proteínas acessórias (ORF3a, ORF6, ORF7a, ORF8 e ORF10).(2-5)
A ordem dos genes do SARS-CoV-2 é 5′-replicase ORF1ab-S-E-M-N-3′, ORF3ab, ORF6, ORF7ab, ORF8, ORF9ab e ORF10 e está demonstrada na Figura 1B como 1a, 1b, 3a, 3b, 6, 7a, 7b, 8, 9a, 9b, 10.(2)
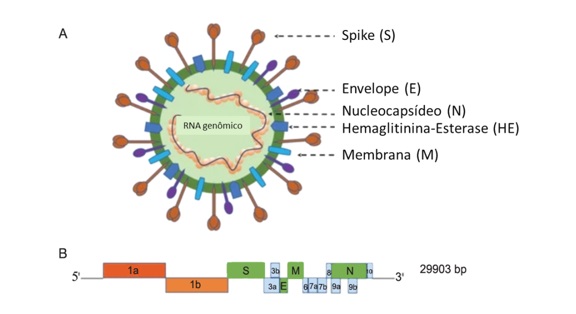
Figura 1. Representação esquemática da partícula viral e do genoma do b-Coronavírus. A: partícula viral; B: genoma viral.
Fonte: Jin Y, et al. 2020; adaptado.(2)
Todos os CoV humanos podem ser de origem zoonótica. Análises filogenéticas demonstraram que o nCoV compartilha 96% de identidade do seu genoma completo com um CoV de morcego, o BatCoV RaTG13, 99% com o genoma do Pangolin-CoV, 79% com o SARS-CoV e 50% com o MERS-CoV, sugerindo a transmissão para humanos após mutações.(2) As vias de transmissão do SARS-CoV-2 ocorrem principalmente por gotículas respiratórias e contato com objetos contendo partículas virais. Estudos que encontraram o vírus nas fezes de humanos infectados sugerem também a transmissão fecal-oral. Evidências sugerem que a proteína S do SARS-CoV-2 se liga à enzima conversora de angiotensina do tipo 2 humana com afinidade 10-20 vezes maior do que o SARS-CoV.(2-6)
Para a replicação viral, existe um tempo entre a adsorção do vírus nas células hospedeiras até a liberação do vírus, isto é, o SARS-CoV-2 não lisa as células. Após a saída da célula, o vírus é adsorvido nas células vizinhas e assim sucessivamente. Ainda não está claro o tempo de replicação viral. Também não está completamente elucidado o tempo da resposta imune e consequente do aparecimento de IgA, IgM e IgG no sangue.(7) A Figura 2 ilustra o período de detecção tanto do RNA viral quanto dos anticorpos contra o SARS-CoV-2.(8)
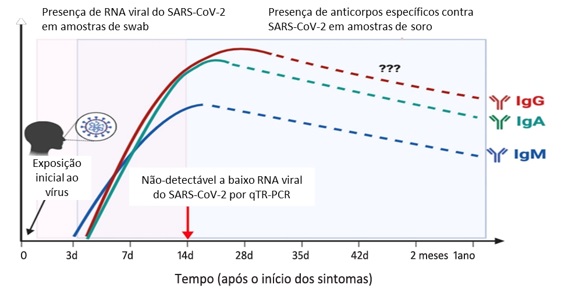
Figura 2. Representação esquemática do período de detecção do RNA viral e dos anticorpos em indivíduos infectados com o SARS-Cov-2.
Fonte: Lee CY-P, et al, 2020; adaptado.(8)
avírus, a SARS em 2002, na China, causando cerca de 8.422 infecções e 916 mortes, e a MERS, responsável por uma epidemia persistente na Península Arábica em 2012, com 862 mortes de 2.506 infectados. Ambas foram associadas às complicações graves do trato respiratório inferior e manifestações extrapulmonares como diarreia, linfopenia, síndrome de disfunção de múltiplos órgãos e taxas de mortalidade de 11% a 35%, respectivamente.(3,9,10) O período de incubação do SARS-CoV-2 foi relatado entre três e cinco dias,(6,11) e os sintomas surgem entre oito e 11,5 dias da infecção.(11) Os pacientes infectados com SARS-CoV-2 assintomáticos ou sintomáticos podem transmitir a doença, no entanto, aqueles com COVID-19 grave têm sido considerados com maior potencial de transmissão.(2)
O diagnóstico da COVID-19, sendo ainda uma doença nova, está alicerçado na clínica do paciente, nos exames de imagem e no diagnóstico laboratorial. Nessa revisão, nós apresentamos o método laboratorial da transcrição reversa seguida da reação em cadeia da polimerase em tempo real (RT-PCR) para diagnóstico do SARS-CoV-2, discutimos suas características de desempenho e destacamos as fragilidades da capacidade diagnóstica atual.
Diagnóstico laboratorial
Neste momento, o diagnóstico laboratorial exerce um papel fundamental tanto para o prognóstico e acompanhamento, bem como para estudos da epidemiologia molecular do SARS-CoV-2. O padrão ouro para isolamento do agente infeccioso da COVID-19, por se tratar de vírus, é a cultura em tecido. Porém, a cultura viral não é prática e leva pelo menos três dias para apresentar os efeitos citopáticos em linhagens celulares, como das células VeroE6. Ainda, esse método requer estrutura laboratorial com nível de biossegurança 3, o qual normalmente não está disponível nas instituições de saúde.(12)
Além disso, os relatos da China corroboram instruções do Centers for Disease Control and Prevention (CDC) e da OMS quanto à utilização da transcrição reversa seguida da reação em cadeia da polimerase em tempo real (RT-PCR) para o diagnóstico laboratorial do SARS-CoV-2.(4,13,14)
Ao contrário da sorologia, a RT-PCR fornece importantes informações nos estágios iniciais da infecção, pois pesquisa o patógeno diretamente por meio da detecção de seu ácido nucleico quando o objetivo é prevenir a transmissibilidade e os anticorpos ainda não foram produzidos. Permite, então, a detecção precoce e a diferenciação de outras viroses respiratórias, apresentando alta sensibilidade e especificidade, respectivamente.(14)
O método de RT-PCR pode ser caseiro (in house) ou comprado em conjuntos diagnósticos (kits). Há vários protocolos de RT-PCR publicados pela OMS e descritos pela China, Estados Unidos, CDC chinês e americano, Alemanha, Hong Kong, Tailândia e Japão. Vários exames foram rapidamente aprovados no Brasil, mas com qualidades diferentes. Até 17 de agosto de 2020, cinquenta empresas já haviam registrado, na Anvisa, kits diagnósticos de SARS-CoV-2 por RT-PCR em tempo real, incluído kits produzidos no Brasil. Desses, 23 têm registro padrão na Anvisa, ou seja, têm a concessão regular da validade de registro de produtos para saúde de 10 anos. Os outros 27 kits têm registro emergencial, ou seja, validade de um ano por não terem apresentado todas as informações necessárias, como a estabilidade. Dos cinquenta kits registrados no Brasil, apenas quatro buscam a amplificação de somente um alvo do genoma viral, a maioria (28) busca dois alvos, 16 buscam três alvos e dois buscam quatro alvos. Entre os genes mais pesquisados, a maioria (38) dos kits investiga o gene da proteína N, 24 da E, 24 o ORF1ab, 8 da proteína S, entre outros genes.(15)
Preparo da amostra e amplificação do material
genético viral
Tanto os kits quanto os métodos in house envolvem as mesmas etapas, que incluem: 1. Extração do RNA, 2. Transcrição reversa para obtenção do DNA complementar (cDNA) e 3. Reação em cadeia da polimerase em tempo real. A detecção da amplificação do material genético é realizada em tempo real pela medida da fluorescência emitida pelo fluoróforo. A seguir, descrevem-se as etapas:
- A extração do RNA normalmente é realizada com um tampão de lise contendo reagentes como isotiocianato de guanidina e Triton, tanto em extrações manuais e subsequente purificação em colunas quanto em extrações automatizadas.(16)Por outro lado, alguns estudos têm demonstrado eficiência semelhante de protocolos de RT-PCR que não realizam a extração do RNA, encurtando o tempo de diagnóstico.(4)
- Consiste na síntese de uma fita de DNA utilizando-se como molde (template) uma fita de RNA numa reação catalisada por uma enzima denominada transcriptase reversa. São utilizados primers inespecíficos, ou seja, oligonucleotídeos compostos por várias timinas consecutivas (6 a 35), que são anelados às regiões Poli-A (ou A-Rich) do RNA, ricas em adeninas. Após esta etapa de 10-15 minutos a 45-50°C, obtém-se o cDNA, que será utilizado na PCR. O round de transcrição reversa não altera o número de fitas de RNA ou DNA. Em seguida, a reação permanece por 3-10 minutos a 95°C para desnaturação da RT e do RNA, mas não do cDNA, e ativação da polimerase.(12,16,17)
- A amplificação (multiplicação) de trechos específicos do cDNA ocorre alternando-se a temperatura de ensaio entre: a) desnaturação das cadeias de RNA, mas não de cDNA; b) anelamento dos primers, usados para delimitar a sequência a ser amplificada; c) polimerização ou extensão; d) reinício do ciclo.(18)
De forma mais detalhada, a transcrição reversa é seguida pela fase de PCR, que consiste em uma etapa de desnaturação de 3-10 segundos a 95°C, durante a qual as fitas de DNA se separam em fitas simples, e uma etapa de hibridação/polimerização de 15-45 segundos a 55-60°C, durante a qual os iniciadores de amplificação (e sondas de detecção) hibridizam com os modelos de DNA de fita simples e permitem que a polimerase replique o modelo, criando DNA de fita dupla. Durante a polimerização bem-sucedida, a sonda é deslocada e hidrolisada, liberando a fluorescência. Este processo é repetido geralmente cerca de 40-45 vezes (ciclos). Uma corrida de RT-PCR em tempo real típica, conforme exemplificado aqui, é concluída em cerca de uma hora e trinta minutos.(12,16,19)
Entre os reagentes da PCR estão DNA polimerase, íons (Na+, Cl-, K+, entre outros) que otimizam as condições de reação. MgCl2 é um doador muito estável de íons Mg2+, que são cofatores indispensáveis para atividade da enzima DNA polimerase. Alguns tampões contêm ainda detergentes que inibem a formação de dímeros das cadeias enzimáticas, proteínas estabilizantes (albumina sérica bovina) e algumas substâncias que agem na desnaturação da cadeia molde de DNA (Ditiotreitol, b-mercaptanoetanol), quebrando as pontes de hidrogênio entre as bases. Os desoxinucleotídeos são a matéria-prima propriamente dita para a síntese das cópias de DNA, são compostos por nucleotídeos (ATP, TTP, CTP, GTP) desoxilados no carbono 5´ da desoxirribose. São adicionados pela polimerase complementarmente à fita-mãe numa área delimitada pelos primers, que são pequenas sequências de DNA (12 a 35 bases).(18)
Diferentemente da PCR convencional, onde os resultados das reações são normalmente visualizados em padrões de bandas obtidos por eletroforese, no método de RT-PCR em tempo real utilizam-se primers e dNTPs marcados por compostos fluorescentes. A emissão e detecção de fluorescência ocorrem durante a reação de PCR. Uma fluorescência mínima (eixo y) da fase exponencial de amplificação gênica corresponde ao threshold, ou cut-off, que é traçado horizontalmente no gráfico, e é utilizado para calcular o limite de ciclo (CT) de cada amostra. O CT corresponde ao número de ciclos de PCR necessários para o início da amplificação, ou seja, o momento em que a fluorescência emitida ultrapassa a linha do limite. Dessa forma, o CT tem relação inversamente proporcional à quantidade de sequência alvo presente na amostra. O diferencial da RT-PCR em tempo real, no entanto, é a utilização de termocicladores especiais que, além de realizar os ciclos de temperatura, possuem leitores de fluorescência que fornecem dados sobre a quantidade de DNA formada durante a reação. Cada nucleotídeo fluoresce em um determinado comprimento de onda que é captado pelo leitor do termociclador e os dados são analisados por um programa.(20) Os resultados são gráficos como o da Figura 3.
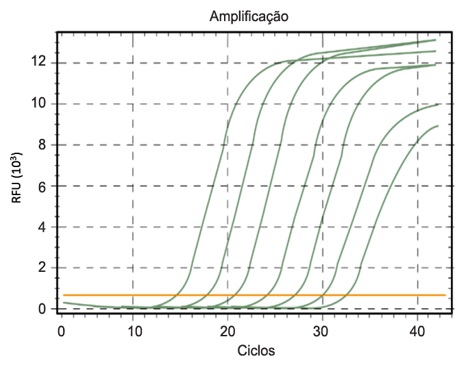
Figura 3. Gráfico de quantificação de produtos de PCR em termociclador do tipo tempo real. O gráfico mostra quantidades absolutas
(unidade relativa de fluorescência – RFU) de DNA em função do número de ciclos.
Fonte: Viasure SARS-CoV-2 Real Time PCR Detection Kit, 2020; adaptado.(21)
Um CT menor do que 35 tem sido considerado como vírus detectado (positivo) e maior do que 40 vírus não detectado (negativo). Entre 35 e 40 necessita de confirmação.(19,22) Quando dois alvos, por exemplo, gene da proteína N e ORF1ab, ou E e S, ou S e RdRp (gene da RNA polimerase dependente de RNA), ou outras combinações são detectadas, o SARS-CoV-2 deve ser considerado detectado pelo laboratório.(22) Quando, de dois, apenas um alvo é detectado recomenda-se a repetição do exame e assim é recomendada a amplificação de vários genes alvo.(13)
A etapa mais demorada do exame diagnóstico é a extração de RNA, no entanto, já há automação que extrai até 96 amostras por hora. A maioria dos equipamentos de PCR em tempo real realiza 96 análises simultaneamente, mas há equipamentos que analisam de 48 a 1.536 amostras em uma única corrida analítica.(16)
Um controle interno negativo (intratubo) deve ser utilizado, o qual não apresentará crescimento na curva de fluorescência. Um controle interno positivo também deve ser utilizado.(13) RNA genômico ou transcrito in vitro não são recomendados para controle interno devido à baixa estabilidade.(23)
Embora estejamos em um período de emergência, há a necessidade urgente de procedimentos de validação e verificação dos métodos de RT-PCR em tempo real nos laboratórios. Para tal, as amostras devem ter a mesma matriz daquelas que serão analisadas. No mínimo dez amostras negativas (preferencialmente anteriores à pandemia) e dez amostras controle comerciais ou amostras residuais de pacientes infectados pelo SARS-CoV-2 devem ser utilizadas para avaliar se a performance atende à precisão e exatidão dos resultados descrita nas instruções do fabricante.(23)
Amostras clínicas
O diagnóstico do SARS-CoV-2 pode ser realizado em uma variedade de amostras clínicas, incluindo lavado broncoalveolar, biópsia pulmonar, escarro, esfregaço (swab) nasofaríngeo, esfregaço orofaríngeo, fezes, urina, sangue e até saliva.(14,24,25) Os estudos têm relatado que o lavado broncoalveolar é a melhor amostra, no entanto, a coleta não é prática.(22-24,26) O escarro também é uma ótima amostra para o diagnóstico laboratorial da COVID-19, seguida dos swabs nasofaríngeo e orofaríngeo.(13,22,26) Contudo, este último tem sido pouco recomendado e os autores não destacaram que na COVID-19 a tosse normalmente não é produtiva, o que também dificulta a coleta do escarro. Por fim, a amostra que tem apresentado mais praticidade e precisão é a de swab da nasofaringe.(14,19,24,25) Entretanto, cabe destacar o risco de transmissão do SARS-CoV-2 aos profissionais de saúde durante a coleta de amostras do trato respiratório, especialmente do inferior.(25) Para evitar inconsistências, os autores sugerem analisar diferentes amostras simultaneamente,(26) o que aumenta os custos do diagnóstico laboratorial da COVID-19.
Como o intervalo de tempo para o pico da carga viral na COVID-19 ainda é desconhecido, o tempo ótimo para a coleta das amostras biológicas para o diagnóstico da infecção não foi estabelecido.(13) Um estudo retrospectivo em Wuhan com 301 pacientes com COVID-19 e 1.113 resultados de RT-PCR indicou a mediana de 16 dias entre o início dos sintomas e o primeiro resultado positivo.(19) Porém, tem sido recomendada a coleta até sete dias a partir do início dos sintomas para obtenção de resultados mais confiáveis.(27) A Figura 4 apresenta a taxa de positividade da RT-PCR para SARS-CoV-2 a partir do início dos sintomas.(19)
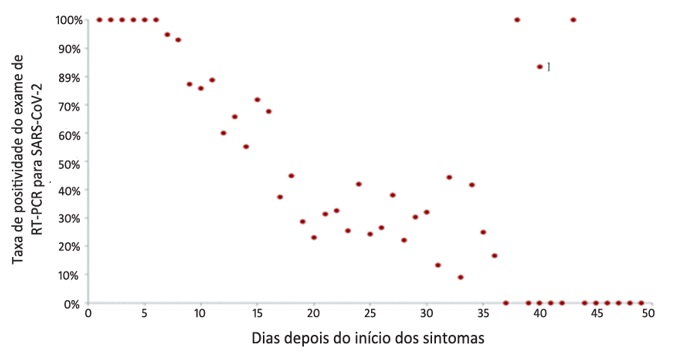
Figura 4. Taxa de positividade da RT-PCR para SARS-CoV-2 a partir do início dos sintomas.
Fonte: Xiao AT, et al, 2020; adaptado.(19)
De acordo com a história natural da COVID-19 e a cinética viral diferente entre os sítios anatômicos, a amostragem contribui para resultados falso negativos. Por exemplo, os swabs utilizados devem ser de poliéster ou dacron.(13) Resultados falso negativos também podem ser gerados por presença de inibidores de amplificação na amostra, pouca quantidade de vírus, coleta ou manuseio inadequados da amostra e longo tempo de transporte.(13,16)
Um estudo chinês descreveu que 3% de 167 pacientes com evidência de COVID-19 na tomografia de tórax inicialmente apresentaram RT-PCR negativa. Posteriormente, o swab de todos os pacientes converteu a RT-PCR positivo em um intervalo médio de cinco a sete dias.(28) Outro estudo publicado com uma série de casos demonstrou que os resultados de pacientes com coletas de swab de orofaringe e nasofaringe em diferentes momentos variou ao longo do tempo. Foram observados casos de pacientes com o vírus detectado em um dia e não detectado em amostra coletada em outro dia, e que apresentaram o vírus detectado novamente em uma terceira amostra.(29) Portanto, eventualmente, a coleta de múltiplas amostras, de locais e tempo diferentes durante a evolução da doença, pode ser necessária para o diagnóstico da COVID-19.
Ainda, para evitar a degradação do RNA viral na amostra e garantir o desempenho da RT-PCR em tempo real, após a coleta de swab, a amostra deve ser imersa em um meio de transporte, ou tampão de lise ou solução salina estéril. As amostras devem ser armazenadas entre 2°C e 8°C por até 72 horas depois da coleta. Caso o exame não seja realizado nesse curto período de tempo, a amostra deve ser armazenada pelo menos a -70°C.(4)
Interpretação
Um resultado positivo para SARS-CoV-2 apresenta elevado valor preditivo positivo e confirma o diagnóstico de COVID-19, mesmo sem sintomatologia. Mitchell et al.(23) propuseram o seguinte comentário para laudos com resultados de SARS-CoV-2 não detectado: “Esse exame foi realizado para detectar os genes “X” e “Y” do SARS-CoV-2 pelo método de amplificação do ácido nucleico. Um resultado não detectado não exclui a possibilidade de infecção pelo SARS-CoV-2, uma vez que a coleta inadequada da amostra e a baixa carga viral podem resultar na presença de ácido nucleico viral abaixo da sensibilidade analítica.”
Portanto, um único resultado não detectado na RT-PCR para SARS-CoV-2 em paciente sintomático não exclui o diagnóstico da COVID-19, possui baixo valor preditivo negativo e a retestagem pode ser considerada.(13,14) Dois resultados negativos em 24 horas indicam a cura da COVID-19,(30) no entanto, esse protocolo não é recomendado, pois não altera a conduta clínica caso ainda haja sinais e sintomas. A clínica continua soberana e os exames são complementares.
Vários fatores como coleta inadequada da amostra, tipo de amostra biológica, tempo decorrido entre a coleta e o início dos sintomas, e insuficiente ou oscilação da carga viral podem influenciar o resultado do exame.(29) Sempre que houver discordância com o quadro clínico epidemiológico, o exame de RT-PCR deve ser repetido em outra amostra do trato respiratório. A sensibilidade do método RT-PCR é variável entre diferentes amostras biológicas para detecção do SARS-CoV-2. Um estudo que avaliou 1.070 amostras de 250 pacientes com COVID-19 observou os seguintes valores de sensibilidade para as diferentes amostras testadas por RT-PCR: lavado broncoalveolar 93%, escarro 72%, swab nasal 63%, swab de orofaringe 32%, fezes 29%, sangue 1% e urina 0%.(31)
Uma revisão encontrou substancial variação sobre o período de infecção. O período mediano de casos assintomáticos foi de 6,5-9,5 dias. O período pré-sintomático variou de 1-4 dias entre os estudos. O tempo médio entre o início dos sintomas e dois resultados de SARS-CoV-2 não detectados foi de 13,4 dias, mas esse período é menor se incluídos casos menos graves e crianças. A duração média estimada entre o início dos sintomas e a alta hospitalar foi de 14,1 dias.(30)
Em pacientes moderada e severamente afetados pela COVID-19 foi estimada a detecção do RNA viral de SARS-CoV-2 em amostras de swab de nasofaringe e de fezes por 45 e 49 dias depois do início dos sintomas, respectivamente.(32) Assim, é importante destacar que a persistência do exame positivo não significa necessariamente que o paciente ainda esteja infectado. O período em que os pacientes permanecem infectantes ainda não está totalmente esclarecido e a utilização dos resultados dos exames para liberação do paciente do isolamento respiratório deve ser avaliada criteriosamente.
Evidências recentes mostram que a eficiência diagnóstica de muitos dos kits comerciais de RT-PCR em tempo real para SARS-CoV-2 pode ser menor do que a ideal, ou seja, <100%.(13) Um grande estudo na China demonstrou até 41% de falso negativos nos resultados, com relatos de indivíduos com falso negativos por até duas semanas. Tal fato prejudica a contenção da pandemia, visto que esses indivíduos continuam transmitindo a doença por desconhecê-la.(14)
Desafios do diagnóstico molecular
A RT-PCR pode ser operada em larga escala e os resultados estão geralmente disponíveis dentro de algumas horas a dois dias.(14) No entanto, a falta de reagentes no mercado e a alta demanda de amostras têm causado sobrecarga aos laboratórios e atraso na liberação de resultados.
Considerando a morosidade de uma RT-PCR em tempo real, uma alternativa de exame molecular é a amplificação isotérmica mediada por alça (LAMP) também precedida de transcrição reversa. Esse método não envolve diferentes temperaturas e então pode ser realizado em equipamentos menos sofisticados, possibilitando que o exame seja realizado fora do laboratório como teste laboratorial remoto (point of care testing). Normalmente utiliza-se a LAMP com quatro a seis genes alvo para garantir a sensibilidade e especificidade sob condição isotérmica a 63°C-65°C. O método é menos sensível a inibidores, pode ser realizado com amostras minimamente extraídas e o tempo de análise é menor, entre 30-40 minutos.(5,16,17,33) Nenhum exame desse tipo foi registrado na Anvisa até o momento.
Contudo, as técnicas moleculares exigem pessoal com conhecimento e treinamento técnico especializado para operar sofisticados instrumentos,(17,25) são de alto custo,(4) e o laboratório deve atender aos requisitos de nível 2 ou mais de biossegurança.(14,34)
Até o momento, vários protocolos de RT-PCR para detecção do SARS-CoV-2 com diferentes eficiências de detecção foram publicados.(25) As diferentes performances podem estar associadas a protocolos variados ou à estrutura secundária do RNA viral ou à sua estabilidade.(16)
No Brasil, as primeiras avaliações dos métodos de RT-PCR identificaram divergências de resultados entre marcas, alvos genéticos, protocolos, pontos de corte e laboratórios. Em uma rodada de controle externo da qualidade com 39 laboratórios participantes, 5,1% de resultados falso positivos foram observados em métodos in house e 10,3% de resultados falso negativos em kits comerciais. Para a amostra definida previamente como reagente, nenhum laboratório relatou resultado como inconclusivo. No entanto, para a amostra definida previamente como não reagente, os métodos in house apresentaram 7,7% dos resultados como inconclusivos. Dos 27 laboratórios que utilizaram método in house, 7,4% apresentaram resultados falso positivos, 7% falso negativos e 11% inconclusivos quando a amostra era reagente. Entre os kits comerciais não foi verificado falso positivo, no entanto, houve 33% de falso negativos.(35)
Além disso, o Instituto Nacional de Controle da Qualidade em Saúde (INCQS) também tem feito um monitoramento pós-mercado da qualidade de dispositivos para diagnóstico in vitro da COVID-19 por meio de análises laboratoriais. Entre os poucos exames moleculares avaliados até o momento, todos estavam em conformidade.(36)
A Sociedade Brasileira de Análises Clínicas junto com outras sociedades científicas também se uniram para avaliar kits de diagnóstico para SARS-Cov-2 disponíveis no mercado brasileiro. Apenas cinco de RT-PCR foram avaliados até o momento, e destes apenas um não apresentou resultados compatíveis com o especificado pelo fabricante.(37)
Embora erros diagnósticos sempre tenham ocorrido de forma individualizada, as suas consequências amplificam junto com a pandemia da COVID-19. Um resultado falso positivo não só leva a tratamento desnecessário, mas pode causar problemas sociais, pois pode prejudicar a força de trabalho disponível para enfrentar esta pandemia se atribuído a profissional de saúde. No entanto, um resultado falso negativo pode contribuir potencialmente para uma maior disseminação do SARS-CoV-2 na comunidade.(13,14)
Os erros analíticos específicos da RT-PCR podem envolver um mau funcionamento do equipamento, ensaios não validados de forma adequada, falha não detectada pelo controle da qualidade, variação na sequência do RNA viral (até 15 de fevereiro de 2020, 104 cepas já haviam sido identificadas), exame realizado fora da janela diagnóstica, má harmonização de primers ou sondas e anelamento não específico, qualidade dos reagentes utilizados e outros problemas técnicos.(13,14)
Ensaios moleculares podem ser inibidos por substâncias presentes no material biológico, caso estes sejam coextraídos com os ácidos nucleicos. Esses inibidores interferem diretamente nas reações enzimáticas, o que diminui a sensibilidade dos exames, podendo até mesmo promover resultados falso negativos. Substâncias inibidoras de PCR como IgG, hemoglobina e lactoferrina podem ser coextraídas do sangue, soro ou plasma. Hormônios e antivirais (aciclovir) também podem afetar a amplificação. O componente mais crítico da urina é a ureia, que degrada as polimerases. Polissacarídeos, sais e ácidos biliares e glicolipídios coextraídos das fezes também são descritos como inibidores. Os inibidores podem ser também introduzidos na amostra durante a fase pré-analítica e/ou purificação dos ácidos nucleicos, o que inclui pó das luvas, sais (cloreto de sódio e cloreto de potássio), detergentes (SDS) e moléculas orgânicas (etanol, isopropanol e fenol).(38)
Considerações finais
O SARS-CoV-2 trouxe um grande desafio para a ciência, bem como para os pacientes, médicos e laboratórios. O diagnóstico laboratorial, o tratamento e vacinas têm sido desenvolvidos principalmente em outros países por terem experienciado a circulação do vírus primeiro. Ainda, a cada dia uma batalha da guerra contra a COVID-19 é vencida. Demonstrando a importância da medicina laboratorial, a pandemia tem destacado o valor das tecnologias já disponíveis para diagnósticos cada vez mais rápidos e também para a produção de vacinas. Lacunas diagnósticas ainda permanecem na triagem de pessoas assintomáticas que estão na fase de incubação do vírus, bem como na detecção da eliminação de vírus vivos durante a convalescença para auxiliar na orientação de flexibilização ou encerramento de isolamento social.
Abstract
The diagnosis of COVID-19 is based on the patient’s clinic, imaging tests and laboratory diagnosis. The detection of viral nucleic acid by reverse transcription (RT) followed by real-time polymerase chain reaction (PCR) was quickly the first established laboratory diagnosis method and remains the gold standard. This descriptive narrative is a result of a referenced search where the focal point was to describe the laboratory diagnosis of SARS-CoV-2 by RT-PCR. The laboratory diagnosis of SARS-CoV-2 by RT-PCR involves the RNA extraction, reverse transcription to obtain complementary DNA, and the polymerase chain reaction steps. The detection of genetic material amplification is carried out by measuring the emitted fluorescence. Among the various biological samples that can be used, the one that has shown the most practicality and precision is the nasopharyngeal swab. Sample collection should be performed, ideally, within 7 days from the symptoms onset. When SARS-CoV-2 is detected by RT-PCR, the diagnosis of COVID-19 is confirmed. However, a single result of undetected SARS-CoV-2 in a symptomatic patient does not exclude the diagnosis. The test has not shown cross-reactions with common respiratory pathogens. However, the test is costly and time-consuming, a false-negative result may arise due to inadequate sample collection time, improper samples collection and handling, and insufficient viral genetic material at the collection site. Diagnosticgaps remain on asymptomatic patients screening, and in the detection of live viruses in convalescence.
Keywords
SARS-CoV-2; COVID-19; laboratory diagnosis; real time RT-PCR; molecular diagnosis
REFERÊNCIAS
- Brasil. Ministério da Saúde. Coronavírus: o que você precisa saber e como prevenir o contágio. [Acesso em 01 de set de 2020]. Disponível em: https://coronavirus.saude.gov.br/
- Jin Y, Yang H, Ji W, Wu W, Chen S, Zhang W, et al. Virology, Epidemiology, Pathogenesis, and Control of COVID-19. Viruses. 2020;12,372. doi:10.3390/v12040372
- Li G, Fan Y, Lai Y, Han T, Li Z, Zhou P, et al. Coronavirus infections and immune responses. J Med Virol. 2020;92(4):424-432. doi: 10.1002/jmv.25685.
- Oliveira BA, Oliveira LC, Sabino EC, Oka TS. SARS-CoV-2 and the COVID-19 disease: a mini review on diagnostic methods. Rev Inst Med Trop São Paulo. 2020; 62:e44. doi: 10.1590/s1678-99462020 62044
- Ortiz-Prado E, Simbaña-Rivera K, Gómez-Barreno L, Rubio-Neira M, Guaman LP, Kyriakidis NC, et al. Clinical, molecular, and epidemiological characterization of the SARS-CoV-2 virus and the Coronavirus Disease 2019 (COVID-19), a comprehensive literature review. Diagn Microbiol Infect Dis. 2020;98(1):115094. doi:10.1016/j.diagmicrobio.2020.115094
- Chan KW, Wong VT, Tang SCW. COVID-19: An Update on the Epidemiological, Clinical, Preventive and Therapeutic Evidence and Guidelines of Integrative Chinese-Western Medicine for the Management of 2019 Novel Coronavirus Disease. Am J Chin Med. 2020;48(3):737-762. doi:10.1142/S0192415X20500378
- Menezes ME. Diagnóstico laboratorial do coronavírus (SARS-CoV-2) causador da COVID-19. COVID-19, Informes Técnicos 30 de março de 2020. [Acesso em 02 de set de 2020]. Disponível em: https://www.sbac.org.br/blog/2020/03/30/diagnostico-laboratorial-do-coronavirus-sars-cov-2-causador-da-covid-19/
- Lee CY-P, Lin RTP, Renia L, Ng LFP. Serological Approaches for COVID-19: Epidemiologic Perspective on Surveillance and Control. Front. Immunol. 2020;11. doi: 10.3389/fimmu.2020.00879
- Ashour HM, Elkhatib WF, Rahman MM, Elshabrawy HA. Insights into the Recent 2019 Novel Coronavirus (SARS-CoV-2) in Light of Past Human Coronavirus Outbreaks. Pathogens. 2020;9(3):186. doi: 10.3390/pathogens9030186.
- Bertolini D. COVID-19. Sociedade Brasileira de Análises Clínicas. COVID-19, Informes Técnicos 6 de abril de 2020. [Acesso em 02 de set de 2020]. Disponível em: https://www.sbac.org.br/blog/2020/04/06/covid-19/
- Lauer SA, Grantz KH, Bi Q, Jones FK, Zheng Q, Meredith HR, et al. The Incubation Period of Coronavirus Disease 2019 (COVID-19) From Publicly Reported Confirmed Cases: Estimation and Application. Ann Intern Med. 2020;172(9):577-582. doi: 10.7326/M20-0504.
- Chan JF, Yip CC, To KK, Tang TH, Wong SC, Leung KH, et al. Improved Molecular Diagnosis of COVID-19 by the Novel, Highly Sensitive and Specific COVID-19-RdRp/Hel Real-Time Reverse Transcription-PCR Assay Validated In Vitro and with Clinical Specimens. J Clin Microbiol. 2020;58(5):e00310-20. doi: 10.1128/JCM.00310-20.
- Tahamtan A, Ardebili A. Real-time RT-PCR in COVID-19 detection: issues affecting the results. Expert Rev Mol Diagn. 2020;20(5),453-454. doi: 10.1080/14737159.2020.1757437
- Younes N, Al-Sadeq DW, Al-Jighefee H, Younes S, Al-Jamal O, Daas HI, et al. Challenges in Laboratory Diagnosis of the Novel Coronavirus SARS-CoV-2. Viruses.2020; 12(6), 582. doi: 10.3390/v12060582
- Agência Nacional de Vigilância Sanitária (Anvisa). Produtos para diagnóstico in vitro de COVID-19 regularizados [Acesso em 17 de ago de 2020]. Disponível em http://portal.anvisa.gov.br/informacoes-tecnicas13/-/asset_publisher/WvKKx2fhdjM2/content/prioridade-de-analise-em-situacoes-de-aumento-da-seguranca-de-uso-dos-produt-1/33912?redirect=/produtos-para-a-saude&inheritRedirect=true.
- Bustin SA, Nolan T. RT-qPCR Testing of SARS-CoV-2: A Primer. Intl J Mol Sci. 2020; 21(8), 3004. doi: 10.3390/ijms21083004.
- Lu R, Wu X, Wan Z, Li Y, Jin X, Zhang C. A Novel Reverse Transcription Loop-Mediated Isothermal Amplification Method for Rapid Detection of SARS-CoV-2.Int J Mol Sci. 2020;18;21(8):2826. doi: 10.3390/ijms21082826.
- Vieira DP. Técnicas de PCR: Aplicações e Padronização de Reações. São Paulo:2011 [Acesso em 10 de ago de 2020]. Disponível em: http://www.imt.usp.br/wp-content/uploads/proto/protocolos/aula1.pdf.
- Xiao AT, Tong YX, Gao C, Zhu L, Zhang YJ, Zhang S. Dynamic profile of RT-PCR findings from 301 COVID-19 patients in Wuhan, China: A descriptive study. J Clin Virol. 2020;127:104346. doi: 10.1016/j.jcv.2020.104346.
- Vieira DP. Técnicas de PCR: Aplicações e Padronização de Reações. São Paulo:2011 [Acesso em 10 de ago de 2020].Disponível em: http://www.imt.usp.br/wp-content/uploads/proto/protocolos/aula3.pdf.
- Viasure SARS-CoV-2 Real Time PCR Detection Kit. Kabbla clinical DX [Acesso em 02 de set de 2020]. Disponível em: https:// kabla.mx/pruebasespeciales/biologia-molecular/sars-cov-2-coronavirus-viasure/
- Liu R, Huan H, Liu F, Lv Z, Wu K, Liu Y, et al. Positive rate of RT-PCR detection of SARS-CoV-2 infection in 4880 cases from one hospital in Wuhan, China, from Jan to Feb 2020. Clin Chim Acta. 2020; 505:172-175. doi: 10.1016/j.cca.2020.03.009
- Mitchell SL, Georg KS, Rhoads DD, Butler-Wu SM, Dharmarha V, McNult P, et al. Understanding, Verifying, and Implementing Emergency Use Authorization Molecular Diagnostics for the Detection of SARS-CoV-2 RNA. J Clin Microbiol.2020;58(8), e00796-20. doi: 10.1128/JCM.00796-20
- Bwire GM, Majigo MV, Njiro BJ, Mawazo A. Detection profile of SARS-CoV-2 using RT-PCR in different types of clinical specimens: A systematic review and meta-analysis. J Med Virol. 2020. doi: 10.1002/jmv.26349.
- Li C, Ren L. Recent progress on the diagnosis of 2019 Novel Coronavirus. Transbound Emerg Dis. 2020;67(4):1485-1491. doi: 10.1111/tbed.13620.
- Yang Y, Yang M, Shen C, Wang F, Yuan J, Li J, et al. Laboratory diagnosis and monitoring the viral shedding of 2019-nCoV infections. MedRxiv preprint. 2020. doi:10.1101/2020.02.11.20021493
- Sociedade Brasileira de Patologia Clínica/Medicina Laboratorial. Recomendações da Sociedade Brasileira de Patologia Clínica/Medicina Laboratorial. Métodos Laboratoriais para Diagnóstico da Infecção pelo SARS-CoV-2. [Acesso em 10 de ago de 2020]. Disponível em: http://www.sbpc.org.br/wp-content/uploads/2020/04/MetodosLaboratoriaisDiagnosticoSARS-CoV-2.pdf
- Xie X, Zhong Z, Zhao W, Zheng C, Wang F, Liu J. Chest CT for Typical Coronavirus Disease 2019 (COVID-19) Pneumonia: Relationship to Negative RT-PCR Testing. Radiology. 2020; 296(2), E41-E45. doi: 10.1148/radiol.2020200343
- Li Y, Yao L, Li J, Chen L, Song Y, Cai Z, et al. Stability issues of RT-PCR testing of SARS-CoV-2 for hospitalized patients clinically diagnosed with COVID-19.J Med Virol. 2020;92(7):903-908. doi: 10.1002/jmv.25786.
- Byrne AW, McEvoy D, Collins AB, Hunt K, Casey M, Barber A, et al. Inferred duration of infectious period of SARS-CoV-2: rapid scoping review and analysis of available evidence for asymptomatic and symptomatic COVID-19 cases. BMJ Open. 2020;10(8)039856. doi:10.1136/bmjopen-2020-039856
- Wang W, Xu Y, Gao R, Lu R, Han K, Wu G, et al. Detection of SARS-CoV-2 in Different Types of Clinical Specimens. JAMA. 2020; 323(18), 1843-1844. doi: 10.1001/jama.2020.3786
- Sun J, Xiao J, Sun R, Tang X, Liang C, Lin H, et al. Prolonged Persistence of SARS-CoV-2 RNA in Body Fluids. Emerg Infect Dis. 2020; 26(8), 1834-1838. doi: 10.3201/eid2608.201097
- Yan C, Cui J, Huang L, Du B, Chen L, Xue G, et al. Rapid and visual detection of 2019 novel coronavirus (SARS-CoV-2) by a reverse transcription loop-mediated isothermal amplification assay. Clin Microbiol Infect. 2020;26(6):773-779. doi: 10.1016/j.cmi. 2020.04.001.
- Organização Pan Americana de Saúde (Brasil). Orientações de biossegurança laboratorial relativa à doença do coronavírus (COVID-19). Orientação provisória 19 de março de 2020.
- ControlLab. Sociedade Brasileira de Patologia Clínica/Medicina Laboratorial. Primeira avaliação de ensaio de proficiência pioneiro para todos os métodos de detecção do SARS-CoV2. [Acesso em 17 de ago de 2020]. Disponível em https://controllab.com/ destaques/2020/arquivos/Relatorio_EP_SARSCOV2.pdf.
- Instituto Nacional de Controle da Qualidade em Saúde (INCQS). Monitoramento pós-mercado da qualidade de dispositivos para diagnóstico in vitro da COVID-19: análises laboratoriais [Acesso em 17 de ago de 2020]. Disponível em https://app. powerbi.com/view?r=eyJrIjoiZjQzMDE0NGUtN2M4Yi00NTZiLTliN2MtMzA2YTZkMjcyNDRhIiwidCI6ImI2N2FmMjNmLWMzZjMtNGQzNS 04MGM3LWI3MDg1ZjVlZGQ4MSJ9.
- Teste COVID 19. Programa de avaliação de kits de diagnóstico para SARS-CoV-2. [Acesso em 17 de ago de 2020]. Disponível em https: //testecovid19.org/avaliacoes/
- Sociedade Brasileira de Patologia Clínica/Medicina Laboratorial. Recomendações da sociedade brasileira de patologia clínica/medicina
laboratorial: fatores pré-analíticos e interferentes em ensaios laboratoriais. 1. ed. Barueri, SP: Manole; 2018.
Correspondência
Maria Elizabeth Menezes
Laboratório DNA Análises
Av. Trompowski, 299 – Centro
Florianópolis-SC, Brasil
