Avanços e perspectivas no diagnóstico molecular da leucemia mieloide aguda: revisão sistemática
Advances and perspectives in the molecular diagnosis of acute myeloid leukemia: systematic review
Flávia Martins da Silva1
Rogério Reis Conceição2
1 Mestre em Ciências de Alimentos com ênfase em Microbiologia e Biologia Molecular pela Universidade Federal da Bahia; Especialista em Análises Clínicas e Gestão Laboratorial pela Escola Bahiana de Medicina e Saúde Pública.
2 Mestre em Imunologia pela Universidade Federal da Bahia.
Instituição: Escola Bahiana de Medicina e Saúde Pública. Salvador, BA, Brasil.
Recebido em 27/06/2021
Aprovado em 15/07/2021
DOI: 10.21877/2448-3877.202102161
INTRODUÇÃO
A leucemia mieloide aguda (LMA) é uma doença agressiva de malignidade hematológica caracterizada por anormal proliferação e diferenciação de células mieloides imaturas.(1) A LMA é uma das neoplasias mais frequentes, complexas e heterogêneas. O prognóstico depende muito das anormalidades citogenéticas, epigenéticas e moleculares adquiridas. Apesar dos avanços na compreensão da biologia da LMA, as taxas de sobrevida permanecem bastante baixas.(2)
Na maioria dos pacientes, os fatores que podem desencadear LMA ainda são desconhecidos, mas a origem genética está fortemente associada. Fatores ambientais, incluindo exposição a produtos químicos, como benzeno, também podem estar associados à LMA. Pacientes com história de síndromes mielodisplásicas (SMD) ou neoplasias mieloproliferativas (NMP) e aqueles que receberam radiação e/ou quimioterapia anteriormente também apresentam risco de desenvolver a doença.(3)
Todas as neoplasias mieloides são consideradas doenças clonais decorrentes de células-tronco hematopoiéticas. A LMA é diagnosticada como uma doença de apresentação aguda com mais 20% da medula óssea ou blastos mieloides circulantes, e os subgrupos como doenças crônicas. As síndromes mielodisplásicas são consideradas distúrbios pré-leucêmicos, caracterizados por hematopoiese ineficaz, citopenias, frequentemente com anormalidades citogenéticas clonais detectadas, com menos 20% de blastos de medula óssea e uma propensão para progressão secundária para LMA (LMA secundária).(4)
Existem cerca de 20.000 novos casos de LMA diagnosticados a cada ano nos Estados Unidos. Segundo o Instituto Nacional do Câncer (INCA), no Brasil a incidência de LMA é desconhecida, uma vez que o INCA relata apenas dados referentes às leucemias em geral. Os dados correspondem somente ao risco estimado de 5,67 casos novos a cada 100 mil homens e 4,56 casos novos para cada 100 mil mulheres em 2020.(5)
A LMA pode afetar pessoas de todas as idades, mas é muito mais comum em adultos mais velhos, com a incidência maior para aqueles com 65 ou mais anos de idade sendo 20,1%. A idade média no diagnóstico é de 68 anos e é mais frequentemente diagnosticada entre pessoas com idade entre 65 e 74 anos. Além disso, a incidência é maior em homens em comparação com as mulheres.(6)
Durante os últimos anos, houve um grande progresso na compreensão da patogênese da doença e no desenvolvimento de ensaios diagnósticos e novas terapias. Apesar dos grandes avanços na identificação de marcadores clinicamente relevantes para o diagnóstico, prognóstico e monitoramento da doença, ainda existem vários fatores genéticos que precisam ser aprofundados para otimizar o diagnóstico.(7)
O diagnóstico e a classificação das neoplasias mieloides foram descritos na classificação revisada da Organização Mundial da Saúde (OMS) de neoplasias hematopoiéticas, publicada em 2008. De acordo com a classificação, as entidades patológicas são definidas por uma combinação de características clínicas, morfológicas, imunofenotípicas e genéticas.(8) Revisada em 2016, as categorias de LMA mostraram avanços significativos no panorama genético e molecular. Os perfis moleculares no diagnóstico, remissão e acompanhamento podem se transformar em um padrão de atendimento, utilizando perfis mutagênicos, em vez de testes de um único gene.(7)
A inclusão sucessiva de novas alterações moleculares modificou substancialmente a classificação e a compreensão da LMA na última década. Contudo, as tecnologias de sequenciamento de nova geração (NGS) auxiliaram na acelerada descoberta de novas alterações moleculares. O NGS foi utilizado com sucesso em vários estudos e forneceu uma visão geral das mutações moleculares, bem como da evolução clonal da LMA. O amplo espectro de anormalidades descobertas por tecnologia de sequenciamento de nova geração está atualmente sob extensa validação de seus valores prognósticos e terapêuticos.
No entanto, esses grandes avanços moleculares no diagnóstico parecem promissores para terapia personalizada individualmente para pacientes com uma categoria de doença maligna caracterizada por extrema heterogeneidade molecular, como LMA.(9,10) A avaliação do perfil genético no momento do diagnóstico, como também na recidiva, é de extrema importância. Considerando o aqui exposto, o presente estudo realizou uma revisão sistemática da literatura sobre avanços no diagnóstico na leucemia mieloide aguda através das técnicas de biologia molecular.
METODOLOGIA
Foi realizada uma revisão sistemática da literatura sobre os avanços no diagnóstico na leucemia mieloide aguda através das técnicas de biologia molecular. O trabalho foi realizado no período de novembro de 2020 a 2021.
A estratégia de busca para a elaboração da revisão sistemática foi através do protocolo Prisma utilizando artigos científicos do portal de buscas PubMed, NCBI, BVSMS e também SciELO. A busca foi realizada mediante a consulta aos seguintes descritores: “leucemia” (leukemia) e “diagnóstico” (diagnostic), junto de suas combinações.
Os artigos inicialmente foram selecionados de acordo com o título e resumo. Em seguida foram aplicados os critérios de inclusão e exclusão e, por fim, foi feita a leitura completa dos artigos selecionados, conforme Figura 1. Como critério de inclusão, foram selecionados os textos completos, estudos escritos em inglês, que tivessem abordagem em diagnóstico para leucemia mieloide aguda. Os trabalhos excluídos foram aqueles que não tinham relação com a leucemia mieloide aguda ou faziam avaliação de tratamento medicamentoso. Após a leitura dos artigos selecionados, foram extraídas as informações relevantes que respondiam ao objetivo da revisão de literatura.
RESULTADOS
Foram identificados 43 artigos na busca inicial feita no PubMed e nos outros sites. Destes, foram identificados 28 artigos, dos quais foram lidos seus títulos e resumos. Na primeira leitura foram excluídos 13 trabalhos. Após leitura completa dos artigos selecionados, foram selecionados 11 artigos que se adequaram ao estudo de sequenciamento gênico e 4 foram excluídos por não focarem o tema. Os artigos incluídos nesta revisão sistemática foram publicados no período de 2010 a 2021, conforme apresentado na Figura 2.
Os artigos incluídos no Quadro 1 nesta revisão sistemática estão relacionados ao campo do diagnóstico, prognóstico e monitoramento da leucemia mieloide aguda. Os avanços da biologia molecular como técnicas de sequenciamento de nova geração (NGS), como também técnicas de PCR em tempo real são utilizadas como ferramentas que integram a avaliação simultânea de vários genes-alvo em análises laboratoriais de rotina. A avaliação de neoplasias mieloides com painéis de sequenciamento de nova geração, mostra evidências de otimização no diagnóstico, auxiliando nas decisões terapêuticas e fornecendo melhores informações sobre o prognóstico e detecção da doença residual mínima.
Os estudos de coorte realizados por Khan et al.,(11) Mack et al.,(12) Schranz et al.,(13) Ouyang et al.,(14) e Onecha et al.(15) demonstram que a tecnologia da biologia molecular aplicada e bioinformática podem fornecer uma avaliação mutagênica. O número crescente de mutações descobertas auxilia no diagnóstico e prognóstico com a detecção simultânea de múltiplas mutações somáticas em dezenas ou centenas de genes-alvo que estão associados a doenças específicas.
Nos artigos de revisão de Kantarjian et al.,(16) Liu et al.,(17) e Puyane Alkan(18) foi discutida a importância da técnica de RT- PCR para detectar a fusão os genes RUNX1-RUNX1T1 e CBFB-MYH11 que são reconhecidos pela detecção sensível e permitem a quantificação da LMA residual. O monitoramento de doença residual mínima (MRD) por meio quantitativo RT-PCR, em pontos de tempos específicos da doença, permite identificação de pacientes com alto risco de recidiva. Concomitante, com o método de PCR, o sequenciamento por análise multivariada mostrou que o status positivo mínimo residual da doença é um fator independente associado ao risco de morte. Este método NGS simplifica e padroniza a avaliação da doença residual mínima, com alta aplicabilidade na leucemia mieloide aguda, além de ser clinicamente aplicável no estabelecimento de um sistema de estratificação de risco preciso, para orientar as decisões terapêuticas.

Figura 1. Fluxograma de atividades.
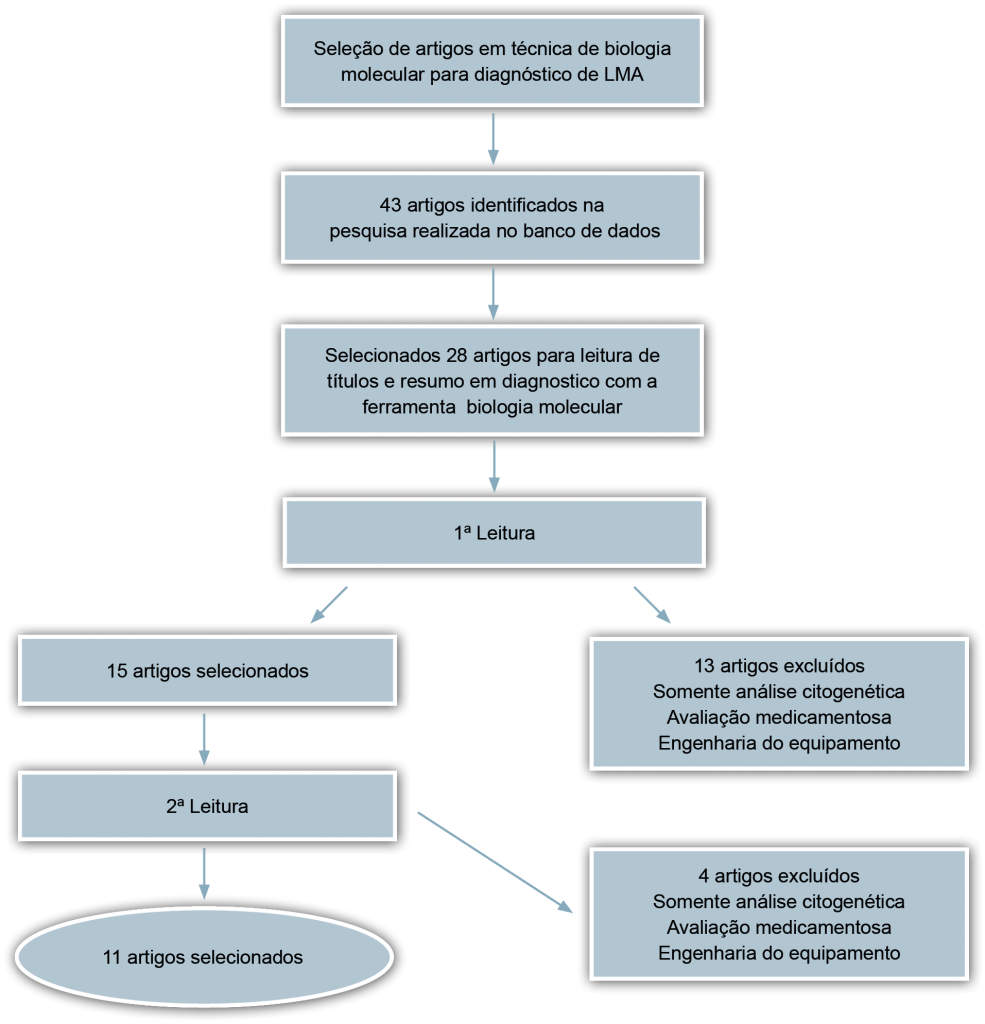
Figura 2. Fluxograma do processo de seleção dos estudos.
Quadro 1 – Principais informações dos estudos incluídos.
| Referências | Tipo de estudo | Técnica | Mutações |
| Khan et al.(11) | Estudo de coorte | PCR | RUNX1 |
| Morita et al.(19) | Ensaio clínico | RT-PCR | RUNX1 |
| Kantarjian et al.(16) | Revisão | NGS | |
| Mack et al.(12) | Estudo de coorte | NGS | FLT3 |
| Liu et al.(17) | Revisão | NGS – RNA – seq | Micro RNA |
| Schranz et al.(13) | Estudo de coorte | PCR – NGS | FLT3 |
| Ouyang et al.(14) | Estudo de coorte | RT-PCR | RUNX1-RUNX1T1 |
| Onecha et al.(15) | Estudo de coorte | NGS – PCR | NPM1, IDH1 / 2 e / ou FLT3 |
| ZHU et al.(20) | Ensaio clínico | RT-PCR | RUNX1/RUNX1T1 |
| Yin et al.(21) | Ensaio clínico | RT-PCR | RUNX1-RUNX1T1 |
| Puyan e Alkan (18) | Revisão | NGS |
DISCUSSÃO
Esta revisão sistemática evidencia que a ferramenta da biologia molecular contribui para o conhecimento das variáveis genéticas e clínicas, auxiliando na determinação do tratamento e possível prognóstico para pacientes de leucemia mieloide aguda. Aproximadamente 45% dos pacientes apresentam cariótipo normal, conforme detectado pela citogenética convencional durante o diagnóstico, mas mutação somática pode ser identificada em 97,3% dos casos. O sequenciamento genético pode identificar várias mutações que carregam informações prognósticas, incluindo mutações em FLT3, NPM1, KIT, CEBPA e TET2.(10,12,15,16)
O diagnóstico de LMA é baseado principalmente na identificação de 20% ou mais de blastos mieloídes na medula óssea e/ou sangue periférico. Além disso os mieloblastos, monoblastos e megacarioblastos são incluídos na contagem. Antes de 2001, o limite para o diagnóstico de LMA era de 30% de blastos, que posteriormente foi reconsiderado e definido para 20%. Contudo a análise citogenética é um componente importante e obrigatório do diagnóstico de LMA, que consiste em análise das alterações genéticas, que envolve o cultivo celular e diferentes técnicas de bandamento cromossômico. Estudos demonstram que, além de ser uma ferramenta diagnóstica poderosa, os achados citogenéticos e genéticos moleculares no pré-tratamento é um dos principais marcadores prognósticos independentes do tipo LMA e determinam a resposta e o resultado do tratamento quimioterápico.(1,22-24)
O Grupo Cooperativo Franco-Americano-Britânico (FAB) se baseia nas análises citomorfológica e citoquímica, para classificar a LMA em oito subgrupos. Esta classificação de LMA foi revisada e atualizada pela Organização Mundial da Saúde (OMS), Associação Europeia de Hemotopatologia e Sociedade de Hematopatologia, classificando a LMA levando em consideração as anormalidades citogenéticas ou genéticas moleculares.(1)
As alterações cromossômicas são encontradas no diagnóstico em aproximadamente 50% – 60% dos pacientes adultos com LMA. As mais comuns são t (8; 21), inv (16) ou t (16; 16), t (15; 17), trissomia do cromossomo 8 e rearranjos de 11q,(24) assim como alterações do cromossomo 5 e/ou cromossomo 7, que são bastante frequentes na doença. No entanto, pesquisas em células leucêmicas de pacientes com LMA têm identificado mutações gênicas adquiridas somaticamente com expressão desregulada de genes bem como os de microRNAs. Esses estudos demonstram avanço no diagnóstico e a heterogeneidade no conhecimento da patobiologia da LMA.(25)
O papel dos microRNAs vem se destancando. São caracterizados por serem moléculas pequenas de RNA de aproximadamente 22 nucleotídeos que se ligam ao 3′-não traduzido a região (3′-UTR) do mRNA alvo que regula negativamente a expressão do gene alvo no nível transcricional.(26,27) Os miRNAs participam principalmente na patogênese da LMA através dos cinco seguintes mecanismos: alteração do número de cópias, mudança no proximidade com a região genômica oncogênica devido à translocação cromossômica, alterações epigenéticas, alterações direcionadas para regiões promotoras de miRNA por fatores de transcrição alterados ou oncoproteínas e, finalmente, processamento alterado de miRNAs.(9)
Cada subtipo de LMA parece exibir um miRNA único que o distingue dos outros. Os miRNAs são considerados biomarcadores com ampla presença em variados tecidos. Sua sequência é altamente conservada com detecção fácil, estável e sensível.(29) Pesquisas demonstram que assim como a descoberta de miRNAs, os RNAs não codificantes (ncRNAs) e RNAs circulares (circRNAs) abrem novas perspectivas para o diagnóstico e prognóstico, como também para o tratamento. Os ncRNAs são pequenas moléculas funcionais de RNA que não são traduzidas em uma proteína.(30,31) Essas moléculas regulam a transcrição e tradução do DNA e podem ser descobertas com uso da tecnologia de RNASeq. Os ncRNAs estão intimamente relacionados à leucemogênese da LMA, e sua descoberta mostra o importante papel na proliferação de células leucêmicas, diferenciação e apoptose; alguns podem ser utilizados como potentes biomarcadores de prognósticos.(28,29)
Estudos recentes destacaram o potencial de novas tecnologias de sequenciamento para descobrir genes de fusão associados à LMA. Se a análise citogenética falhar, a hibridização fluorescente in situ é uma opção para detectar rearranjos de genes como RUNX1-RUNX1T1. A investigação diagnóstica deve incluir a triagem de mutações em NPM1, CEBPA e RUNX1, genes que podem definir categorias da doença, otimizando o diagnóstico. A hibridização fluorescente in situ é um método que pode ser utilizado para auxiliar a citogenética, pois detecta alterações cromossômicas, rearranjos de genes e avalia as células tanto na interfase quanto na metáfase, sendo um método mais sensível, uma vez que a citogenética só avalia na fase metáfase.(19,32)
O desenvolvimento de técnicas de reação em cadeia da polimerase de transcrição reversa (RT-PCR) para detectar os genes de fusão RUNX1-RUNX1T1 e CBFB-MYH11 possibilitou a detecção sensível e quantificação de genes da LMA. Embora apenas alguns dos marcadores moleculares recentes tenham sido identificados na prática clínica atual, pela técnica de RT-PCR a lista de genes provavelmente será expandida nos testes de genes únicos para serem substituídos por painel de genes ou plataformas simultâneas de mutações genéticas e arranjos genéticos. Portanto, a técnica de PCR permite identificar genes que estão relacionados com as translocações. Em cerca de 60% dos adultos jovens, as células de leucemia são informativas para um marcador molecular que pode ser rastreado por ensaios RT-qPCR baseados em RNA. A sensibilidade do ensaio depende da expressão relativa do alvo em blastos leucêmicos em comparação com genes de manutenção padrão.(20,32)
Estudos de Ouyang et al. (2016)(14) foram realizados utilizando a técnica RT-PCR quantitativo e citometria de fluxo multiparâmetros (CMF) com o objetivo de avaliar a doença residual mínima (MRD), que permite a identificação daqueles pacientes com alto risco de recidiva. As análises foram realizadas em 42 pacientes e o monitoramento da doença residual mínima por RT- qPCR em pontos de tempos específicos permitem a identificação de pacientes com alto risco de recidiva. Apesar disso, a maioria desses estudos mostrou que um alto nível de RT-qPCR no final do tratamento ou um aumento do nível de RT-qPCR durante o acompanhamento predispõem à recidiva. No entanto, a imunofenotipagem e a citometria de fluxo multiparâmetros (CMF) são considerados como exames de alta relevância no diagnóstico para várias desordens hematopoiéticas linfoproliferativas crônicas, como linfomas não Hodgkin, leucemias agudas, crises blásticas, desordens mieloproliferativas crônicas, sendo aplicável em mais de 90% de todos os pacientes com LMA, também auxiliando no diagnóstico da recidiva da doença.(33)
Estudos realizados por Schranz (2018)(13) analisam as mutações frequentes do gene FLT3 que estão associadas a prognóstico desfavorável da LMA. No diagnóstico, o FLT3-ITD é rotineiramente avaliado por análise de fragmentos e fornece informações do sequenciamento de amplicon de alto rendimento (HTAS) baseado no cDNA de 250 pacientes com LMA positivo para FLT3-ITD. O status do FLT3-ITD é determinado por diagnósticos de rotina, e durante este estudo foi confirmado por HTAS que 242 dos 250 pacientes (97%) teriam a mutação. O método de HTAS detectou um número grande de genes mutacionais indicando maior sensibilidade. Sendo a utilização da técnica de sequenciamento viável para a detecção de FLT3-ITD em pacientes com LMA analisando tanto a sequência como a carga mutacional desta alteração em um único ensaio com alta sensibilidade.
CONCLUSÃO
O progresso nas descobertas da patogênese molecular da LMA e a identificação de determinantes genéticos, tanto para diagnóstico como para prognóstico, e da resposta ao tratamento têm sido relevantes, e a tradução desses achados para a tomada de decisão clínica tem aumentado nos últimos anos. A disponibilidade do perfil molecular permite um tratamento direcionado.
As novas tecnologias de sequenciamento para descobrir genes de fusão associados à LMA vêm crescendo. A investigação diagnóstica na triagem de mutações gênicas que auxiliam na detecção de anormalidades genéticas contribui de forma preponderante no prognóstico. A triagem mutacional para os genes NPM1, FLT3 e CEBPA tem mostrado que esses marcadores podem ser utilizados para avaliar a doença residual mínima (MRD), bem como no desenvolvimento de novos agentes antileucêmicos.
As técnicas moleculares, incluindo PCR quantitativo em tempo real (RT-qPCR), PCR digital e tecnologias baseadas em sequenciamento de nova geração (NGS), podem ser padronizadas e utilizadas para detectar alterações genéticas associadas à LMA, sendo crucial para a decisão de tratamento ideal e nos direcionando para um tratamento personalizado.
REFERÊNCIAS
- Tamamyan G, Kadia T, Ravandi F, Borthakur G, Cortes J, Jabbour E, et al. Frontline treatment of acute myeloid leukemia in adults. Crit Rev Oncol Hematol. 2017 feb; 110: 20-34, doi: 10.1016/j.critrevonc.2016.12.004.
- Skayneh H, Jishi B, Hleihel R, Hamieh M, Darwiche N, Bazarbachi A, et al. A critical review of animal models used in acute myeloid leukemia pathophysiology. Genes (Basel). 2019 aug; 10(8): 614. doi: 10.3390/genes10080614.
- Hou H-A, Lin C-C, Chou W-C, Liu C-Y, Chen C-Y, Tang J-L, et al. Integration of cytogenetic and molecular alterations in risk stratification of 318 patients with de novo non-M3 acute myeloid leucemia. Leukemia. 2014; 28(1): 50-58. doi: 10.1038/leu.2013 .236.
- Heo SK, Noh EK, Jeong YK, Ju LJ, Sung JY, Yu HM, et al. Radotinib inhibits mitosis entry in acute myeloid leukemia cells via suppression of aurora kinase a expression. Tumour Biol. 2019 may; 41(5). doi: 10.1177/1010428319848612.
- Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA). Estimativa 2020: Incidência de Câncer no Brasil. Rio de Janeiro: INCA, 2019.
- Carter JL, Hege K, Yang J, Kalpage HA, Su Y, Edwards H, et al. Targeting multiple signaling pathways: the new approach to acute myeloid leukemia therapy. Signal Transduction and Targeted Therapy. 2020; 5(288).
- Kansal R. Acute myeloid leukemia in the era of precision medicine: recent advances in diagnostic classification and risk stratification. Cancer Biol Med. 2016 mar; 13(1): 41-54. doi: 10.28092/j.issn.2095-3941.2016.0001.
- Kulsoom B, Shamsi TS, Ahmed N, Hasnain SN. Recent advances in diagnostic and prognostic aspects of acute myeloid leukaemia. J Pak Med Assoc. 2017 oct; 67(10): 1580-1587.
- Lagunas-Rangel FA, Chávez-Valencia V, Gómez-Guijosa MA, Cortes-Penagos C. Acute myeloid leukemia-genetic alterations and their clinical prognosis. Int J Hematol Oncol Stem Cell Res. 2017 oct;11(4): 328-339.
- Kayser S, Levis MJ. Clinical implications of molecular markers in acute myeloid leucemia. Eur J Haematol. 2019 jan; 102(1): 20-35. doi: 10.1111/ejh.13172.
- Khan M, Cortes J, Kadia T, Naqvi K, Brandt M, Pierce S, et al. Clinical Outcomes and Co-Occurring Mutations in Patients with RUNX1-Mutated Acute Myeloid Leukemia. Int J Mol Sci. 2017 Aug; 18(8): 1618. doi: 10.3390/ijms18081618.
- Mack EKM, Marquardt A, Langer D, Ross P, Ultsch A, Kiehl MG, et al. Comprehensive genetic diagnosis of acute myeloid leukemia by next-generation sequencing. Haematologica. 2019 Feb;104(2):277-287. doi:10.3324/haematol.2018. 194258.
- Schranz K, Hubmann M, Harin E, Vosberg S, Herold T, Metzeler KH, et al. Clonal heterogeneity of FLT3-ITD detected by high-throughput amplicon sequencing correlates with adverse prognosis in acute myeloid leucemia. Oncotarget. 2018 Jul 10; 9(53):30128-30145. doi: 10.18632/oncotarget.25729.
- Ouyang J, Goswami M, Peng J, Zuo Z, Daver N, Borthakur G, et al. Comparison of Multiparameter Flow Cytometry Immunophenotypic Analysis and Quantitative RT-PCR for the Detection of Minimal Residual Disease of Core Binding Factor Acute Myeloid Leukemia. Am J Clin Pathol. June 2016; 145: 769-777. doi: 10.1093/AJCP/AQW038.
- Onecha E, Linares M, Rapado I, Ruiz-Heredia Y, Martinez-Sanchez P, Cedena T, et al. A novel deep targeted sequencing method for minimal residual disease monitoring in acute myeloid leucemia. Haematologica. 2019 Feb;104(2):288-296. doi: 10.3324/haematol.2018.19 4712.
- Kantarjian H, Kadia T, DiNardo C, Daver N, Borthakur G, Jabbour E, et al. Acute myeloid leukemia: current progress and future directions. Blood Cancer J. 2021 Feb 22;11(2):41. doi: 10.1038/s41408-021-00425-3.
- Liu Y, Cheng Z, Pang Y, Cui L, Qian T, Quan L, et al. Role of microRNAs, circRNAs and long noncoding RNAs in acute myeloid leucemia. J Hematol Oncol. 2019 may; 12(1): 51. doi: 10.1186/s13045-019-0734-5.
- Puyan FO, Alkan S. The Progress of Next Generation Sequencing in the Assessment of Myeloid Malignancies. Balkan Med J. 2019 Feb 28; 36(2): 78-87. doi: 10.4274/balkanmedj.ga lenos.2018.2018.1195.
- Morita K, Noura M, Tokushige C, Maeda S, Kiyose H, Kashiwazaki G, et al. Autonomous feedback loop of RUNX1-p53-CBFB in acute myeloid leukemia cells. Scientific Reports. 2017 nov; 7(16604). doi: 10.1038/s41598-017-16799-z.
- Zhu HH, Zhang XH, Qin YZ, Liu DH, Jiang H, Chen H. MRD-directed risk stratification treatment may improve outcomes of t(8;21) AML in the first complete remission: results from the AML05 multicenter trial. Blood. 2013; 121(20): 4056–4062. Doi:10.1182/blood-2012-11-468348.
- Yin JAL, O’Brien MA, Hills RK, Daly SB, Wheatley K, Burnett AK. Minimal residual disease monitoring by quantitative RT-PCR in core binding factor AML allows risk stratification and predicts relapse: results of the United Kingdom MRC AML-15 trial. Blood. 2012; 120(14): 2826–2835. doi:10.1182/blood-2012-06-435669
- Döhner H, Estey EH, Amadori S, Appelbaum FR, Büchner T, Burnett AK, et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the european LeukemiaNet. Blood. 2010 jan; 115(3): 453-74. doi: 10.1182/blood-2009-07-235358.
- Parikh SA, Jabbour E, Koller CA. Adult acute myeloid leukemia. In: Kantarjian HM, Wolff RA, Koller CA. The MD Anderson Manual of Medical Oncology. 2nd. New York, NY: McGraw-Hill; 2011.
- Kayser S, Döhner K, Krauter J, Köhne CH, Horst HA, Held G, et al. The impact of therapy-related acute myeloid leukemia (AML) on outcome in 2853 adult patients with newly diagnosed AML. Blood. 2011 feb; 117(7): 2137-45. doi: 10.1182/blood-2010-08-301713.
- Vardiman JW, Thiele J, Arber DA, Brunning RD, Borowitz MJ, Porwit A, et al. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes. Blood. 2009 jul; 114(5): 937-51. doi: 10.1182/blood-2009-03-209262.
- Vasudevan S, Tong Y, Steitz JA. Switching from repression to activation: microRNAs can up-regulate translation. Science. 2007 dec; 318(5858): 1931-4. doi: 10.1126/science.1149460.
- Wallace JA, O’Connell RM. MicroRNAs and acute myeloid leukemia: therapeutic implications and emerging concepts. Blood. 2017 sep; 130(11): 1290-1301. doi: 10.1182/blood-2016-10-697698.
- Liu Y, Cheng Z, Pang Y, Cui L, Qian T, Quan L, et al. Role of microRNAs, circRNAs and long noncoding RNAs in acute myeloid leucemia. J Hematol Oncol. 2019 may; 12(1): 51. doi: 10.1186/s13045-019-0734-5.
- Turchinovich A, Samatov TR, Tonevitsky AG, Burwinkel B. Circulating miRNAs: cell-cell communication function? Front Genet. 2013 jul; 4(119). doi: 10.3389/fgene. 2013.00119.
- Llave C, Xie Z, Kasschau KD, Carrington JC. Cleavage of Scarecrow-like mRNA targets directed by a class of arabidopsis miRNA. Science. 2002 sep; 297(5589): 2053-6. doi: 10.1126/science.1076311.
- Döhner H, Weisdorf DJ, Bloomfield CD. Acute Myeloid Leukemia. N Engl J Med. 2015 sep; 373(12): 136-52. doi: 10.1056/NEJMra1406184.
- Döhner H, Estey E, Grimwade D, Amadori S, Appelbaum FR, Büchner T, et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 2017; 129(4): 424-447. doi: https://doi.org/10.1182 /blood-2016-08-733196.
- Araki D, Wood BL, Othus M, Radich JP, Halpern AB, Zhou Y, et al. Allogeneic Hematopoietic Cell Transplantation for Acute Myeloid Leukemia: Time to Move Toward a Minimal Residual Disease-Based Definition of Complete Remission? J Clin Oncol. 2016 feb; 34(4): 329-36. doi: 10.1200/JCO.2015.63.3826.
Correspondência
Flávia Martins da Silva
Escola Bahiana de Medicina e Saúde Pública
Programa de Pós-Graduação em
Análises Clínicas e Gestão Laboratorial
Rua Dom João VI, Brotas
Salvador-BA CEP 40290-000
E-mail: [email protected]
