Avaliação dos parâmetros de testes rápidos para o diagnóstico do vírus da imunodeficiência humana
Evaluation of rapid test parameters for the human immunodeficiency virus diagnosis
Renata Almeida Scherdien1
Camila Lima da Silva1
Allyne Cristina Grando2
1 Graduanda do curso de Biomedicina da Universidade Luterana do Brasil (ULBRA).
2 Professora Adjunta do curso de Biomedicina da Universidade Luterana do Brasil (ULBRA).
Instituição: Universidade Luterana do Brasil (ULBRA). Canoas, RS, Brasil.
Recebido em 25/05/2020
Aprovado em 08/09/2020
DOI: 10.21877/2448-3877.202201997
INTRODUÇÃO
O Departamento de Infecções Sexualmente Transmissíveis (DIST) e Síndrome da Imunodeficiência Adquirida (AIDS) do Ministério da Saúde (MS) vem trabalhando de modo contínuo na busca de uma solução ao Vírus da Imunodeficiência Humana (HIV) e AIDS.(1) Baseado nisso, novas metodologias de diagnóstico têm sido adotadas com a intenção de proporcionar melhorias ao diagnóstico antecipado do HIV, consequentemente diminuindo o número de casos e transmissões.(2)
De acordo com o Programa Conjunto das Nações Unidas sobre HIV/AIDS (UNAIDS), mundialmente são cerca de 39,6 milhões de pessoas vivendo com HIV no ano de 2017.(3) No Brasil atualmente existem cerca de 630 mil pessoas vivendo com HIV/AIDS. No ano de 2018, surgiram 12.505 novos casos de homens infectados com o vírus HIV, 4.737 de mulheres e 119 crianças menores de cinco anos.(3) O MS estima que há cerca de 255 mil brasileiros infectados pelo vírus que não sabem da sua condição, pois nunca realizaram testes laboratoriais para os devidos fins.(4)
Segundo o Boletim Epidemiológico de HIV/AIDS, de 2007 até junho de 2018 foram notificados no Sistema de Informação de Agravos de Notificação (SINAN) 247.795 casos de infecção pelo HIV no Brasil. Na Região Sul fazem parte destes casos 42.215 pessoas, entre eles no Rio Grande do Sul foram 23.957 casos, caracterizando assim como o estado com a maior taxa de detecção do vírus na Região Sul. Porém a Região Sudeste é representada com o maior número de casos, com 50.890 pessoas com o HIV.(4)
No momento atual do nosso país, há várias dificuldades que estão associadas à implementação de novos testes mais específicos para detecção do vírus, desafios que visam detectar com precisão e acurácia uma boa amostra biológica que será utilizada para os testes de diagnóstico.(5) Algumas dificuldades permanecem constantes, como o desenvolvimento progressivo da tecnologia que desperta de maneira periódica novas metodologias no mercado de testes, sua aprovação pelas agências reguladoras e ainda sua aceitação para uso na rotina diária do diagnóstico em diferentes situações e instalações.(6)
Resultados falsos positivos (FP), falsos negativos (FN) ou indeterminados podem ser atingidos com a utilização de qualquer teste, seja devido à limitação da própria metodologia e do que ela pode detectar na amostra, ou seja, pela característica que o HIV tem do período de infecção nos indivíduos, até a produção de anticorpos consideráveis para serem detectados nos mesmos.(6) A reação cruzada de anticorpos presentes na amostra por algumas doenças autoimunes, dentre outras situações, pode produzir resultados FP ou indeterminados em qualquer teste sorológico.(7)
Atualmente existem algumas metodologias para diagnosticar o HIV com uma ampla variação de testes de diferentes marcas no mercado, entre elas a imunocromatografia realizada através de testes rápidos (TR). Os TR são testes imunocromatográficos que podem ser executados em até 20 minutos.(6) Existem vários formatos de TR, e os mais regularmente utilizados são as tiras de imunocromatografia de fluxo lateral, de dupla migração, dispositivos de imunoconcentração e fase sólida.(6)
O TR consiste em ser estendido sobre uma membrana de nitrocelulose fixa sobre suporte plástico. À medida que a amostra testada é absorvida pelo papel de filtro, e flui ao longo da reação, os anticorpos específicos para HIV presentes na amostra interagem com um conjugado composto por anticorpo monoclonal Anti Imunoglobulina G (IgG) humana. Logo após, o complexo flui pela membrana e os anticorpos específicos para HIV-1 e HIV-2 reagem aos antígenos, formando a coloração na tira, determinando se o resultado é reagente para o HIV-1 e HIV-2.(6)
Tendo em vista que não existem pesquisas até o momento no Brasil comparando uma grande quantidade de diferentes marcas de TR para HIV, este trabalho teve como objetivo comparar parâmetros como sensibilidade, especificidade, acurácia e valores preditivos positivos e negativos com diferentes fabricantes de TR utilizados para detectar anticorpos do HIV no mercado laboratorial.
MATERIAIS E MÉTODOS
A partir de dados coletados em bulas de TR para HIV, retiradas dos sítios web dos fabricantes, foi realizada uma análise comparativa com o objetivo de determinar qual o teste mais sensível, específico, com maior valor de acurácia, valor preditivo negativo, valor preditivo positivo e interferentes. Foram selecionadas bulas de 13 testes imunológicos que possuem registro na ANVISA.
Realizou-se uma revisão bibliográfica dos últimos anos sobre testes rápidos para HIV para fundamentar o artigo. A revisão foi efetuada nas bibliotecas eletrônicas Scielo, PubMed e BVS, nos idiomas português, inglês e espanhol, utilizando os seguintes descritores: HIV, sintomas, transmissão, diagnóstico, epidemiologia, testes rápidos, sensibilidade, especificidade, acurácia, VPP e VPN.
Por se tratar de uma revisão bibliográfica e os dados coletados das bulas dos testes não conterem informações pessoais sobre pacientes, não ocorreu a necessidade de encaminhamento para um Comitê de Ética e Pesquisa.
RESULTADOS
Foram analisados 13 testes imunocromatográficos para HIV. Seus parâmetros foram retirados de suas respectivas bulas fornecidas pelos sítios web dos próprios fabricantes. Os dados coletados são apresentados nas Tabelas 1 e 2.
Tabela 1 – Comparação entre os parâmetros de testes imunocromatográficos
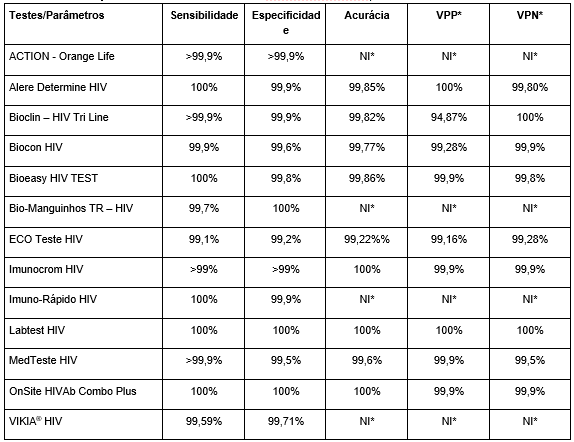
Legenda*: NI – Não informado; VPP – Valor Preditivo Positivo; VPN – Valor Preditivo Negativo. Fonte: Autoral
Tabela 2 – Substâncias interferentes nas amostras referidas pelos testes imunocromatográficos
| Teste Rápido | Interferentes na amostra |
| 1. ACTION – Orange Life | Anticoagulantes como heparina, EDTA e citrato não afetam o resultado. Interferentes relevantes conhecidos como amostras hemolíticas, fator reumatoide, amostras ictéricas, hemolisadas e lipêmicas podem prejudicar os resultados do teste. Os resultados falsos positivos podem aparecer em imunoensaios sensíveis devido à presença de anticorpos heterofílicos com antimouse humanos ou proteínas de ligação inespecíficas. |
| 2. Alere Determine HIV | Os 10 agentes patogênicos causadores de reação cruzada listados abaixo não tiveram efeito nos resultados do teste HIV: Hepatite C, Vírus Linfotrópico da célula humana, Epstein Barr, Hepatite B, Citomegalovírus, Clamídia, Influenza, Toxoplasma, Sífilis, Tripanossoma cruzi; Nove substâncias potenciais não tiveram efeito no desempenho: Mulheres grávidas, colesterol alto, bilirrubina alta, fator reumatoide, amostras lipêmicas, hemolisadas, autoimune, cirrose alcoólica, gravidez multíparas. Não houve interferência com 25 fármacos, todos testados com concentração de 250μ/mL, sendo alguns deles: abacavir, paracetamol, ácido acetilsalicílico, amoxicilina, aspirina, diclofenaco, ácido fólico, ibuprofeno, ferro, metformina, pirazinamida, ritonavir. |
| 3. HIV Tri Line – Bioclin | Hemólise com valores de hemoglobina até 10g/L não interferem na detecção. Não foram encontradas interferências significativas até 30g/L de lípides, 0,2g/L de bilirrubina e 60g/L de proteínas. Nenhuma reatividade cruzada foi encontrada com as seguintes infecções testadas: Hepatite C, Hepatite B e Sífilis. |
| 4. HIV Biocon | NI* |
| 5. HIV TEST Bioeasy | Anticoagulantes, como heparina, EDTA e citrato de sódio, não afetam o resultado do teste. As utilizações de amostras hemolíticas, lipídicas, ictéricas, contendo fatores reumatoides, podem afetar o resultado do teste. |
| 6. TR – HIV Bio- Manguinhos | Resultados falsos negativos podem ser obtidos caso o teste seja utilizado em amostras de pacientes soropositivos, que estejam ou tenham sido submetidos à terapia antirretroviral. |
| 7. ECO Teste HIV | NI* |
| 8. Imunocrom HIV | A reação cruzada foi acessada testando soros de pacientes acometidos com outras infecções e negativos para HIV. Todos os resultados obtidos foram negativos, reduzindo, assim, a possibilidade de reação cruzada com as seguintes infeções: Hepatite B e C; Vírus linfotrópico da célula T humana; Chagas; Sífilis e Toxoplasmose. Amostras contentando altos títulos de anticorpos heterofílicos ou fator reumatoide além de anticorpos monoclonais, podem interferir nos resultados. |
| 9. Imuno-Rápido HIV | Usar soros livres de hemólise, lipemia e contaminação. Recomenda-se usar amostras frescas. Amostra diluída pode ocasionar resultado falso negativo. Amostras de sangue total coletadas com anticoagulante líquido podem ocasionar falsos resultados. A avaliação para infecção por HIV em pacientes de hemodiálise crônicos requer sempre testes confirmatórios, devido aos interferentes presentes nesse tipo de amostra. Podem ocorrer resultados falsos positivos e falsos negativos com este teste, cuja proporção dependerá da prevalência da doença na população ensaiada. |
| 10. Labtest HIV | Não foram observados resultados falsamente positivos em amostras positivas para Vírus linfotrópico da célula T humana, Hepatite C e B, Tripanossoma cruzi, Sífilis. |
| 11. MedTeste HIV | Não mostrou reações cruzadas com amostras reagentes de Hepatites A, B e C, Sífilis, Citomegalovírus, Rubéola, Toxoplasmose. Algumas reações cruzadas foram observadas em amostras reagentes de Fator Reumatoide, Epstein Barr e Hepatite B aguda. Nenhuma das substâncias nas concentrações testadas, como acetaminofeno 20mg/dL; ácido acetilsalicílico 20mg/dl; ácido ascórbico 2g/dl; creatina 200mg/dL; bilirrubina 1g/dl; cafeína 20mg/dl; ácido gentísico 20mg/dL; albumina 2g/dL; hemoglobina 1,1g/dL e ácido oxálico 600mg/dL, interferiu no ensaio. |
| 12. OnSite HIVAb Combo Plus | Não foi observado resultado FP nos seguintes estados patológicos como: Hepatite B, Hepatite A, Hepatite C, Dengue, Sífilis, Tuberculose. Substâncias comuns (como medicações para dor e febre) podem afetar o desempenho. As substâncias nas concentrações testadas não afetaram a performance do teste, tais como: Bilirrubina 20mg/dL; creatinina 442µmol/L; glicose 55 mmol/L; albumina 60g/L; ácido salicílico 4,34mmol/L; heparina 3,000U/L; EDTA 3,4µmol/L. Algumas amostras contendo elevados títulos de anticorpos heterofílicos ou fator reumatoide podem ocasionar resultados FP. |
| 13. VIKIA® HIV | Não houve interferência e influência significativa de hemólise até 5g/L; lipemia até 30mg/mL; bilirrubinemia até 300mg/mL, biotina até 20 μg/mL. |
Legenda *: NI – Não Informado Fonte: Autoral
Os testes em sua totalidade apresentaram valores de sensibilidade, especificidade, acurácia, VPP e VPN superiores a 99% sendo que cinco destes testes, tais como Alere Determine,(8) Bioeasy,(9) Imuno Rápido,(10) Labtest,(11) OnSite,(12) apresentaram sensibilidade de 100%. As marcas Labtest(11) e OnSite(12) apresentaram sensibilidade e especificidade de 100%. Em comparação, o fabricante EcoTeste(13) apresentou os menores parâmetros em relação aos demais testes, com valores de sensibilidade e especificidade 99,1%, 99,2% respectivamente.
Os testes Imunocrom HIV,(14) Labtest(11) e OnSite HIV(12) apresentaram valores de acurácia, VPP e VPN acima de 99,9%. O teste EcoTeste(13) mostrou-se com o menor valor de acurácia de 99,22%; em consequência VPP e VPN com valores de 99,16% e 99,28% respectivamente. Quatro testes, sendo estes ACTION – Orange Life,(15) Bio-Manguinhos TR HIV,(16) Imuno Rápido,(10) Vikia HIV,(17) não apresentaram os dados necessários para calcular os valores de acurácia, VPP e VPN, tendo em vista que para tal feito as bulas devem referir quantas amostras foram testadas para avaliar o desempenho do teste e quais os resultados FP, FN, VP eVN.
Relacionado aos interferentes de cada teste, dois fabricantes, Biocon HIV(18) e EcoTeste HIV(13) não apresentaram seus interferentes em suas bulas. Os testes Bioclin,(19) MedTeste,(20) OnSite(12) e Vikia(17) foram os únicos a apresentar algumas substâncias de alto potencial interferente e com concentrações testadas que podem alterar o desempenho do teste, tais como bilirrubina, creatinina, glicose, proteínas, ácido acetilsalicílico, ácido ascórbico, ácido oxálico, heparina, EDTA, biotina e lipídios. Com a exceção dos testes Bio-Manguinhos,(16) Imunocrom(14) e Labtest,(11) que não mencionaram nenhuma destas substâncias como possíveis interferentes.
Os testes Action Orange Life(15) e Bioeasy(9) relatam que ao utilizar amostras com anticoagulantes como heparina, EDTA e citrato, estas substâncias não interferem no resultado obtido. Em contrapartida, o teste Imuno Rápido(10) diz que amostras de sangue total colhidas com anticoagulantes podem ocasionar falsos resultados, não especificando se são resultados FP ou FN.
Seis testes, Alere Determine,(8) Bioclin,(19) Imunocrom,(14) Labtest,(11) MedTeste(20) e OnSite(12) abordaram sobre possíveis reações cruzadas com as seguintes infecções: hepatites A, B e C, sífilis, citomegalovírus, rubéola e toxoplasmose.
Os fabricantes Action Orange Life,(15) Bioeasy,(9) Imunocrom,(14) MedTeste(20) e OnSite(12) relatam possíveis resultados FP em amostras contendo uma alta titulação de fator reumatoide, sendo que Action,(15) Imunocrom(14) e OnSite(12) relatam ainda reação cruzada com anticorpos heterofílicos resultando em possíveis FP. O fabricante Alere Determine(8) foi o único a abordar sobre possíveis interferentes, como gestantes, gravidez multípara e cirrose alcoólica, conjuntamente com alguns fármacos testados em concentrações de 250μ/mL, tais como abacavir, paracetamol, ácido acetilsalicílico, amoxicilina, aspirina, diclofenaco, ácido fólico, ibuprofeno, ferro, metformina, pirazinamida, ritonavir. Portanto, estas substâncias não interferiram no ensaio do teste.
Não foi possível identificar um interferente comum entre todos os testes.
DISCUSSÃO
Em 2005, a Portaria n.º 34/05 estabeleceu a regulamentação do uso dos TR anti-HIV com o objetivo de ampliar o acesso ao diagnóstico da infecção pelo HIV, tendo como justificativa que se conhecendo a condição sorológica do paciente e a identificação precoce da doença irá contribuir para a diminuição no número de transmissões.(21)
Atualmente, os TR são muito utilizados devido às suas vantagens, como baixo custo, rapidez e fácil utilização.(22) Porém, alguns estudos mostram que devido à sensibilidade e especificidade menor, durante a janela imunológica da infecção podem ocorrer mais resultados FN, constatando os casos positivos em apenas 91% das vezes.(23,24)
De acordo com o MS, os TR foram inicialmente desenvolvidos no final da década de 1980, mas alcançaram mais notoriedade nos anos 1990. Com o decorrer do tempo e com os avanços tecnológicos para detectar o HIV, o TR mostrou-se tão acurado quanto os métodos do inglês Enzyme-Linked Immunosorbent Assay (ELISA).(25) Por ser um teste simples e rápido, pode ser considerado de grande valia para ampliar o diagnóstico em regiões com pouca infraestrutura, não havendo a necessidade de materiais caros e complexos.(26) Existem no mercado variados kits de TR disponíveis, que empregam diferentes princípios técnicos e que são comercializados por vários fabricantes.(27)
Dentro deste contexto, se faz necessária a ação de analisar os parâmetros de um TR, para que tenhamos entendimento de quão eficaz é o desempenho de determinado teste, ou seja, facilitam observar se ele realmente condiz com o que lhe foi proposto. Para avaliar estes parâmetros, é de suma importância ter o amplo e necessário conhecimento dos mesmos, ficando a cargo do laboratório ou do profissional que estiver utilizando avaliar e definir qual teste será específico para a finalidade escolhida.(28)
O MS considera como TR com um bom desempenho aqueles que possuem sensibilidade maior ou igual a 99,5% e especificidade maior ou igual a 99,0%.(6) A sensibilidade de um teste diagnóstico é a capacidade de identificar os verdadeiros positivos nos indivíduos verdadeiramente doentes. Já a especificidade é a capacidade de um teste diagnóstico de identificar os verdadeiros negativos em pacientes realmente sadios.(29)
Comparando os parâmetros entre os testes selecionados, eles apresentaram todos os valores de sensibilidade e especificidade superiores a 99%. Somente um teste não se ajusta de acordo com os parâmetros requeridos pelo MS, pois apontou sensibilidade menor que 99,5%, que fora a marca EcoTeste HIV(14) com 99,1%, da mesma forma a menor especificidade com valor de 99,2%.
Em estudo realizado no Peru,(30) para comparar a sensibilidade de três marcas de TR, sendo elas Alere Determine, Bioline e OnSite, verificou-se que os valores referidos nas bulas dadas pelos fabricantes não condizem com o teste feito pelos autores, visto que os três testes determinaram sensibilidade de 100% e no estudo realizado constataram valores diferentes de sensibilidade, respectivamente como 54,8% 47,6% e 14,3%. Como justificativa, os autores consideraram que os testes feitos para verificar o desempenho de cada teste fora precedente de outros países, e que uma das razões por terem dado resultados tão diferentes de sensibilidade seria a variabilidade antigênica do HIV.(30)
Os fabricantes Bio-Manguinhos(16) e Vikia(17) apresentaram uma especificidade de 100% e 99,71%, respectivamente, ou seja, a especificidade foi maior que a sensibilidade, que apresentou valores de 99,7% e 99,59%, respectivamente. Estudos mostram que geralmente os TR são mais sensíveis do que específicos, e que para se confirmar se uma amostra realmente é reagente para HIV deve-se realizar testes mais específicos, como Western blot, por exemplo.(6) Testes mais sensíveis conseguem detectar com mais facilidade um anticorpo em uma fase mais aguda da doença. Porém, em um âmbito laboratorial clínico precisa-se ter uma especificidade maior, assim diminuindo os resultados FN.(9)
Um estudo realizado em 2011 avaliou um novo teste imunocromatográfico produzido pela empresa Canadense Medmira para a detecção de anticorpos específicos de HIV, HCV e HBV. Foram colhidas amostras com resultados reagentes e não reagentes para a presença de anticorpos anti-HIV para avaliar o desempenho separadamente em cada infecção. Os resultados encontrados se mostraram bastante favoráveis em relação ao teste para HIV com valores de sensibilidade, especificidade e acurácia, revelando 98,6%, 100% e 99,3%, respectivamente. Os autores também investigaram a presença de anticorpos específicos de algumas infecções importantes, além do fator reumatoide, utilizando amostras reagentes para eles, de modo a avaliar se podem causar reações cruzadas, ocasionando, assim, resultados FP e FN no teste. Os autores concluíram que para o Toxoplasma gondii, Trypanossoma cruzi, citomegalovírus, rubéola, herpes virus-1, Treponema pallidum e fator reumatoide não foram observadas reações cruzadas.(31)
Os fabricantes Alere Determine,(8) Bioclin,(19) Imunocrom,(14) LabTest,(11) MedTeste(20) e OnSite(12) relataram sobre possíveis reação cruzadas com as mesmas infecções referidas no estudo citado anteriormente, porém estes não causaram interferência no desempenho do teste. Cinco dos testes, Action Orange Life,(15) Bioeasy,(9) Imunocrom,(14) MedTeste(20) e OnSite,(12) apresentaram possíveis interferências no ensaio devido à utilização de amostras com titulação elevada de fator reumatoide.
A marca LabTest HIV(11) foi a única a apresentar todos os parâmetros de 100% e tampouco referiu sobre interferentes que pudessem ocasionar um resultado FN, apenas FP. Nenhum teste dispõe de uma sensibilidade e especificidade de 100%, visto que o aumento da especificidade vem associado de uma queda da sensibilidade, e do mesmo modo o aumento da sensibilidade acompanha uma diminuição da especificidade. Daí ser muito difícil, na prática clínica, encontrar um teste diagnóstico que tenha valores de sensibilidade e especificidade de 100%, visto que os dois parâmetros são contrários entre si.(32)
Resultados FN, FP, indeterminados ou divergentes podem ocorrer durante a rotina laboratorial, assim diminuindo o desempenho do teste.(29) Estes testes são simples de serem realizados, pois geralmente são utilizados antígenos virais fixados em um suporte sólido (membranas de celulose, por exemplo) para reagirem com os anticorpos da amostra e são acondicionados em embalagens individualizadas, permitindo a testagem individual de cada amostra.(25) Por essa razão, muitas vezes podem não estar armazenados corretamente com a temperatura recomendada pelo fabricante, ou então é utilizado um volume de amostra insuficiente, entre outras interferências, ocasionando os resultados descritos anteriormente.(33)
Um estudo de 2014 avaliou a acurácia dos TR Bio-Manguinhos e Rapid Check utilizados em gestantes para o diagnóstico da infecção pelo HIV. O TR Bio-Manguinhos foi utilizado para a primeira testagem e o Rapid Check para a segunda, ou seja, o Rapid Check foi adotado como TR confirmatório, conforme estabelece o fluxograma de TR do DDAHV. Das 764 gestantes testadas, 10 pacientes apresentaram resultados positivos com o primeiro TR (Bio-Manguinhos) e após realizar o TR confirmatório (Rapid Check), dois pacientes revelaram resultados negativos. Estes dois resultados foram avaliados, portanto, como resultados inconclusivos, consequentemente necessitaram ser confirmados com ensaios complementares como Western Blot. Os oito testes restantes foram confirmados reagentes como Rapid Check, ou seja, comprovando o primeiro resultado realizado como Bio-Manguinhos. Os dois TR avaliados mostraram uma concordância de 99%, e os autores concluíram que os TR são uma ótima opção para maternidades que precisam investigar HIV em gestantes, porém deve-se utilizar dois TR para maior segurança.(34)
Normalmente, o aumento da prevalência da infecção nos indivíduos reforça a probabilidade de que o indivíduo com resultado positivo esteja realmente infectado.(35) Em consequência, um único TR não possibilita o diagnóstico da infecção pelo HIV no Brasil.(35,36) Conforme o fluxograma descrito na Portaria SVS/MS n.º 29, de 17 de dezembro de 2013, o MS recomenda que sejam utilizados dois TR em sequência caso a amostra seja positiva para a testagem do primeiro TR utilizado.(6)
Verifica-se que os fabricantes Action Orange Life,(15) Bio-Manguinhos,(16) Imuno Rápido(10) e Vikia(17) não referiram valores de acurácia, VPP e VPN. A acurácia de um marcador sorológico tem relação com a amplitude com que ele pode prognosticar a ocorrência de determinada doença ou infecção.(37) Nesse contexto, temos uma probabilidade de o indivíduo estar realmente doente ou não, isto é conhecido como Valor Preditivo (VP), que pode ser positivo (VPP) ou negativo (VPN). Consequentemente, o VPP é a proporção de VP e representa a probabilidade de um indivíduo com o teste positivo ter a doença. E o VPN é a proporção de VN e representa a probabilidade de um indivíduo com o teste negativo não ter a doença. Uma vez que são parâmetros importantes e necessários para determinar a eficácia de um teste, ou seja, diz respeito à dimensão com que ele pode predizer a ocorrência da doença, devem ser apresentados nas bulas.(38)
A prevalência da doença na população em certo local determina um VPP e VPN.(39) Em locais de baixa prevalência da infecção pelo HIV, por exemplo, o VPP pode não ser suficientemente alto.(36) Logo, se a prevalência do HIV for alta em um local, o VPP aumenta e o VPN diminui. Assim, eles serão diferentes em populações com maior ou menor prevalência da doença em comparação com a população na qual o teste foi descrito pela primeira vez. Portanto, valores preditivos não são características fixas do teste e não podem ser generalizados para populações com diferentes prevalências da doença.(39)
Os fabricantes Biocon(18) e EcoTeste(13) não apresentaram os interferentes em suas bulas, tendo em vista a importância dos mesmos para verificar se pode haver resultados FP e FN, dependendo do tipo de amostra e do paciente. Seus valores de sensibilidade e especificidade foram respectivamente de 100% e 99,75%, 99,9% e 99,6%, 99,1% e 99,2%. Apesar de seus valores de sensibilidade e especificidade, resultados FP e FN podem ser causados pelas reações cruzadas e interferências na amostra. Quando o analito apresenta concentrações muito elevadas, é possível ultrapassar a capacidade de ligação dos anticorpos, ocorrendo assim os resultados descritos anteriormente. Amostras muito diluídas ou hemolisadas, presença de substâncias que interferem na reação antígeno-anticorpo do mesmo modo podem apresentar resultados FP e FN, e consequentemente podemos observar a importância relacionada ao se ter conhecimento sobre os interferentes.(40)
Como se pode observar, cada um dos testes expressa diferentes substâncias em diferentes concentrações testadas, como bilirrubina, creatinina, glicose, proteínas, ácido acetilsalicílico, ácido ascórbico, ácido oxálico, heparina, EDTA, biotina e lipídios, porém nem todos apresentam as mesmas substâncias. Os demais testes expressaram algumas destas substâncias como interferentes, mas não apresentaram suas concentrações testadas. Os fabricantes HIV Tri Line Bioclin(19), Imunocrom(14) e MedTeste(20) relatam que não houve reações cruzadas gerando resultados FP e FN. Portanto, não foi possível observar um interferente comum em todos os testes, visto que alguns comentam sobre as mesmas substâncias, mas em concentrações diferentes.
Um estudo realizado com pacientes africanos em 2010 mostrou que a doença de Chagas interfere significativamente nos desempenhos de TR para HIV. Os testes avaliados apresentaram resultados de 100% de especificidade testados em pacientes sem anticorpos para o Trypanosoma brucei gambiense. Os valores de especificidade dos mesmos TR diminuíram consideravelmente em pacientes que tinham anticorpos reagentes para a infecção, antes do tratamento. Foram encontrados valores de 39,1% para o TR Determine, 85,3% a 92,8% para Vikia, Immuno Flow, Double Check e Bioline. A infecção pelo Trypanosoma brucei gambiense diminui as especificidades dos TR para o diagnóstico do HIV.(41)
O fabricante Alere Determine(8) foi o único teste a abordar sobre interferentes específicos, que os outros testes não comentaram, tais como gravidez multípara, gestantes, cirrose alcoólica e colesterol elevado. Do mesmo modo, relatou sobre fármacos que podem causar interferência, alguns bastante utilizados pela população, como: paracetamol, amoxicilina, aspirina, diclofenaco, ibuprofeno, ácido fólico e metformina. O teste OnSite(12) aborda sobre medicamentos para dor e febre como possíveis interferentes no desempenho do teste, mas não cita quais medicamentos. Os medicamentos são interferentes relevantes, tendo em vista sua ampla utilização pela população. Seja qual for o fármaco, independentemente da via de administração, pode interferir nos testes laboratoriais. Como exemplo, se tem a conversão da droga em outros compostos iônicos ou mais polares por biotransformação hepática, transformações como estas podem produzir derivados e metabólitos que reagem no ensaio, resultando em resultados incorretos.(42)
CONCLUSÕES
Avaliando os diferentes fabricantes de TR para HIV analisados neste estudo, observa-se que cerca de todos os TR apresentaram em suas bulas valores de sensibilidade e especificidade de acordo com o que o MS estipula, ficando evidente que apenas a marca EcoTeste(13) não está em consonância com estes parâmetros por estar abaixo do que é recomendado pelo órgão regulamentador dos testes em nosso país. Os demais fabricantes que apresentaram todos os parâmetros analisados em suas bulas revelaram parâmetros com valores muito similares entre si.
Ademais, é importante considerar que o MS não estipula valores de VPP, VPN e acurácia, em razão de que estes parâmetros são variáveis porque dependem da prevalência daquela doença/infecção de determinada região em que foi feito o desempenho do teste. Verificou-se que de 13 testes analisados neste estudo, quatro não apresentaram os parâmetros relacionados à VPP, VPN e acurácia.
Por fim, no presente trabalho houve a comparação dos TR de diferentes fabricantes em relação aos seus parâmetros de desempenho e concluiu-se que os fabricantes Alere Determine,(8) Bioclin,(19) Bioeasy,(9) Imunocrom,(14) MedTeste(20) e OnSite (12) foram os testes com as bulas mais completas, apresentando elevados valores de sensibilidade e especificidade e, do mesmo modo, contendo todos os parâmetros necessários para analisar o desempenho do teste juntamente com seus principais interferentes nas amostras.
REFERÊNCIAS
- Schmitt JHL, Silva RM. Prevalência de sintomas depressivos em pacientes portadores do HIV/Aids em um hospital de referência na cidade de Florianópolis – SC. Arq Catarinenses Med. 2009 Abr-Jul;38(2):90-97.
- Santos AFM, Assis M. Vulnerabilidade das idosas ao HIV/AIDS: despertar das políticas públicas e profissionais de saúde no contexto da atenção integral: revisão de literatura. Rev Bras Geriatr Gerontol [periódicos na internet]. 2011 [acesso em 15 de nov 2018];14(1). Disponível em: https://www.scielo.br/pdf/rbgg/v14n1/a15v14n1.pdf
- UNAIDS [homepage na internet]. Programa Conjunto das Nações Unidas sobre HIV/AIDS [acesso em 15 de nov 2018]. Disponível em: https://unaids.org.br.
- Ministério da Saúde (BR). Boletim epidemiológico HIV/AIDS 2018. Brasília: Secretaria de Vigilância em Saúde; 2018.
- Knottnerus JA, Buntinx F. The evidence base of clinical diagnosis: theory and methods of diagnostic research. 2. ed. Oxford: BJM Books; 2011.
- Ministério da Saúde (BR). Manual técnico para o diagnóstico da infecção pelo HIV em adultos e crianças. Brasília: Secretaria de Vigilância em Saúde – Departamento de vigilância, prevenção e controle das infecções sexualmente transmissíveis, do HIV/Aids e das Hepatite Virais; 2018.
- Ministério da Saúde (BR); Universidade Federal de Santa Catarina. Diagnóstico do HIV. Brasil: Secretaria de Vigilância em Saúde – Departamento de DST, AIDS e Hepatites Virais; 2014.
- Alere Determine. [Bula]. São Paulo (SP): Alere Medical Co; 2015.
- Bioeasytest HIV. [Bula]. República Popular da China: AconBiotech; 2019.
- Imuno-Rápido HIV. [Bula]. São Carlos (SP): WAMA Diagnóstica; 2019.
- Labtest. [Bula]. Lagoa Santa (MG): Labtest Diagnóstica S.A; 2012.
- OnSite. [Bula]. São Paulo (SP): BioAdvance Diagnósticos Ltda; 2017.
- ECO Teste. [Bula]. Corinto (MG): Eco Diagnóstico Ltda – ME; 2017.
- Imunocrom. [Bula]. Contagem (MG). Mbiolog Diagnósticos; 2017.
- Action-OrangeLife. [Bula]. Rio de Janeiro (RJ): Orangelife Com. e Ind. Ltda; 2017.
- Bio-Manguinhos. [Bula]. Rio de Janeiro (RJ): Fundação Oswaldo Cruz; 2007.
- VIKIA. [Bula]. São Paulo (SP): bioMérieux Ltda; 2017.
- Biocon. [Bula]. Belo Horizonte (MG): Diagnóstica – Importadora e Distribuidora Ltda – ME; 2010.
- Bioclin. [Bula]. Belo Horizonte (MG): Quibasa Química Básica Ltda; 2019.
- Medteste. [Bula]. Serra (ES): MedLevensohn Com. e Rep. de Prod. Hospitalares Ltda; 2018.
- Silva O, Tavares LHL, Paz LC. As atuações do enfermeiro relacionadas ao teste rápido anti-HIV diagnóstico: uma reflexão de interesse da enfermagem e da saúde pública. Rev Enfermagem em Foco [periódicos na internet]. 2011 [acesso em 26 de mai 2019];2(Suppl). Disponível em: http://revista.cofen.gov.br/index.php/enfermagem/article/view/83/69
- Martínez-Oliva BG, Montaño-Valenzuela KJ, Rodriguez-Herbas P, Flores-León AA, Grados-Torrez RE. Sensibilidad y especificidad de pruebas inmunocromatográficas utilizadas en el nuevo algoritmo de diagnóstico de VIH en Bolivia. Gac Med Bol. 2018;41(2):6-8.
- Branson BM, MD. The future of HIV testing. J Acquir Immune Defic Syndr [periódicos na internet]. 2010 dez [acesso em 26 de mai 2019];55(Suppl 2). Disponível em: https://journals.lww.com/jaids/fulltext/2010/12152/the_future_of_hiv_testing.11.aspx
- Stekler JD, Swenson PD, Coombs RW, Dragavon J, Thomas KK, Brennan CA, et al. HIV testing in a high-incidence population: is antibody testing alone good enough? Clin Infect Dis. 2009 Ago;49(3):444-53.
- Ministério da Saúde (BR). Testes rápidos: considerações gerais para seu uso com ênfase na indicação de terapia anti-retroviral em situações de emergência. Brasil: Unidade de assistência, unidade de laboratório e rede de direitos humanos da coordenação nacional de DST/Aids; 1999.
- Cruz HM. Avaliação do desempenho de testes rápidos na detecção de marcadores do vírus da hepatite B. Rio de Janeiro. Dissertação [Mestrado em Medicina Tropical] – Fundação Oswaldo Cruz; 2014.
- Moreschi LB, Beltrame M, Soares RG, Dockhorn DMC, Neves M. Testes rápidos para diagnóstico de HIV: uma revisão narrativa da literatura. Revista Eletrônica da Pontifícia Universidade Católica do Rio Grande do Sul [periódicos na internet]. 2015 [ acesso em 26 de mai 2019];8(1). Disponível em: http://revistaseletronicas.pucrs.br/ojs/index.php/graduacao/article/view/20730/12994
- Seadi C. Princípios Básicos de Imunologia. 2. ed. Canoas: Editora da ULBRA; 2014.
- Oliveira GM, Camargo FT, Gonçalves EC, Duarte CVN, Guimarães CA. TCBC-RJ. Revisão sistemática da acurácia dos testes diagnósticos: uma revisão narrativa. Rev Col Bras Cir. 2010;37(2):153-6.
- Miranda-Ulloa E, Romero-Ruiz S, Briceño-Espinoza R, Santos-Anaya D. Evaluación de tres marcas comerciales de pruebas rápidas para la detección de VIH [carta]. Rev Peru Med Exp Salud Publica. 2015;32(2):404-5.
- Souza IO. Validação de ensaio imunocromatográfico para a detecção múltipla de anticorpos específicos contra HIV, HBV e HCV. Salvador. Dissertação [Mestrado em Biotecnologia] – Universidade Federal da Bahia; 2011.
- Bastos RR, Bastos RR. Sensibilidade e especificidade. Revista Médica Oficial do Hospital Universitário da UFJF [periódicos na internet]. 2004 Jan-Abr [acesso em 01 de jun 2019];30(1). Disponível em: http://www.ufjf.br/hurevista/files/2016/11/extracted_Ensino_Pesquisa_2016_11_10_17_51_32_838.pdf
- Ferreira Junior OC, Ferreira C, Riedel M, Widolin MRV, Barbosa-Júnior A. HIV Rapid Test Study Group. Evaluation of rapid tests for anti-HIV detection in Brazil. AIDS. 2005 Out;19(Suppl 4):S70-5.
- Santos AM, Barbosa AB, Rocha TJM, Pimentel EC, Rodrigues MML. Avaliação de teste rápido para HIV, padronizado pelo Ministério da Saúde, utilizado em uma maternidade escola em Maceió-AL. Revista Eletrônica de Farmácia [periódicos na internet]. 2014 [acesso em 01 de jun 2019];11(3). Disponível em: https://revistas.ufg.br/REF/article/view/27822/17122
- Patino CM, Ferreira JC. Entendendo os testes diagnósticos: parte 2. J Bras Pneumol. 2017;43(6):408.
- Ministério da Saúde (BR). Recomendações para terapia anti-retroviral em adultos infectados pelo HIV. Brasília: Secretaria de Vigilância em Saúde – Programa Nacional de DST e Aids; 2008.
- Ministério da Saúde (BR). HIV: estratégias para utilização de testes rápidos no Brasil. Brasília: Secretaria de Vigilância em Saúde – Departamento de DST, Aids e Hepatites Virais; 2010.
- Monico JFG, Dal Póz AP, Galo M, Santos MC, Oliveira LC. Acurácia e precisão: revendo os conceitos de forma acurada. Bol Ciênc Geod sec Comunicações Curitiba [periódicos na internet]. 2009 Jul-Set [acesso em 26 de mai 2019];15(3). Disponível em: https://revistas.ufpr.br/bcg/article/view/15513/10363.
- Kawamura T. Interpretação de um teste sob a visão epidemiológica. Eficiência de um teste. Arq Bras Cardiol. 2002 Out;79(4):437-41.
- Barros E, Dora JM, Xavier RM. Laboratória na Prática Clínica – Consulta Rápida. 3. ed. Porto Alegre: Artmed; 2016.
- Lejon V, Ngoyi DM, Ilunga M, Beelaert G, Maes I, Büscher P, et al. Low specificities of HIV diagnostic tests caused by Trypanosoma brucei gambiense sleeping sickness. J Clin Microbiol. 2010 Ago;48(8):2836-9.
- Barros E, Barros HMT. Medicamentos na Prática Clínica. Porto Alegre: Artmed; 2010.
Correspondência
Renata Almeida Scherdien
Universidade Luterana do Brasil
Av. Farroupilha, 8001 – São José, Canoas – RS, 92425-020
